纤维素酶产生菌的筛选、其酶学性质及对饲料粗纤维降解效果的研究
■胡艳平 王 磊 曹平华 胡雄兵 方明建 陈玉林
(西北农林科技大学动物科技学院,陕西杨凌 712100)
纤维素是地球上最丰富的可再生资源[1],而秸秆纤维素占有很大的比例。由于天然纤维素结构复杂和不易降解,对它的开发利用却有限,造成了资源的很大浪费[2];如何将这些秸秆纤维素转化为可被畜禽利用的饲料成为我们研究的热点,而寻找可有效分解秸秆纤维素的纤维素分解菌,并以此得到足量的纤维素分解酶是一个有效途径[3]。纤维素酶既能有效地分解纤维素,又不会造成环境污染。自20世纪初Seillieve发现蜗牛消化液纤维素酶以来,纤维素酶的生物降解作用便成了关注的焦点[4]。关于微生物资源,研究得最多的是真菌,但其不足之处在于其菌剂难保存或难将其制成菌剂,不利于工业化生产。近年来,陆续出现了芽孢细菌可有效降解纤维素的报道,产芽孢细菌因芽孢的形成,具有适应性强、作用底物广泛及耐高温的明显优势[5]。提高纤维素酶的热稳定性可提高反应温度,加快降解速度、节省反应时间,所以研究耐热纤维素酶及其产生菌具有重要的实用价值,而秸秆纤维素的微生物降解是作为秸秆发酵饲料的最有前景的方法之一,产酶菌株直接作用于秸秆纤维素又是微生物降解中一项最基础的研究工作,但这种研究目前并不多见。因此,本试验从桑天牛排泄物中分离、筛选出产耐热纤维素酶的芽孢杆菌,对其种属进行鉴定,并研究其酶学特性和对麸皮、麦草秸秆、燕麦秸秆3种饲料粗纤维的降解效果,为该菌商业化生产纤维素酶奠定基础,并为秸秆纤维素的高效利用,解析其结构与功能的关系提供参考。
1 材料与方法
1.1 材料
1.1.1 样品采集
桑天牛幼虫采自陕西省安康市桑种场桑树种植基地,收集其排泄物保存于4℃冰箱中备用。
1.1.2 菌株和质粒
大肠杆菌E.coli DH5α购自北京天根生物公司,载体pGEM-T Easy Vector购自Promega公司。
1.1.3 培养基
筛选培养基:蛋白胨10 g、羧甲基纤维素钠(CMC-Na)10 g、氯化钠5 g、琼脂粉15 g、蒸馏水1 L,用缓冲液调至不同pH值,121℃高压灭菌20 min。
种子培养基:蛋白胨10 g、酵母抽提物5 g、氯化钠5 g、蒸馏水1 L,pH值7.0,121℃高压灭菌20 min。
基础产酶培养基:蛋白胨10 g、羧甲基纤维素钠(CMC-Na)10 g、酵母抽提物5 g、氯化钠5 g、蒸馏水1 L,pH值7.0,121℃高压灭菌20 min。
发酵产酶培养基:每50 ml种子培养基中各加入2.00 g麸皮、麦草秸秆、燕麦草粉,pH值7.0,121℃高压灭菌20 min。
1.1.4 酶和试剂
基因组提取试剂盒购自北京百泰克公司,TA克隆试剂盒购自Promega公司,Taq酶及生化材料购自Takara公司;限制性核酸内切酶、T4DNA连接酶购自Promega公司;NaCl、NaOH、H2SO4、葡萄糖、羧甲基纤维素钠(CMC-Na)、3,5-二硝基水杨酸、刚果红、酚酞、甲基红等购自西安沃尔森、杨凌三利化玻仪器公司;胰蛋白胨、酵母提取物购自OXOID公司。
1.2 方法
1.2.1 菌株的分离及筛选
称取0.1 g桑天牛排泄物溶于1 ml灭菌水中,10倍稀释后,取0.1 ml涂布于筛选培养基,37℃恒温培养24 h。挑取不同形态、长势良好的菌株划线分离纯化。将各纯化菌株梯度稀释(10-1、10-3、10-5、10-7)后,取适量涂布于筛选CMC培养基,37℃培养24 h。选取适宜生长密度的CMC平板,1 mg/ml刚果红溶液染色1 h,1 M的NaCl溶液脱色30 min,观察透明圈大小,选择H/C值(透明圈与菌落直径大小之比)大的菌株进行后续研究。
1.2.2 纤维素酶活力测定
将筛选得到的菌株接种到基础产酶培养基中,37℃、220 r/min培养一定时间后,制备粗酶液,参照文献[6]测定羧甲基纤维素酶(CMCase)酶活力,并稍作改进。在25 ml透明比色管中加入2 ml 1%的羧甲基纤维素钠作为底物,预热5 min,然后加入0.1 ml粗酶液,水浴5 min,迅速加入2.5 ml 3,5-二硝基水杨酸显色液终止反应,煮沸5 min(另取1管作空白对照,即在25 ml的比色管中分别加入2 ml 1%的羧甲基纤维素钠、2.5 ml 3,5-二硝基水杨酸溶液和0.1 ml经煮沸30 min灭活的粗酶液,迅速混匀后沸水浴加热5 min);冷却后,定容至10 ml,混匀;用空白管调零,于540 nm波长下测定OD值,根据葡萄糖标准曲线计算酶活力。将在上述条件下每分钟由底物羧甲基纤维素分解产生1 μmol还原糖所需的纤维素酶量定义为一个纤维素酶活力单位,用U/ml表示。
1.2.3 菌株种属的鉴定
1.2.3.1 菌株的形态学鉴定
将筛选到的产纤维素酶菌株平板划线,观察其菌落形态,并经革兰氏染色后于显微镜下观察。
1.2.3.2 菌株16S rDNA鉴定
以菌株的基因组DNA为模板,用16S rDNA通用引物(F∶5'-AGAGTTTGATCCTGGCTCA-3',R∶5'-AAGGAGGTGATCCAGCC-3'),扩增 16S rDNA 片段,克隆到pGEM-T Easy载体上,转化E.coli DH5α,挑选阳性克隆,PCR和酶切鉴定后进行测序;阳性质粒命名为pGEM-16S。
1.2.4 产酶条件优化
1.2.4.1 培养时间对菌株HY3生长和产酶的影响
将菌株HY3种子液接种于(接种量为2%)50 ml基础产酶培养基中,37℃、220 r/min摇瓶培养,于不同培养时间取样测定OD595值和纤维素酶活性。
1.2.4.2 培养基初始pH值对菌株HY3生长和产酶的影响
将菌株HY3种子液分别接种(接种量为2%)到50 ml初始pH值为3、4、5、6、6.5、7、7.5、8、9、10、11的基础产酶培养基中,在1.2.4.1确定的适宜培养时间下,37℃、220 r/min摇瓶培养结束后测定OD595值和纤维素酶活性。
1.2.5 纤维素酶特性研究
产酶条件及初始培养基经过优化后,将种子培养液按2%的比例接种于基础产酶培养基中,于37℃、220 r/min摇瓶培养一定时间后,制备粗酶液。
1.2.5.1 酶促反应的最佳温度及酶的热稳定性
将粗酶液与反应底物混合后,分别在30、40、50、60、65、70、75、80、90、100 ℃的温度下反应,测定酶活力。酶的热稳定性的测定方法为将粗酶液分别在 30、40、45、50、55、60、65、70、75、80、90、100℃温度下保温1 h后,按常规方法于最佳反应温度条件下测定酶活力,以未经处理的粗酶液的酶活力100%计。
1.2.5.2 酶促反应的最佳pH值及酶的酸碱稳定性
将粗酶液与底物组成的反应体系用缓冲液调至分别为3.5、4.5、5、5.5、6、6.5、7、7.5、8、9、10的不同pH值,于最佳反应温度条件下测定粗酶液的纤维素酶活力。酶的酸碱稳定性的测定方法为将粗酶液于pH值为3.5、4.5、5、5.5、6、6.5、7、7.5、8、9、10、11的缓冲液中37℃水浴保温1 h,按常规方法于最适条件下测定酶活力,以未经处理粗酶液的酶活力100%计。
1.2.6 菌株HY3对饲料粗纤维降解效果的研究
产酶条件及初始培养基经过优化后,将种子培养液按2%的比例分别接种到含有2.0 g麸皮、麦草秸秆和燕麦草粉的发酵产酶培养基中,每种底物设置3个重复和1个未加菌液的空白对照,于37℃、220 r/min分别培养一定时间后,4℃、5 000 r/min离心10 min制备粗酶液。然后将残渣全部转入已恒重的300目尼龙袋中,恒重后用于测定粗纤维含量。原料和残渣粗纤维含量用尼龙袋法[7]测定,并计算粗纤维降解率。
1.2.7 数据分析
用Excel进行数据整理,SPSS11.5进行统计分析,显著水平为0.05。
2 结果
2.1 产纤维素酶菌株的筛选(见表1)

表1 纤维素酶产生菌筛选结果
经过反复筛选,从桑天牛排泄物获得6株H/C值较大的产纤维素酶的菌株,分别命名为HY1、HY2、HY3、HY4、HY5、HY6,其中菌株HY3的H/C值最大,为6.4。由表1可知,6株菌纤维素酶活力测定结果显示:菌株HY3的酶活最高,为2.9 U/ml,因此选取菌株HY3作为进一步研究对象。
2.2 菌株的鉴定
2.2.1 菌株HY3的形态学鉴定(见图1)
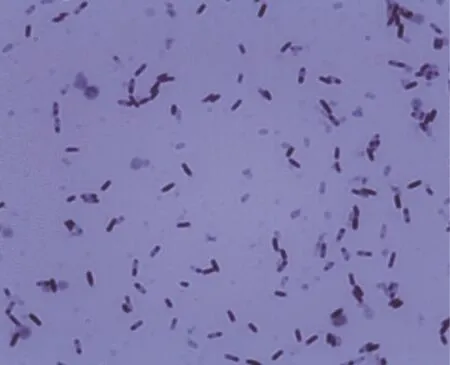
图1 革兰氏染色结果
菌株HY3在LB平板上37℃培养12 h后,其菌落为椭圆形,边缘不齐,菌落呈灰白色。革兰氏染色后,菌体呈杆状,两端钝圆,有芽孢,革兰氏阳性。
2.2.2 菌株种属鉴定(见图2)
以菌株HY3的基因组DNA(图2-A)为模板,用16S rDNA通用引物扩增获得菌株的16S rDNA基因片段,大小约为1.5 kb(图2-B)。质粒pGEM-16S经双酶切后产生700 bp片段和800 bp片段(图2-C),说明菌株HY3 16S rDNA被成功克隆和转化。
通过同源性比对发现该菌株的16S rDNA序列与地衣芽孢杆菌属(Bacillus licheniformis)细菌的16S rDNA序列同源性达到99%,再根据该细菌筛选时的菌落形态和革兰氏染色结果,综合分析确定该菌株为地衣芽孢杆菌属,命名为Bacillus li⁃cheniformis HY3。
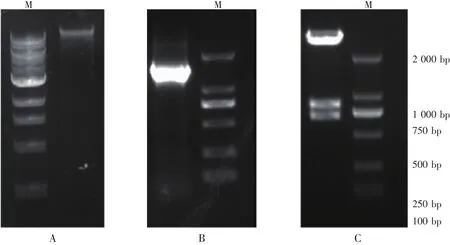
图2 细菌基因组DNA、PCR产物和酶切电泳图
2.3 菌株HY3产酶条件优化
2.3.1 菌株HY3液体培养的生长曲线(见图3)
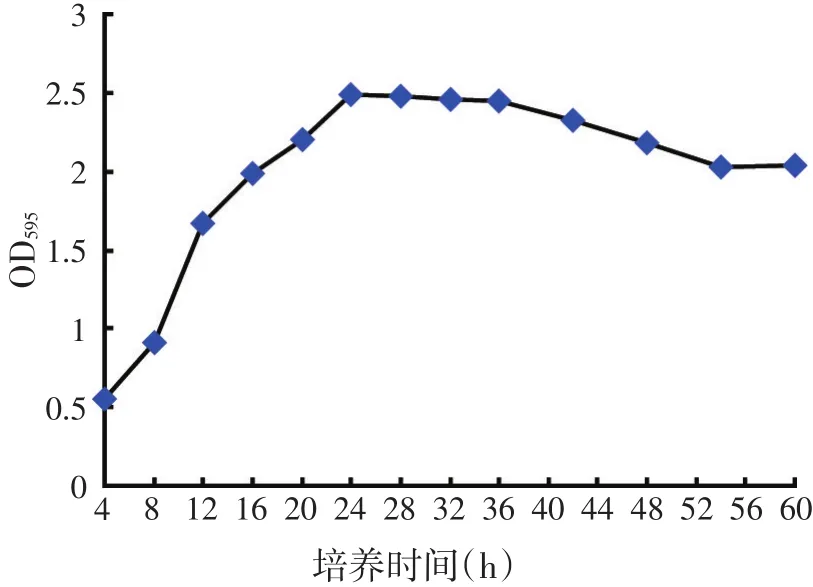
图3 菌株HY3生长曲线
由生长曲线可知,在4~24 h,曲线呈上升趋势;24~30 h时达到最高峰,而30 h以后呈缓慢下降趋势。所以确定菌株的对数生长期在8~24 h之间,因为对数生长期菌体活力旺盛,所以应选择培养18 h种子液进行接种,最佳产酶时间为24 h。
2.3.2 菌体产酶的最佳培养时间(见图4)
如图4所示,纤维素酶活力随着培养时间呈现先上升后下降的规律。纤维素酶活力在发酵8 h后大幅上升,至24 h时最高,为2.95 U/ml,随后逐渐降低。该结果与菌体生长曲线(图3)基本一致,因此确定菌株HY3产酶最佳培养时间为24 h。
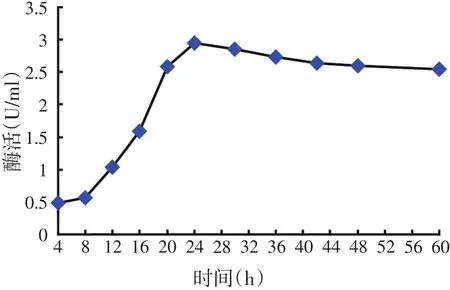
图4 培养时间对菌体产酶的影响
2.3.3 菌体生长及产酶的培养基最佳初始pH值(见图5)
如图5所示,菌株在pH值3.0~11的培养基中都能生长;在pH值3.0~6.5范围内,随着培养基初始pH值的升高,纤维素酶活力呈现上升趋势,pH值为6.0~7.5时酶活力较高,最高值为2.99 U/ml;当pH值大于8时,其酶活力逐渐降低。表明该菌株在中性偏酸、偏碱(pH值6.0~8.0)环境中能很好地生长,并保持较高的产酶量,故确定菌株HY3生长、产酶的最适pH值为6.5~7。
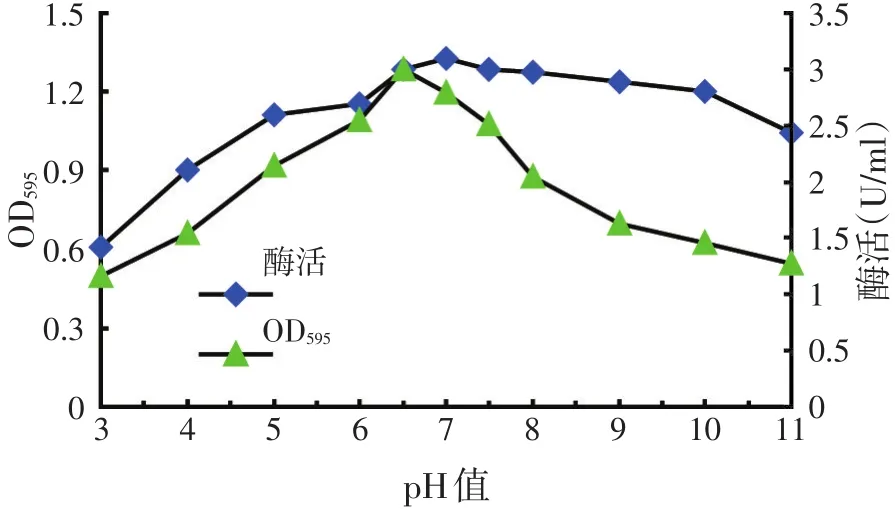
图5 培养基初始pH值对HY3菌株生长和产酶的影响
2.4 菌株HY3酶学性质分析
2.4.1 酶反应的最适温度(见图6)
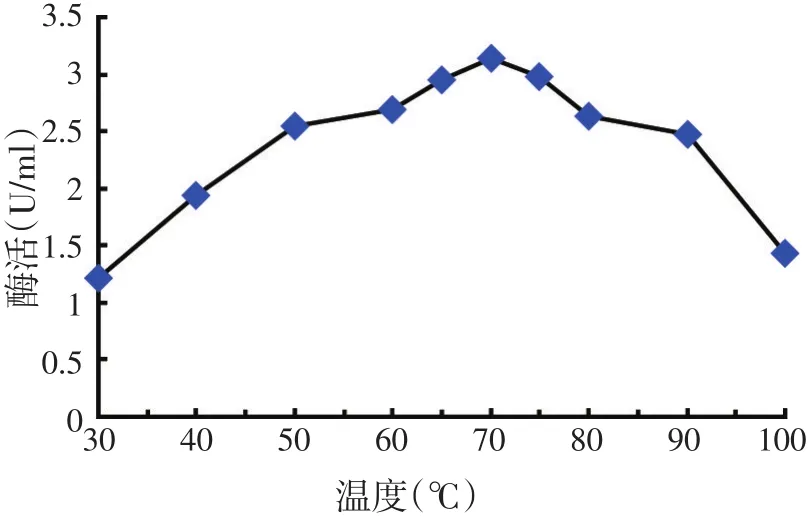
图6 温度对酶活力的影响
如图6所示,在30~70℃范围内,酶活力随温度升高而上升,70℃最高,达到3.14 U/ml,在70~100℃范围内,酶活力随温度升高而迅速降低,由此说明该酶的最适反应温度为70℃,该菌株产生的纤维素酶的最适反应温度比报道的大多数细菌和真菌都要高。
2.4.2 酶的热稳定性(见图7)
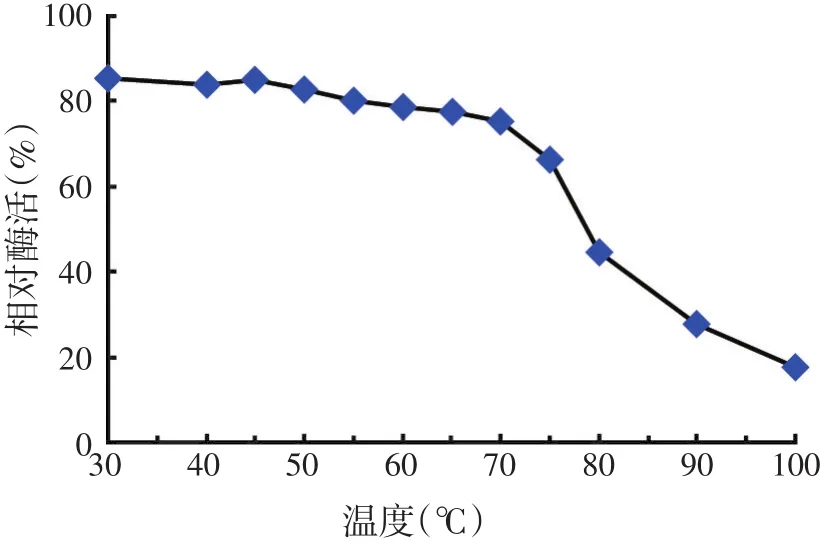
图7 温度对酶稳定性的影响
如图7所示,55℃以下酶的稳定性较好,相对酶活力在80%以上,当温度超过75℃时,相对酶活力随着温度的升高而迅速下降,但在90℃保温1 h后仍有30%以上的活力,说明菌株HY3产生的纤维素酶耐热性较好。
2.4.3 酶反应的最适pH值(见图8)
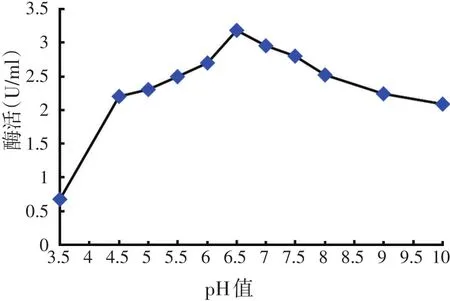
图8 pH值对酶活力的影响
如图8所示,该菌株产生的纤维素酶在pH值5~9之间有较高的酶活力,pH值为6.5时酶活力最高,达到3.18 U/ml。说明菌株HY3产生的纤维素酶催化活性能适应较宽的pH值范围。
2.4.4 酶反应的酸碱稳定性(见图9)

图9 酶在不同pH值条件下的稳定性
如图9所示,粗酶液在pH值6~8范围内,相对酶活力可保持80%以上,pH值小于4.5和大于10时,该酶的稳定性较差,说明菌株HY3产生的纤维素酶对强酸碱的耐受力较差,而在中性偏酸、偏碱条件下具有较好的稳定性,适于液体发酵。
2.5 菌株HY3对饲料粗纤维降解效果
2.5.1 不同饲料对菌株HY3产酶的影响(见图10)
将分别添加有麸皮、麦草秸秆和燕麦秸秆的发酵培养基,220 r/min、37℃摇瓶培养24 h后,制备粗酶液,按常规方法于70℃(反应pH值为6.5)测定酶活力。结果如图10所示,该菌在添加麸皮的培养基中产纤维素酶的能力最强,达到5.01 U/ml,燕麦草粉次之,麦草秸秆培养基中检测到酶活力最低,为3.66 U/ml。说明不同培养底物对菌株HY3的产酶影响比较大,这可能与底物的营养成分有关系。
2.5.2 粗纤维降解能力的分析(见表2)
如表2所示,随培养时间的延长,麸皮、燕麦秸秆和麦草秸秆的粗纤维降解率无明显变化(P>0.05)。其中,麸皮的粗纤维降解率最高,最高为7.41%;麦草与燕麦秸秆的粗纤维降解率在4.89%~5.8%之间。菌株HY3对3种饲料粗纤维降解率的差异,与3种粗饲料作为不同底物对菌株HY3产酶的影响密切相关。麸皮为底物时,HY3的酶活最高,因此粗纤维的降解率最高,麦草秸秆为底物时,酶活最低,相应的降解率也是最低。
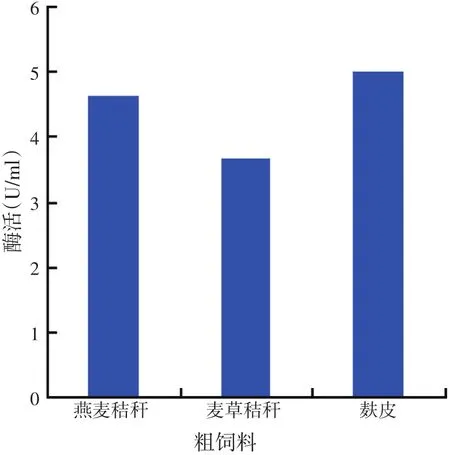
图10 3种粗饲料对菌株HY3产酶的影响

表2 不同处理时间3种饲料粗纤维的降解率(%)
3 讨论
3.1 产纤维素酶菌株的筛选与鉴定
纤维素酶广泛存在于动植物体内和微生物中;而天牛蛀食树木,主要通过消化纤维素获得养分[8],其体内纤维素酶一般有内源性和外源性两种。近些年来,从天牛肠道中筛选出了能产纤维素酶的细菌。曹月青等(2001)从桑粒肩天牛肠道中分离到1株纤维素分解菌[9];刘晨娟等(2010)从桑粒肩天牛肠道中筛选到能降解纤维素的细菌,经鉴定为枯草芽孢杆菌[10]。为从天牛体内发掘新的降解纤维素的微生物,本试验以桑天牛排泄物为材料,利用刚果红染色产生透明圈的方法进行初筛,用DNS法测定发酵液酶活进行复筛,筛出1株产纤维素酶的菌株,并采用细菌形态学和分子生物学的方法对其种属进行鉴定,该菌株为地衣芽孢杆菌属。
3.2 不同发酵时间菌株HY3生长及产酶分析
本试验结果显示,随着培养时间的增长,菌株的产酶活力呈现出先上升后下降的趋势,在培养24 h时酶活力达到最大值。这可能与细菌所处不同生长阶段有关,细菌在对数生长期(12~24 h)快速增殖,因而表现出酶活急剧上升;菌体生长进入稳定期后,由于营养物质逐渐耗尽,有害代谢产物不断积累,导致细菌死亡速率大于增殖速率,从而导致菌株在培养36 h后产酶活力的显著下降[11-12]。
3.3 酶耐热特性研究
纤维素酶一般作为酶制剂添加到饲料中,由于饲料加工工程的特殊要求,适合于饲料中使用的酶必须具有好的热稳定性,因此对酶的耐热性的研究非常必要[13-14]。李旺等(2012)对耐热菌B.subtilis DR研究发现,其最适温度为50℃[15];而贺芸(2006)发现,嗜热脂肪芽孢杆菌的最适温度为66℃[16]。本试验中,通过分析菌株HY3产生的纤维素酶性质发现,该酶最适反应温度为70℃;在75℃下保温1 h,其相对酶活力为65%,在90℃保温1 h后仍有30%左右的活力,表明该菌分泌的纤维素酶具有较高的耐热性,显示出更大的应用潜力。
3.4 菌株HY3对不同粗饲料降解率效果的分析
本试验中,添加麸皮和燕麦秸秆的培养基中菌株产酶活力较麦草的高,这可能与麸皮和燕麦秸秆所含的营养成分较丰富有关,其所含蛋白质分别为14%和19.42%,具有十分丰富的植物蛋白质资源[17],可为菌株提供丰富的碳源和氮源。另外,3种饲料的粗纤维降解率随培养时间的增长无明显差异,但麸皮的粗纤维降解率最高,最高可达7.41%,麸皮与燕麦秸秆在纤维素降解率所表现出的差异,可能与其纤维素含量有关,麸皮粗纤维含量较低,仅10%左右,从而表现出较高的粗纤维降解率。而麦草表现出的酶活力和降解率较低,可能与其细胞壁结构较致密、纤维素含量较高有关。
3.5 尼龙袋法测定粗纤维降解率的分析
目前,测定粗纤维的方法有很多,如近红外漫反射光谱测定法、滤袋分析法、二次萃取快速测定法等。这些方法都能方便、简单、快速地测定饲料中粗纤维的含量,但由于这些方法大多需特定的仪器,价格昂贵,很难在所有的实验室中普及应用。比较而言,使用尼龙袋法测定粗纤维,既能减少残渣转移的次数,缩短试验时间,又可以保持传统方法的准确度。吴秋珏等(2005)[7]对传统方法与尼龙袋法的测定结果进行比较,认为选用260目尼龙布测定粗纤维降解率时,其结果与传统方法差异不大。但本试验中选用300目尼龙布的测定时,发现仍有少量损失。因此,用尼龙袋法测定粗纤维时,针对不同粗饲料(如麸皮、麦草秸秆和燕麦秸秆)选用适宜目数的尼龙袋尚需进一步研究。
4 结论
①本试验通过刚果红染色初筛和测定粗酶液酶活力复筛,从桑天牛排泄物中筛选到一株能够分解纤维素的细菌,经形态学和细菌16S rDNA鉴定,该细菌为地衣芽孢杆菌属,命名为Bacillus licheniformis HY3。
②菌株HY3的适宜生长和产酶pH值为6.5~7,生长和产酶最佳培养时间为24 h。该菌产生的纤维素酶的最适反应温度为70℃,75℃保温1 h后仍有65%以上活力,在90℃保温1 h仍有30%左右的活力,显著高于报道水平,属于耐热性纤维素酶;在pH值6.5时酶活最高,而且在较宽的pH值范围内都具有较高的反应活性,但对强酸碱的耐受力较差,在中性条件下具有较好的稳定性。
③菌株HY3在添加麸皮的培养基中纤维素酶活性(5.01 U/ml)和对粗纤维的降解率(7.41%)均最高;在添加麦草的培养基中酶活性和对粗纤维的降解率均最差;饲料粗纤维的降解率随时间的变化不大。

