孤立性纤维性肿瘤的CT和MRI表现
王关顺,刘云霞,高得培,董兴祥
孤立性纤维性肿瘤(solitary fibrous tumors,SFT)是一种临床少见的梭形细胞软组织肿瘤,1931年由Kemperer和Robin首次报道,全身各部位均可发生[1]。本文回顾性分析经手术病理证实的21 例SFT 的CT及MRI表现,旨在提高对该病的认识。
材料与方法
1.临床资料
搜集本院2007年10月-2011年12月经手术或穿刺病理证实的21例SFT 患者,其中男12例,女9例,年龄28~73岁,平均48.2岁。临床多以局部肿块及疼痛就诊,发生于颅内的1例以头痛伴言语减少3月就诊,1例以左上肢及左胸壁麻木3天就诊。
2.检查方法
所有患者均行CT平扫及增强扫描,其中8例行MRI平扫及增强扫描。CT扫描采用德国Siemens Somatom Sensation 16层螺旋CT,管电压120kV,管电流140mA,层厚5~8mm,增强扫描采用高压注射器经肘静脉注射碘海醇(300mg I/ml)1.5ml/kg,注射速率3.5ml/s,腹部增强扫行2期或3期扫描(动脉期延迟25s,门静脉期延迟60s,实质期延迟90s),腹部以外部位如胸腔、颅脑、下肢等部位,行动脉期及实质期增强扫描。MRI扫描采用Siemens Avanto Iclass 1.5T磁共振扫描仪,层厚5~6mm,层间隔1mm,T2WI:TR 3200ms,TE 98ms,averages 2,矩阵320×275;T1WI:TR 450ms,TE10ms,averages 1,矩阵256×224;DWI:TR 4500ms,TE 87ms,averages 6,矩阵160×112,层厚4~5mm,层间隔0mm,b=0、1000s/mm2;增强T1WI采用Vibe序列扫描,层厚4mm,TR 4.09ms,TE 2.26ms,averages 1,对比剂采用钆喷替酸葡甲胺(Gd-DTPA),剂量0.1 ~0.2mmol/kg,注射速率3ml/s。
3.影像分析
由两名有经验的高年资放射科医师对CT及MRI检查结果行双盲法阅片,分析肿瘤的位置、大小、形态、边缘、密度或信号特点、强化方式及与相邻器官的关系。病灶增强前后密度或信号改变采用与周围正常肌肉软组织对比的方法。
结 果
1.病灶部位
21例SFT 中发生于颅内2例,腹、盆腔3例,胸腔7例,下肢3例,右侧咬肌1例,左额部1例,右锁骨上1例,骶尾部1例,腹膜后1例,右髂部1例。
2.CT表现
CT均能很好地显示病灶本身及其与周围结构的关系,肿瘤呈圆形或类圆形13例,不规则形8例,有分叶征者7 例。肿瘤最大径线3~22.6cm(平均9.8cm)。边界清晰者14例,包膜完整或不完整,边界不清者7例,无包膜或包膜不完整,平扫密度均匀或欠均匀,平扫呈等密度者19例,高密度者2例,平扫CT值25~52HU,增强多为持续性强化(图1、2),动脉期轻中度强化,实质期、延迟期明显强化,强化最显著者CT值约159HU,所有病例增强后均强化不均,16例病灶内见大小不一斑片状低密度无强化区,3例病灶内有钙化,2例侵犯邻近骨质。
3.MRI表现
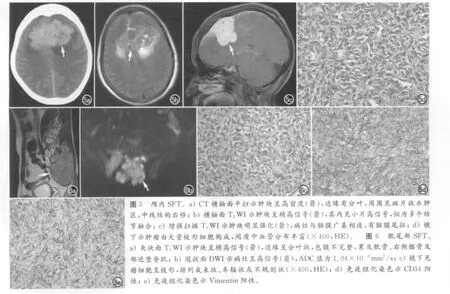
MRI可清楚显示肿瘤部位及受累范围,边缘清晰者6例,边缘不清者2例,T1WI呈等低信号,T2WI呈稍高或高信号,信号不均,增强明显强化(图3),2例肿块内可见血管流空信号(图4),1例似有多结节融合倾向。2例可见病灶周围水肿表现(图5)。1 例侵犯邻近骨质,致相应骨质不规则破坏(图6)。1例与脑膜关系密切,表现为肿瘤基底部与脑膜相连,临近脑膜增厚、强化,可见“脑膜尾征”(图5c)。有4例行DWI检查,3例呈高信号,1例呈稍高信号,ADC 值为(0.78~1.29)×10-3mm2/s。
4.病理学表现
SFT 镜下见瘤细胞呈卵圆至长梭形,胞浆红染,核仁不明显,无明显异型性,细胞密集区与细胞稀疏区交替排列,呈束状、车辐状或不规则状,瘤细胞间胶原纤维变性,间质中血管分布丰富(图4b、5d、6c)。全组病例均行免疫组化染色,CD34 阳性100%(21/21),Vimentin阳 性95.2%(20/21),Bcl-2 阳 性85.7%(18/21),CD99阳性23.8%(5/21),CD56阳性14.3%(3/21),CD20 阳性9.5%(2/21),全组CK 阴性,S-100阴性(图6d、6e)。
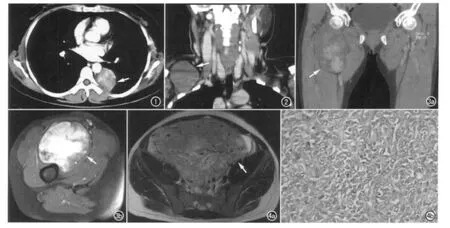
图1 左胸膜SFT,CT增强实质期示边界清楚的圆形软组织肿块(箭),强化明显,CT值100HU,肿瘤强化方式为持续性强化。图2 右锁骨上SFT,CT增强扫描示病灶呈类圆形(箭),边界清楚,包膜完整,呈中等强化。 图3 右大腿SFT。a)CT冠状面增强扫描示病灶强化不均(箭),呈地图样强化,边界清楚;b)MRI横轴面增强扫描示肿块强化明显(箭)。 图4 盆腔SFT。a)横轴面T2WI示肿块呈稍高信号(箭),其内见丰富的血管流空信号,肿块大小约22.6cm×21.3cm×11.4cm;b)镜下示肿瘤细胞为卵圆至长梭形,胞质稀少,胞浆红染,核仁不明显,无明显异型性,细胞疏密不均,细胞密集区与细胞稀疏区交替排列(×400,HE)。
讨 论
SFT 是一种少见的起源于间质细胞的软组织肿瘤,约占所有软组织肿瘤的0.6%,瘤细胞具有向成纤维细胞/肌纤维母细胞转化倾向[2]。SFT 可发生于全身各个部位,如颅内、椎管内、头颈部、胸腔、腹膜后、腹腔、盆腔、四肢等处,以发生于胸腔最常见[3-5]。本组发病部位也以胸腔33.33%(7/21)最常见,其次为下肢14.29%(3/21),腹、盆腔14.29%(3/21),颅内9.5%(2/21)。SFT 可发生于任何年龄,范围5~87 岁,平均51岁,无性别差异。本组发病年龄与性别与文献报道相似。临床表现与肿瘤发生部位、大小、良恶性有关,多表现为局部肿块及压迫症状,发生于中枢神经系统者可出现疼痛、肢体感觉、运动障碍、抽搐等表现。文献报道部分SFT 可出现低血糖、杵状指、肥大性肺性骨关节病等副肿瘤综合征表现,本组未出现此类临床表现。
SFT 典型CT表现为边界清楚或不清楚的孤立性软组织肿块[2,6-7],呈圆形、椭圆形或不规则形,本组肿瘤圆形或类圆形13例,包膜多完整,境界清楚,不规则形8例,境界多不清楚,可见小分叶,包膜不完整或无包膜。肿瘤体积一般较大,本组肿瘤最大直径3~22.6cm(平均9.8cm),主要与大部分SFT 是良性病变有关,其临床病程多呈慢性,早期发现困难。密度均匀或不均匀,肿瘤囊变、坏死、出血多见,钙化少见。本组16例肿瘤内见斑片状低密度区,这主要与肿瘤内囊变坏死、黏液样变性有关,病灶内有钙化者3例。增强早期不均匀强化,与肿瘤组织富含血管有关,延迟期呈明显或中等强化,瘤内显著强化区代表细胞密集区及富血管区,而细胞稀疏区与胶原纤维丰富区相对强化较轻。本组所有病例均呈不均匀强化,肿瘤血供丰富,18例病灶内可见到较多强化血管。2 例病灶向周围浸润,侵犯邻近骨质引起临近骨质破坏。
MRI的信号差异反映了肿瘤组织学成分的不同[6-8],T2WI呈低信号的肿瘤胶原纤维丰富,瘤细胞较少,T2WI呈高信号的肿瘤细胞密集,血管丰富,MRI上可见肿瘤内大量点条状流空信号,肿块较大者T2WI上呈混杂信号,其内等或稍高信号区为肿瘤实质部分,增强明显强化,其内片状高信号区为肿瘤囊变、坏死、出血区,增强无强化。本组8例SFT 在MRI上表现为边界清楚或不清楚的孤立性肿块,T1WI呈等低信号,T2WI以稍高或高信号为主,增强强化明显,形态多不规则,其中1例有多结节融合倾向,1例累及临近骨质,1 例与脑膜关系密切,与文献报道相符[8]。本组3例DWI上呈高信号,1 例呈稍高信号,ADC值(0.78~1.29)×10-3mm2/s,反映肿瘤组织不同程度扩散受限,ADC 值减低区代表肿瘤细胞密集区。
SFT 需要与各种肉瘤、胃肠道间质瘤、胸膜间皮瘤、侵袭性纤维瘤病、脑膜瘤等相鉴别[9]。发生于胸腹部及四肢的SFT 需与各种肉瘤鉴别,肉瘤一般较大,边界不清,密度或信号不均,T2WI多呈高信号,增强强化不均,钙化相对较SFT 多见,而SFT 肿块边界相对清楚,T2WI呈等低信号。胃肠道间质瘤是消化道最常见的间叶组织源性肿瘤,肿块可向腔内外生长,边界较清,即使肿块较大对周围组织的浸润亦较轻,较大肿瘤易出现囊变、坏死以及偏心多发小溃疡或窦道样改变是该病的特征性表现,病灶内可出现气体或液面,其强化程度不如SFT。胸膜SFT 主要与恶性胸膜间皮瘤鉴别,恶性间皮瘤病程短,临床症状重,主要表现为多发胸膜结节或胸膜弥漫不规则增厚,极少为单发局限性病变,可侵犯肋骨引起骨质破坏,常合并同侧大量胸腔积液,且大部分间皮瘤在T2WI上呈高信号。侵袭性纤维瘤病好发于肌肉、腱膜和深筋膜等处,以30岁左右的女性多见,局部呈浸润性生长,具有侵袭性,无包膜,影像上呈边界清楚或不清楚的软组织肿块,增强多呈渐进性强化,一般无坏死、无钙化、无脂肪组织,而SFT 多为良性,包膜多完整,肿瘤囊变、坏死、出血多见。发生于中枢神经系统的SFT 需与脑膜瘤鉴别,尤其是纤维母细胞型脑膜瘤,SFT 一般有包膜且T2WI上以低信号为主,增强肿块强化明显且不均匀,一般无钙化,而脑膜瘤则沿脑膜方向生长,有时可见钙化,邻近骨质往往有增生硬化改变,MRI上大部分肿瘤以等T1等T2信号为主或稍长T1稍长T2信号,增强多为均匀强化。
SFT 最终确诊靠病理组织学检查,特别是免疫组织化学染色。因肿瘤起源于CD34阳性的间叶细胞,具有向纤维母细胞转化的特征,免疫组化染色显示CD34、Vimentin、CD99 及Bcl-2 阳性,平滑肌肌动蛋白、S-100和角蛋白一般阴性。本组病例CD34阳性率100%,Vimentin阳性率95.2%,Bcl-2阳性率85.7%,CD99阳性率23.8%,所有病例CK 及S-100阴性,与文献报道相似[1]。
总之,CT能够很好地显示SFT 的位置、形态、大小、边缘、密度、强化特征及其与周围结构的关系,MRI的信号变化能够反映病灶组织学成分的不同,CT和MRI对于早期发现病灶、SFT 的诊断与鉴别诊断、判断病灶与周围组织结构的关系方面具有重要意义。
[1]Wignall OJ,Moskovic EC,Thway K,et al.Solitary fibrous tumors of the soft tissues:review of the imaging and clinical features with histopathologic correlation[J].AJR,2010,195(1):W55-W62.
[2]Ginat DT,Bokhari A,Bhatt S,et al.Imaging features of solitary fibrous tumors[J].AJR,2011,196(3):487-495.
[3]Cardillo G,Lococo F,Carleo F,et al.Solitary fibrous tumors of the pleura[J].Curr Opin Pulm Med,2012,18(4):339-346.
[4]Luciano C,Francesco A,Giovanni V,et al.CTsigns,patterns and differential diagnosis of solitary fibrous tumors of the pleura[J].J Thorac Dis,2010,2(1):21-25.
[5]Herijoelison AR,Cavalleri A,Cucchi JM,et al.Solitary intraperitoneal fibrous tumor:report of three cases[J].Clin Imaging,2011,35(4):315-319.
[6]Zhang WD,Chen JY,Cao Y,et al.Computed tomography and magnetic resonance imaging findings of solitary fibrous tumors in the pelvis:correlation with histopathological findings[J].Eur J Radiol,2011,78(1):65-70.
[7]Kim HJ,Lee HK,Seo JJ,et al.MR imaging of solitary fibrous tumors in the head and neck[J].Korean J Radiol,2005,6(3):136-142.
[8]Weon YC,Kim EY,Kim HJ,et al.Intracranial solitary fibrous tumors:imaging findings in 6consecutive patients[J].AJNR,2007,28(8):1466-1469.
[9]王关顺,谭静,封俊.侵袭性纤维瘤病的CT和MRI表现[J].放射学实践,2011,12(26):1287-1289.