18F-FDG PET-CT在非小细胞肺癌术前分期中的应用价值
王广丽,张成琪,范医鲁,邓凯,宋吉清,陈静
非小细胞肺癌(non-small cell lung cancer,NSCLC)的治疗主要根据其临床分期来进行,术前的准确分期对其治疗和预后具有极其重要的意义。18FFDG PET-CT集功能显像和结构显像于一体,在肿瘤的早期诊断及分期中显示出强大优势,本研究通过对112例NSCLC 患者PET-CT图像的回顾性分析比较其与病理分期的诊断符合率和一致性。
材料与方法
1.临床资料
本研究搜集2003年1月-2008年1月在山东省立医院放射科接受18F-FDG PET-CT显像并经手术病理、支气管镜或穿刺活检证实为112例NSCLC 患者的病例资料进行回顾性分析。其中男78例,女34例,年龄35~90 岁,平均年龄60.5±8.7 岁。其中鳞癌43例,腺癌54 例,细支气管肺泡癌10 例,腺鳞癌2例,大细胞癌2例,细支气管肺泡癌合并腺鳞癌1例。按照Mountain和Dresler制定的肺癌区域淋巴结图谱将淋巴结分为9组评价淋巴结转移[1],阳性淋巴结经手术病理、纵隔镜穿刺活检、CT/超声/气管镜引导下细针穿刺活检或随访证实,所得淋巴结的病理分组与PET-CT的分组相一致。有2 例患者活检证实有远处转移,31例患者根据病史、临床表现、PET-CT、全身骨显像、X线片和/或CT、MRI等影像学表现和随访结果证实有远处转移,每位患者的随访时间均超过12个月,若病灶在随访期间变大或治疗后缩小诊断为转移,随访或治疗期间病灶无变化者认为不是转移病灶[2]。这33例远处转移的患者在行PET-CT检查时有32例显示有远处转移灶,1例是在随访过程中发现病灶增大。
2.检查方法
采用GE Discovery LS PET-CT仪。患者检查前禁食6h,检查前血糖<7mmol/L。注射18F-FDG(GE Minitrace,放化纯>95%)前患者安静、避光、平卧15min,剂量为5.55~7.40MBq/kg,注射后继续静卧约1h。患者排尽尿液后先后行全身螺旋CT扫描和PET 发射扫描,检查范围自OM 基线至股骨上段。CT扫描参数:电压140kV,电流80mA,层厚5mm。PET 扫描使用2D 模式。采用有序子集最大期望值法(ordered-subset expectation maximization,OSEM)对图像进行重建,用对PET 图像进行CT衰减校正(computed tomography attenuation correction,CTAC)。图像融合在XELERIS工作站上实现,一次性得到PET、CT及两者融合的横轴面、矢状面和冠状面图像。
3.图像分析
3名有多年工作经验的PET-CT诊疗中心医师结合目测法和半定量分析法对PET-CT图像进行盲法阅片。目测法是医师直接在显示器上读片,辨别病灶的部位、数目、大小、密度、与周围结构的关系及示踪剂的浓聚程度;半定量分析法是使用PET 分析软件选取病变部位感兴趣区(region of interest,ROI),测量最大标准摄取值(SUVmax)和平均标准摄取值(SUVmean)。SUVmean≥2.5判断为恶性。淋巴结不管大小,表现为放射性浓聚且SUVmean≥2.5判断为转移。但是,当淋巴结出现良性钙化(中心的、斑块状的、弥漫的、层状的或爆米花状的钙化)时,即使出现放射性浓聚也诊断为良性[3-5]。按照少数服从多数的原则做出最终影像学诊断。国际抗癌联盟(UICC)的TNM 分期标准作为肺癌分期依据。
4.统计学分析
采用SPSS 19.0软件进行统计学分析,观察值的一致性采用加权Kappa检验。以P<0.05为差异有统计学意义。
结 果
112例NSCLC原发灶主要表现为病灶部分或全部呈放射性浓聚(图1),SUVmean均>2.5,其中直径≤3cm 的孤立性肺结节有23 例,结节均显示中心FDG 高摄取,部分结节边界欠清晰,考虑是因为呼吸运动的影响。本研究中有2 例肺癌结节<1.0cm,PET-CT均准确诊断,其中1例16层螺旋CT最终漏诊(图2),另1 例为直径0.8cm 的周围型肺癌,SUVmean为3.0。有33例患者有远处转移,PET-CT诊断32例,符合率为96.97%,两者高度一致(kappa=0.957,P=0.000)。术前PET-CT影像分期与术后T分期及术后淋巴结转移分期结果比较差异均无统计学意义(kappa=0.929,P<0.01;kappa=0.928,P<0.01,表1、2)。
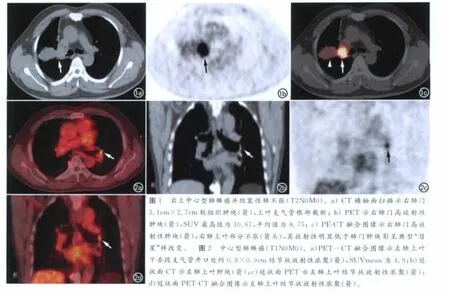
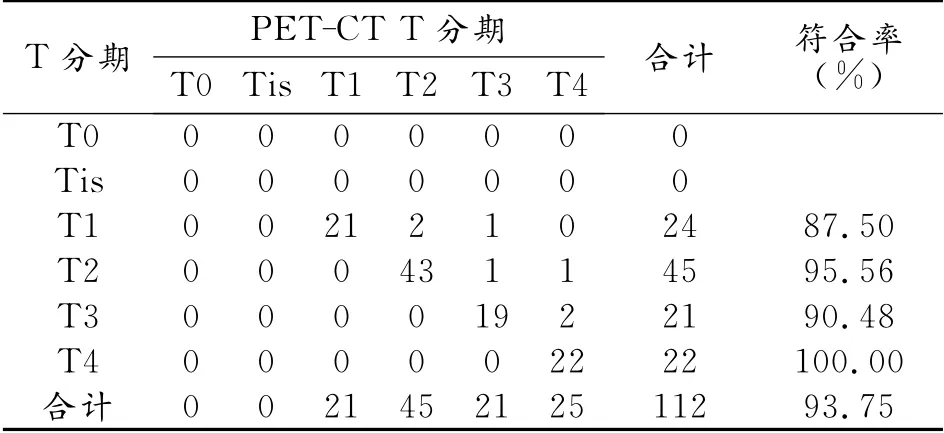
表1 术前PET-CTT分期与术后T分期结果比较 (例)
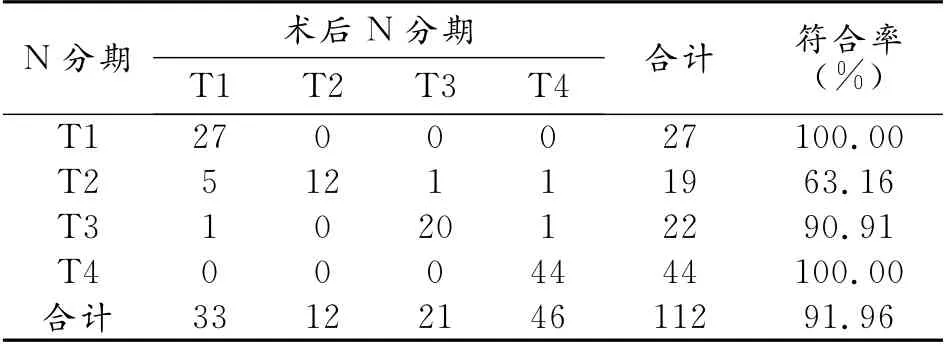
表2 术前PET-CT分期与术后淋巴转移分期结果比较(例)
讨 论
CT是目前最常用的肺癌术前分期的影像学手段,但作为分子成像方法的PET-CT也越来越多的用于提供更精确的TNM 分期。在本研究中,PET-CT对NSCLC的TNM 分期与病理分期显示出高度的一致性,能有效地指导临床制定合理的治疗方案。
对于NSCLC的T 分期,单纯的CT检查很难评价肺癌对胸壁及纵隔的细微侵犯,PET-CT在这方面也没有什么优势,但它可以将肿瘤与邻近膨胀不全的肺组织鉴别(图1),对精确制定放疗靶区减少放疗毒性有很大帮助。Kim 等[6]对33 例伴有胸腔积液的NSCLC患者进行分析以评价PET-CT对恶性胸腔积液及胸膜侵犯的诊断价值,结果证实PET-CT是比较可靠的鉴别胸膜良恶性病变的检查方法。但是,对于<1.0cm 的孤立性肺结节,考虑到空间分辨力及部分容积效应的影响,用PET-CT判定其良恶性具有一定的挑战性,尤其是<5mm 的孤立性肺结节常呈假阴性,因为目前PET 的空间分辨力约为5~6mm,CT也常没有特征性的表现。本研究中涉及的原发肿瘤直径偏大,最小直径约8mm,这可能是本研究中PET-CT对T 分期诊断符合率高于以往文献的原因[7-9]。
临床实践中,鉴别转移淋巴结与增生淋巴结及淋巴结结核是项富有挑战性的工作,PET-CT对此有一定的帮助,但研究结果也不尽一致。Lv 等[10]从330篇文献报道中挑选出14篇用meta分析进行统计分析,证实了PET-CT对淋巴结转移的诊断有较高的特异性,但同时也提示不能完全依靠PET-CT的结果来判断有无淋巴结转移。有研究显示PET-CT对纵膈淋巴结转移的阴性预测值为98%,准确度为93%,若PET-CT上无阳性发现,则可以直接行开胸手术而不必再行纵膈镜进行分期,若PET-CT上有阳性发现,则必须由病理组织 学来验证[11]。Sánchez等[12]研究显示18F-FDG PET-CT对N2分期的诊断有较高的敏感度、特异度和阳性预测值,分别为97.4%、100%和100%,但也有的文献显示对于T1 的NSCLC 患者,PET-CT诊断N2的敏感度较低[13]。本研究中,PETCT对N2的诊断符合率较高,但对N1的诊断符合率较低,可能与病例选择和淋巴结大小及数目有关。本研究中PET-CT显示假阴性的淋巴结转移皆因病变太小低于PET-CT空间分辨力,或仅为淋巴结内的微转移而未发现;当肺癌与肺内炎症、结核同时存在时,肺门、纵膈淋巴结可呈假阳性。
多项研究证实PET-CT是判断远处转移较好的无创性检查手段[8,14-18],Alonso等[18]用PET-CT评 价NSCIC纵膈淋巴结侵犯时发现了隐匿性胸腔外的转移,从而更改了患者的治疗方案,证实PET-CT可以作为隐匿性远处转移的补充诊断方法。另外,PETCT探测骨转移也明显优于骨显像[19]。
[1]Mountain CF,Dresler CM.Regional lymph node classification for lung cancer staging[J].Chest,1997,111(6):1718-1723.
[2]Ohno Y,Koyama H,Onishi Y,et al.Non-small cell lung cancer:whole-body MR examination for M-stage assessment-utility for whole-body diffusion-weighted imaging compared with integrated FDG PET/CT[J].Radiology,2008,248(2):643-654.
[3]Shim SS,Lee KS,Kim BT,et al.Non-small cell lung cancer:prospective comparison of integrated FDG PET/CTand CTalone for preoperative staging[J].Radiology,2005,236(3):1011-1019.
[4]Kim BT,Lee KS,Shim SS,et al.Stage T1non-small cell lung cancer:preoperative mediastinal nodal staging with integrated FDG PET/CTa prospective study[J].Radiology,2006,241(2):501-509.
[5]Kim YK,Lee KS,Kim BT,et al.Mediastinal nodal staging of nonsmall cell lung cancer using integrated18F-FDG PET/CTin a tuberculosis-endemic country:diagnostic efficacy in 674patients[J].Cancer,2007,109(6):1068-1077.
[6]Kim BS,Kim IJ,Kim SJ,et al.Predictive value of18F-FDG PET/CTfor malignant pleural effusion in non-small cell lung cancer patients[J].Onkologie,2011,34(6):298-303.
[7]Pauls S,Buck AK,Hohl K,et al.Improved non-invasive T-Staging in non-small cell lung cancer by integrated18F-FDG PET/CT[J].Nuklearmedizin,2007,46(1):9-14.
[8]De Wever W,Ceyssens S,Mortelmans L,et al.Additional value of PET-CTin the staging of lung cancer:comparison with CTalone,PET alone and visual correlation of PET and CT[J].Eur Radiol,2007,17(1):23-32.
[9]Yi CA,Shin KM,Lee KS,et al.Non-small cell lung cancer stag-ing:efficacy comparison of integrated PET/CTversus 3.0T whole-body MR imaging[J].Radiology,2008,248(2):632-642.
[10]Lv YL,Yuan DM,Wang K,et al.Diagnostic performance of integrated positron emission tomography/computed tomography for mediastinal lymph node staging in non-small cell lung cancer:a bivariate systematic review and meta-analysis[J].J Thorac Oncol,2011,6(8):1350-1358.
[11]Tasci E,Tezel C,Orki A,et al.The role of integrated positron emission tomography and computed tomography in the assessment of nodal spread in cases with non-small cell lung cancer[J].InteraCTCardioVasc Thorac Surg,2010,10(2):200-203.
[12]Sánchez Sánchez R,Rodríguez Fernández A,Gómez Río M,et al.Utility of PET/CTfor mediastinal staging of non-small cell lung cancer in stage III(N2)[J].Rev Esp Med Nucl,2011,30(4):211-216.
[13]Shin KM,Lee KS,Shim YM,et al.FDG PET/CTand mediastinal nodal metastasis detection in stage T1non-small cell lung cancer:prognostic implications[J].Korean J Radiol,2008,9(6):481-489.
[14]Lardinois D,Weder W,Hany TF,et al.Staging of non-small-cell lung cancer with integrated positron-emission tomography and computed tomography[J].N Engl J Med,2003,348(25):2500-2507.
[15]Cerfolio RJ,Ojha B,Bryant AS,et al.The accuracy of integrated PET-CTcompared with dedicated PET alone for the staging of patients with nonsmall cell lung cancer[J].Ann Thorac Surg,2004,78(3):1017-1023.
[16]De Wever W,Vankan Y,Stroobants S,et al.Detection of extrapulmonary lesions with integrated PET/CTin the staging of lung cancer[J].Eur Respir J,2007,29(5):995-1002.
[17]Lardinois D,Weder W,Roudas M,et al.Etiology of solitary extrapulmonary positron emission tomography and computed tomography findings in patients with lung cancer[J].J Clin Oncol,2005,23(28):6846-6853.
[18]Alonso Moralejo R,Sayas Catalán J,García Luján R,et al.Use of positron emission tomography in assessing hidden extrathoracic metastasis in non small cell lung cancer[J].Arch Bronconeumol,2010,46(5):238-243.
[19]Portilla-Quattrociocchi H,Banzo I,Martínez-Rodríguez I,et al.Evaluation of bone scintigraphy and18F-FDG PET/CTin bone metastases of lung cancer patients[J].Rev Esp Med Nucl,2011,30(1):2-7.