溶胶凝胶法制备网状锰酸锂材料
刘 辉, 董晓楠, 刘 萍, 雄 壮
(陕西科技大学 材料科学与工程学院, 陕西 西安 710021)
0 引言
近年来,锂离子电池因其优越的电化学性能、商比容量、长循环寿命、高能量密度以及放电电压高、体积小、绿色环保等特性在过去的十年内得到了迅猛发展[1].目前使用的正极材料主要有钴酸锂、镍酸锂,Li-Co-O材料虽较早的实现商业化,但因其成本较高、高温条件下安全性差和对环境具有较大的危害等问题而被逐渐限制;Li-Ni-O材料虽理论能量密度高,但因循环性能差、安全性低及稳定性差等因素仍停留在实验室研究阶段.尖晶石型锰酸锂是近年来兴起的锂离子电池正极材料,其热稳定性高,耐过充性及安全性好,并且对环境无污染.其在充放电过程中是依靠电子在高价态Mn4+和低价态Mn3+之间的跃迁导电的,且其制备过程中晶型发育愈完整愈好,这样有利于提高锂离子蓄电池的电化学比容量及其循环寿命[2,3].并且通过合理的结构设计,采用液相合成工艺制备纳米结构的锰酸锂,可以使其具备嵌锂空间多、离子扩散路径短等优点,而具有优良的电化学性能[4].
本文采用一种简单的溶胶凝胶法,制备了具有尖晶石型结构的纳米网状锰酸锂电池材料,晶体结晶性能良好,晶粒尺寸在几十个纳米左右,此种电池材料具有密集和巨大的面网结构,其间锰酸锂小颗粒相互作用,连接形成具有特定的网络结构.循环伏安测试表明,电化学反应中载流子传递、转移性能优良.
1 实验
1.1 实验仪器和药品
乙酸锂(Li(CH3COO)·2H2O,AR),上海化精生物高科技有限公司;乙酸锰(C4H6MnO4·4H2O,AR),天津市登峰化学试剂厂;甲醛(HCHO,AR),天津市天力化学试剂有限责任公司;乙二醇(C2H6O2,AR),天津市福晨化学试剂厂;浓氨水(NH3·H2O,AR),西安三浦化学试剂有限公司;实验中所用的水均为去离子水.
1.2 架状锰酸锂电池材料的制备
(1)配制金属盐混合溶液,用天平分别称取9.5 g的乙酸锰和2.0 g的乙酸锂溶于40 mL的去离子水中,制备成两者的混合溶液,使溶液中锂离子与锰离子的物质的量的比约为0.5.
(2)配制分散剂混合溶液,称取11.0 g的间苯二酚和9 mL的甲醛,将间苯二酚溶于40 mL的去离子水中,搅拌一段时间,向其中缓慢加入甲醛,制备成分散剂混合溶液.
(3)混合溶液反应后处理,将金属盐的混合溶液加入到分散剂溶液中,常温搅拌1 h.利用氨水调控体系pH为6.5左右,持续搅拌的条件下进行80 ℃油浴2 h,离心、洗涤,干燥,制得的粉体在500 ℃下煅烧2 h,即得架状锰酸锂电池正极材料.
1.3 样品测试与表征
样品表征:采用日本理学D/max2200PC型自动X-射线衍射仪进行样品的晶相组成、颗粒尺寸、物相定性测定和粒度的测定.测试条件为:铜靶Kα射线,X-射线波长λ=0.154 056 nm,管压40 kV,管流40 mA,狭缝DS,RS和SS分别为0.3 mm和1 °,扫描速度为16 °/min,采样宽度为0.02 °,石墨单色器.采用日本电子JSM-6700F(场发射)型扫描电子显微镜用于观察样品的显微形貌.用透射电子显微镜(JEM-200CX)观察样品的微观形貌和结构.
2 结果讨论
2.1 不同pH对样品的结晶性能的影响
图1为不同pH条件下,制备的锰酸锂的XRD图谱,由图中可知,当控制体系pH=8时所有衍射峰与标准卡片(JCPDS 35-0782)的衍射数据相吻合[5],没有发现其它物质的衍射峰存在,由此可知,体系在中性略微偏碱的条件下,可以生成较纯的尖晶石结构的LiMn2O4(图1(a)).随着体系氨水的量不断增大,所有衍射峰的强度逐渐降低,可能因为某些游离的盐离子与柠檬酸发生发应,产生了不溶性的杂质,使其结晶程度有所降低[6],表明pH的增大不利于样品结晶性能的改善;当pH=10时,一方面,在较强的碱性环境中锰离子可能生成沉淀,在煅烧时则会产生类似于Mn2O3的杂相;此外,低价锰离子在煅烧时发生氧化反应,也可能会产生相同的效果.
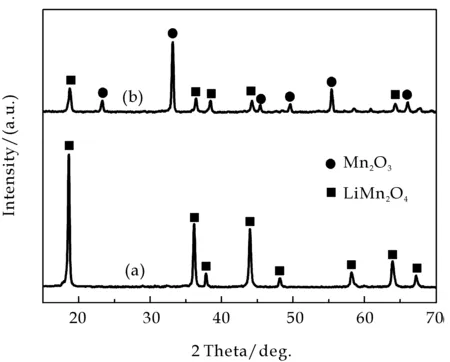
a:pH=8;b:pH=10图1 不同pH条件下制备的LiMn2O4的XRD
2.2 不同的甲醛添加量对锰酸锂形貌的影响
图2为不同甲醛添加量下制备的锰酸锂的扫描电镜照片,图2(a)、(b)、(c)、(d)中甲醛量加入量分别为3 mL、6 mL、9 mL、12 mL.由图2(a)可知,当甲醛的加入量较低时,体系中颗粒表现为不规则的形貌,且出现较轻微的团聚,颗粒之间开始趋向于奥斯瓦尔多熟化机制,发生连接而形成网络前体,可能因为甲醛的含量较低,不能与柠檬酸充分的作用,使更多的锰盐离子发生络合形成大面积的网状结构[7];随着甲醛含量的增大,体系中的小颗粒在柠檬酸等的作用下,发生进一步缔合,形成分散的链状结构,并且此种链状结构将进一步缔合,形成初步的网络状结构(图2(b));当甲醛的加入量为9 mL时,大量的网络状结构将进一步完善,连接、缔合,形成密集而巨大的网状结构,且面网之间分散性较为优良,出现中心聚集的趋向;甲醛量继续增大,柠檬酸的络合作用可能发生破坏,而使颗粒出现聚集,在后期的煅烧中,小颗粒团聚并长大而形成较大的板结,使形貌发生较大破坏.

a:3 mL;b:6 mL,c:9 mL;d:12 mL图2 不同甲醛添加量下制备的LiMn2O4的扫描电镜照片
2.3 最优条件下制备的样品的XRD分析
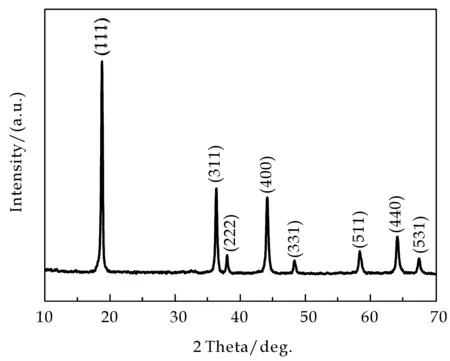
图3 最优条件下制备的网状锰酸锂的XRD图谱,其中pH=8,甲醛的添加量为9 mL
图3为最优条件下制备的网状锰酸锂的XRD图谱,其中控制体系pH为8,甲醛的添加量为9 mL.可以看出,谱线中所有衍射峰均表现为细而尖锐的形状,且均与尖晶石型锰酸锂(JCPDS No.70-3120)的衍射峰相对应[5],谱线在衍射角为18.6 °、36.1 °、38.0 °、44.0 °、48.2 °、58.2 °、63.9 °和67.2 °处出现特征衍射峰,分别对应于尖晶石型锰酸锂晶面(111),(311),(222),(400),(331),(511),(440)和(531),并且未有其他相的出现,表明采用溶胶凝胶法制备的样品为较纯的尖晶石型锰酸锂,结晶性能良好.
2.4 最优条件下制备的样品的SEM分析
图4为最优条件下制备的样品的扫描电镜图片,其中pH为8,甲醛的添加量为9 mL.由图4(a)可知,制备的锰酸锂由大量的网状结构基元组成,整体呈现出巨大而密集的网络状结构,基元之间具有较为优良分散性能和规则的连接方式,从而在一定区域中表现出特定的骨架状桥接方式,为载流子的迅速传递、转移提供必要的媒介.图4(b)为高倍的扫描电镜图片,可以看出,大量小颗粒规则连接形成具有一定面积分布的结构基元,分散性较好;图4(c),(d)为更高倍数的扫描电镜照片,显然,组成网状结构的结构基元内部,小颗粒粒度分布较窄,尺寸约为几十纳米,它们以特定的方式“桥接”成链,链之间相互交织,构成巨大和密集的网络状骨架结构,颗粒之间分布着适量的间隙,可以提供更多的嵌锂空间,并且缩短离子扩散路径,从而改善电池的性能[8].
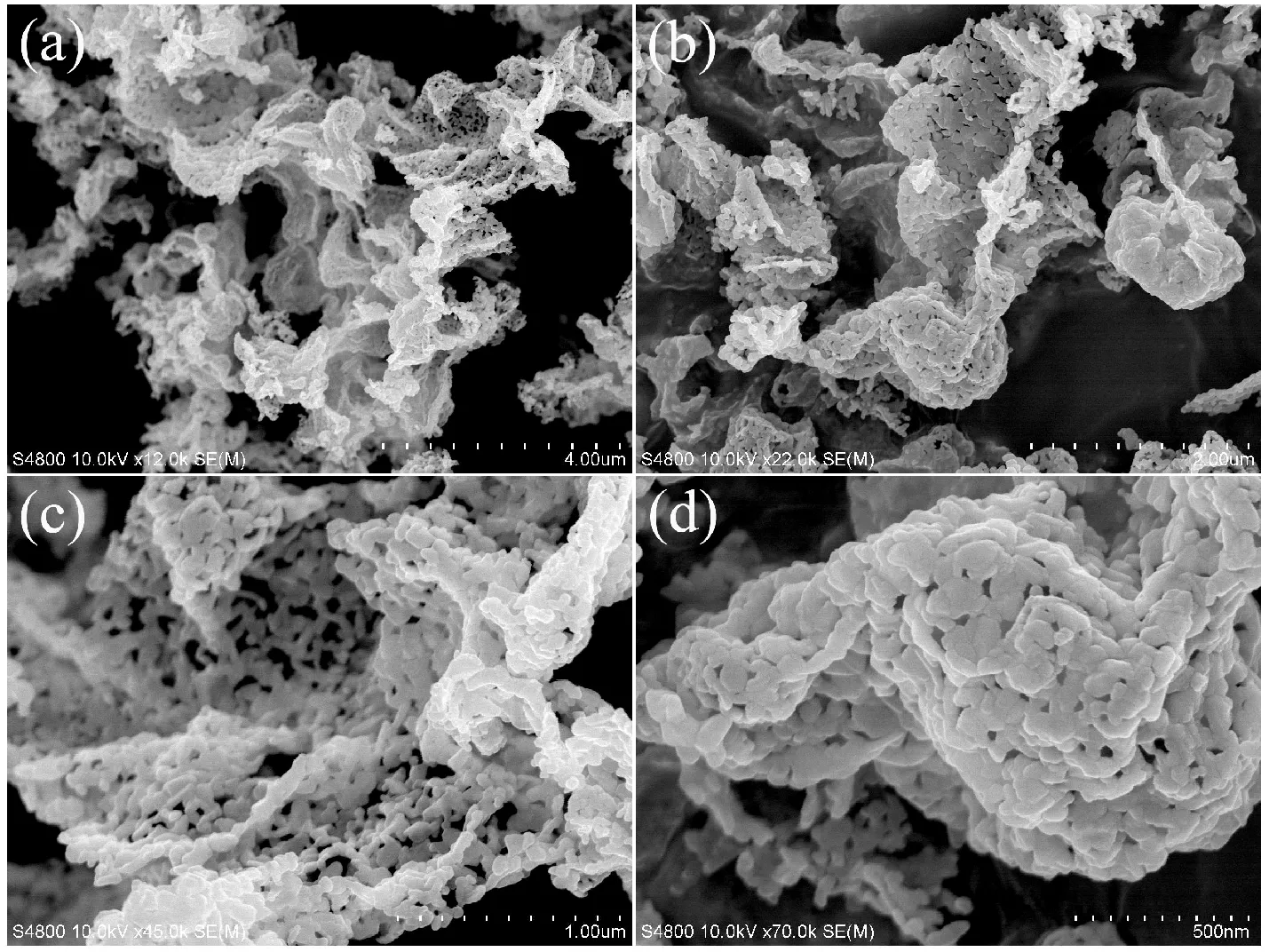
图4 最优条件下制备的网状锰酸锂的扫描电镜图片,其中pH=8,甲醛的添加量为9 mL
2.5 最优条件下制备的样品的TEM分析
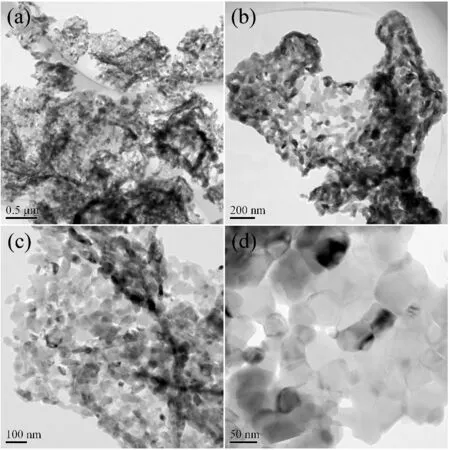
图5 最优条件下制备的网状锰酸锂的透射电镜照片,其中pH=8,甲醛的添加量为9 mL
图5为最优条件下制备的网状锰酸锂的透射电镜照片,其中体系pH为8,甲醛的添加量为9 mL.图5(a)为样品的低倍透射电镜照片,可以看出,制备的锰酸锂整体呈现密集而巨大的面网结构,作为其骨架组成的结构基元具有较好的分散性,并且组成基元的小颗粒之间规则连接、桥接成链,链与链之间相互交织构成骨架结构.图5(b)为较高倍数的透射电镜照片,其反映的为单个基元的结构,可以看出,组成链之间相互交织,缔合成具有特定空间结构的网络体,链间存在的诸多空隙,可能提供更多的嵌锂空间,缩短离子扩散路径,从而改善电池材料的测试性能[9].图5(c),(d)为高倍的透射电镜照片,可以看出,组成结构基元的小颗粒粒度分布较窄,结晶性能良好,尺寸约为几十纳米,颗粒之间存在适宜的间隙,并构成相应的结构基元.此外,少数晶粒较大,可能因为在后期煅烧过程中,出现了二次再结晶的现象.
2.6 样品的循环伏安分析
图6为最优条件下制备的样品的循环伏安测试分析图片.循环伏安性能的测量是通过应用三电极体系,其中工作电极为锰酸锂修饰的玻碳电极,对电极与参比电极分别为铂丝电极与Ag/AgCl电极,循环伏安扫描电位的范围为-2.0~2.0V,扫描速率为10~600 mV/s.所有的电化学性能的测试都应用的是CHI760型电化学工作站(中国).锰酸锂电池的脱嵌反应主要分为两步:
LiMn2O4<=>Li1-xMn2O4+xLi++xe-1(x<0.5)
(1)
Li1-xMn2O4<=>Mn2O4+1-x Li++(1-x)e-1(x>0.5)
(2)
其中,制备的网状尖晶石型锰酸锂粉体所具有的独特的网络结构,由图6中可以看出,随着扫速的不断增加,峰形基本保持不变.此外,具有优异结晶性能的小颗粒组装的大面积的网络结构可能为其提供更多的嵌锂空间,缩短离子扩散路径,而改善电池载流子传递、转移性能[6,10].
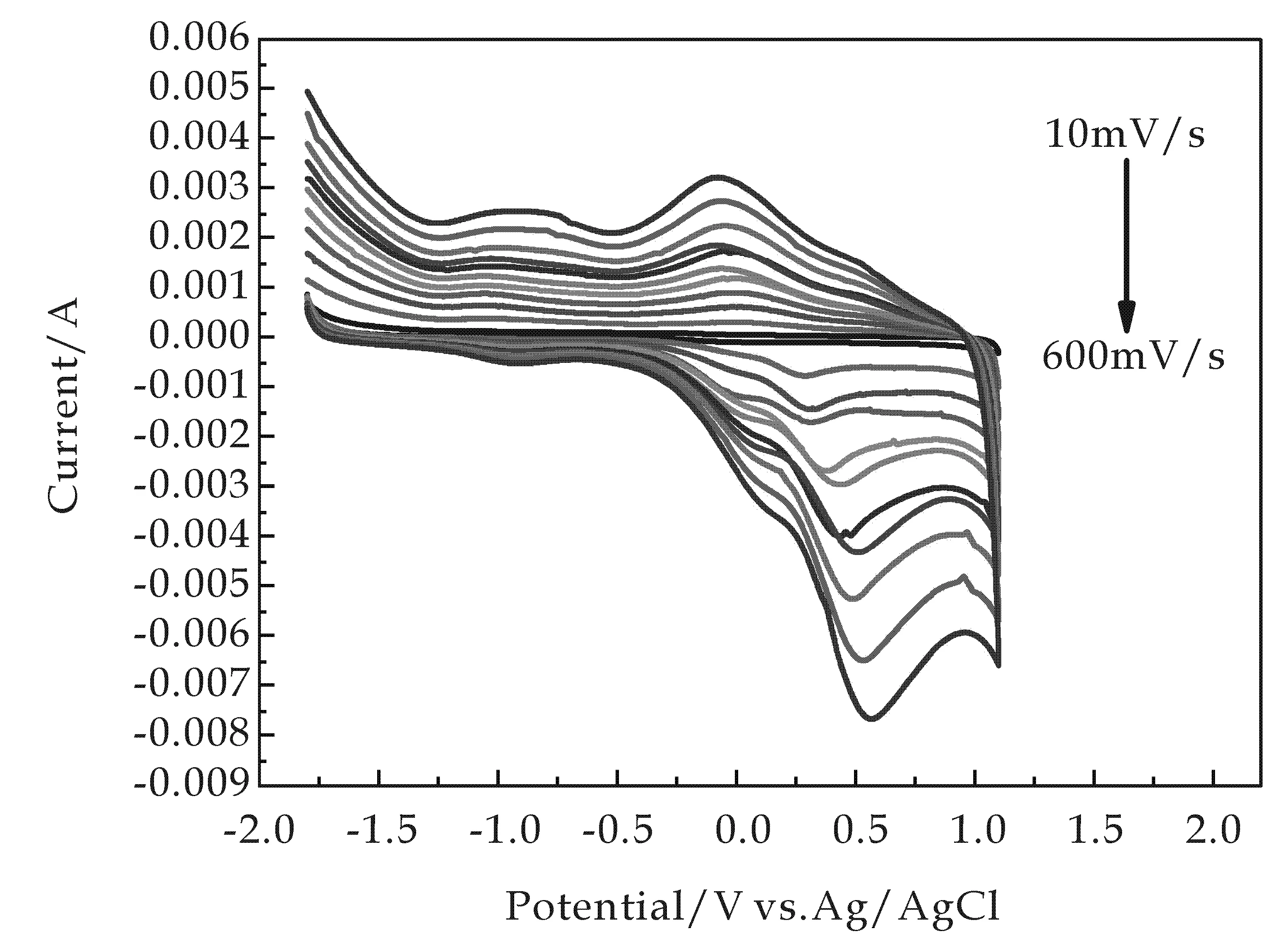
图6 最优条件下制备的LiMn2O4的不同扫速的循环伏安测试分析
3 结论
(1)采用溶胶凝胶法,以锰盐作为锰源,间苯二酚和甲醛为分散剂,柠檬酸为络合剂,成功制备具有特定网络结构的锰酸锂电池材料,其主晶相为纯的尖晶石型锰酸锂,结晶性能优良,晶粒尺寸在几十纳米左右.
(2)体系pH和甲醛的添加量会影响产物的形貌,其中pH过大,可能会因氢氧根的富集而产生氢氧化锰,进而在煅烧时在体系中生成氧化锰的杂相;甲醛的加入量过少,不能和柠檬酸作用形成较大的网状结构,甲醛较多的话,可能因分子间力的作用使大量的有机物发生团聚,不利于模板化形成特定巨大的网络结构.因此,当调整体系的pH为8,甲醛添加量为9 mL时,制备的锰酸锂具有密集而巨大的面网结构,这对促进电化学反应中载流子的传递具有重要意义.
(3)样品的循环伏安测试表明,采用此种方法制备的尖晶石型网状锰酸锂材料在电化学反应中具有良好的载流子传递、转移性能,可能因其结晶性能优良,本身所具有的独特的网络结构可以提供更多的嵌锂空间,并且缩短离子扩散路径.
[1] X.W.Li,R.Yang,B.Cheng,et al.Enhanced electrochemical properties of nano-Li3PO4coated on the LiMn2O4cathode material for lithium ion battery at 55 ℃[J].Mater. Lett.,2012,66(1):168-172.
[2] W.Liu,K.Kowal,G.C.Farrington.Mechanism of the electrochemical inserti on of lithium into LiMn2O4spinels[J].J.Electrochem.Soc.,1998,145(2):459-465.
[3] Y.C.Chen,K.Xie,Y.Pan,et al.High power nano-LiMn2O4cathode materials with high-rate pulse discharge capability for lithium-ion batteries[J].Chin.Phys.B,2011,20(2):028201.
[4] S.Castillo,F.Ansart,C.L.Robert,et al.Advances in the recovering of spent lithium battery compounds[J].J.Power Sources,2002,112(1):247-254.
[5] 郑子山,唐子龙,张中太,等.锂离子电池正极材料LiMn2O4的研究进展[J].无机材料学报,2003,18(2):257-263.
[6] C.H.Lu,S.W.Lin.Influence of the particle size on the electro-chemical properties of lithium manganese oxide[J].J.Power Sources,2001,97-88(1/2):458-460.
[7] J.B.Shu,Y.L.Yan,L.L.Hu.Synthesis and electrochemical properties of LiMn2O4by microwave-assisted sol-gel method[J].Mater.Lett.,2005,59(28):3 761-3 765.
[8] P.Z.Shen,D.Z.Jia,Y.D.Huang,et al.LiMn2O4cathode materials synthesized by the cellulose-citric acid method for lithium ion batteries[J].J.Power Sources,2006,158(1):608-613.
[9] J.T.Son,H.G.Kim,Y.J.Park.New preparation method and electrochemical property of LiMn2O4electrode[J].Electrochim.Acta,2004,50(2-3):453-459.
[10] F.K.Shokoohi,J.M.Tarascon,B.J.Wilkens,et al.Low Temperature LiMn2O4Spinel Films for Secondary Lithium Batteries[J].J.Electrochem.Soc.,1992,139(7):1 845-1 849.

