蛋白激酶PRKX对人肝癌细胞粘附和迁移能力的影响
胡启凯 任 斌
(山西中医学院体育部,太原030024)
原发性肝癌是世界上最常见的恶性肿瘤之一,病死率高[1]。手术治疗是目前肝癌最有效的治疗方法,但即使是根治术后5年转移复发率仍高达60-70%。复发转移是影响预后的最主要因素,因此抗肝癌细胞侵袭和转移,减少术后复发成为目前研究的热点和难点[2-3]。PRKX是一种cAMP依赖的丝氨酸/苏氨酸蛋白激酶。研究表明,蛋白激酶PRKX与上皮细胞迁移与分支浸润有关[4],提示其可能在肿瘤细胞的转移机制中发挥作用。目前,对PRKX在肝癌细胞系中的表达及对肝癌细胞粘附和迁移能力的影响还没有研究报道。本研究通过在SMMC-7721细胞中过表达PRKX,研究PRKX对人肝癌细胞粘附和迁移的影响和作用。
材料和方法
1.材料
人肝癌细胞株SMMC-7721购于中国科学院上海生物研究所细胞库。主要试剂:RPMI 1640培养液 (Invitrogen), 胎 牛 血 清 (Invitrogen),pDONR223-PRKX(Addgene),Lipofectamine 2000(Invitrogen),BCA 蛋 白 定 量 试 剂 盒 (Pierce),PRKX抗体(Abcam),β-actin抗体(Sigma),辣根过氧化物酶(HRP)标记羊抗小鼠IgG(Cell Signaling Technology),PVDF膜、ECL化学发光剂显色试剂盒(Millipore),蛋白裂解液及其他 Western blot试剂(碧云天),CellTiter 96AQueous One Solution Reagent(Promega),Calcein-AM (BD),Matrigel(BD),FluoroBlok细胞培养池(BD Falcon)。
2.方法
2.1细胞培养:
SMMC-7721细胞培养于含10%胎牛血清、青霉素和链霉素各100U/mL、pH7.3的 RPMI 1640培养液,37℃、5%CO2的培养箱中培养。每日倒置相差显微镜观察细胞形态及生长情况,约3天传代1次。当细胞贴壁生长至丰度为80%时,用0.25%胰酶消化,在倒置显微镜下观察到细胞间隙增大、触角回缩时终止消化,分瓶培养,待细胞进入对数期生长时开始实验。
2.2转染及蛋白印迹鉴定:
将SMMC-7721细胞接种到6孔板中,参照说明书采用脂质体法将pDONR223-PRKX转染至SMMC-7721细胞。72h后,收集对照组和转染组细胞,PBS漂洗2次,加入细胞裂解液进行超声裂解,高速离心后取上清液冷冻保存,抽提好的蛋白,用BCA试剂盒以570nm于Varioskan Flash多功能读数仪上测定蛋白含量。制备10%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)进行电泳,每孔加入50μg的变性蛋白质。电泳后,转移到PVDF膜上,5%脱脂奶粉封闭1h后,加入小鼠抗人PRKX抗体,4℃过夜孵育。洗涤后加入HRP标记的羊抗小鼠IgG,室温孵育1h。洗涤后采用ECL化学发光剂显色试剂盒反应,X胶片显色,暗室,曝光。扫描胶片,用ImageJ软件(National Institutes of Health,NIH)对蛋白条带进行灰度值分析,以βactin蛋白的表达作为参照。
2.3粘附实验:
细胞基质-粘附实验采用的Matrigel胶是一种可溶性的基底膜基质,其主要成分包括层黏连蛋白、胶原IV等,同时含转化生长因子β(TGF-β)、成纤维细胞生长因子(FGF)、血小板衍生生长因子(PDGF)以及其它在EHS肿瘤中自然表达的生长因子。室温下Matrigel可自动聚集产生类似于哺乳动物细胞基底膜的生物活性基质材料。具体步骤如下:将 Matrigel(5μg/孔)包被于96孔板,37℃孵育24h,加入1%BSA RPMI l640(50μL/孔),37℃孵育1h,PBS洗3次。消化对照组和转染组SMMC-7721细胞,计数并以1×105/孔接种于96孔板中,37℃孵育1h。PBS轻洗3次,每孔加20μl CellTiter 96AQueous One Solution Reagent,在37℃、5%CO2培养箱中孵育1.5h,置 Varioskan Flash多功能读数仪上选择490nm波长读取吸光度值(OD 490)。每组设6个平行孔,实验重复3次。
2.4迁移实验:
Boyden小室试验是检查肿瘤迁移、侵袭能力的主要方法之一。本实验中利用不同血清浓度建立的梯度因素,诱发肝癌细胞向下迁移通过滤膜。具体步骤如下:消化对照组和转染组SMMC-7721细胞,计数后荧光染料Calcein-AM标记细胞,细胞种植在含1% 胎牛血清的RPMI l640培养液的FluoroBlok细胞培养池。4h后,将FluoroBlok细胞培养池转移至含5%胎牛血清的RPMI l640培养液的24孔培养板中,37℃、5%CO2培养箱中孵育12h,置Varioskan Flash多功能读数仪上进行荧光定量检测,以不同组测得的相应的荧光数值进行比较。每组设6个平行孔,实验重复3次。
3.统计学分析
实验数据应用GraphPad Prism 5和StatView 5.0统计软件进行统计分析,结果以 表示,两组间比较采用t检验,差异显著性水平取P<0.05,差异非常显著性水平取P<0.01。
结 果
1.肝癌细胞系中PRKX蛋白的表达
蛋白印迹测定结果显示,SMMC-7721细胞PRKX转染组PRKX蛋白的表达较对照组明显增加(图1)。这为研究高表达的PRKX在肝癌细胞系中的作用提供了实验基础。
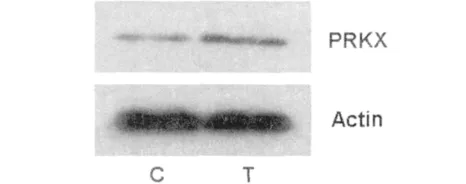
图1 PRKX在肝癌细胞SMMC-7721中的表达Fig.1The expression of PRKX protein in SMMC-7721 cells C:对照组;T:PRKX转染组
2.PRKX对肝癌细胞粘附的影响
为了检测PRKX对肝癌细胞粘附能力的影响,对照组和转染组SMMC-7721细胞种植在Matrigel包被的板内。采用修改的MTS方法,MTS(一种四唑类化合物)被活细胞生物还原成为一种有色的甲臜产物,可直接溶解于培养基中,通过颜色反应检测两组细胞对Matrigel的粘附效果。结果显示,SMMC-7721细胞转染组的粘附能力较对照组明显增加(P<0.05,图2)。

图2 PRKX对肝癌细胞SMMC-7721粘附的影响Fig.2The effect of PRKX on the adhesion of SMMC-7721cells**P<0.01,n=3.
3.PRKX对肝癌细胞迁移的影响
采用修改的“Boyden小室试验”,通过检测穿过FluoroBlok细胞培养池的标记细胞的荧光值,分析PRKX对肝癌细胞迁移能力的影响。结果显示SMMC-7721细胞转染组的迁移能力较对照组明显增加(P<0.05,图3)

图3 PRKX对肝癌细胞SMMC-7721迁移的影响Fig.3The effect of PRKX on the migration of SMMC-7721 cells.AFU:arbitraryfluorescence units.*P<0.05,n=3.
讨 论
恶性肿瘤的浸润和转移机制,目前尚未十分明了,但已知是一个由一系列步骤组成的复杂过程,包括肿瘤细胞彼此之间的粘附力减少;癌细胞附着于细胞外基质成分基底膜;细胞外基质的降解;癌细胞的移出等[2,5]。探讨肿瘤细胞粘附和迁移的调控机制对肿瘤细胞转移机制的研究和临床干预治疗具有重要的意义。目前已有对肿瘤转移相关因素的干预方面的研究。比如,大剂量长疗程应用α干扰素(IFN-α)治疗能够抑制肝癌的转移复发和肿瘤生长,其抑制术后复发的作用较抑制未经切除的移植瘤的作用更为明显,并且其效应是剂量依赖性,作用机理可能为阻断肝癌的肿瘤血管形成[6]。
蛋白激酶是细胞活化包括肿瘤细胞转化的重要信号分子,也是介导肿瘤细胞粘附、侵袭及转移的关键因素[7-8]。1995年研究克隆发现了人蛋白激酶PRKX,与经典的蛋白激酶A、B、C等不同,是一种新的蛋白激酶,其催化活性比蛋白激酶A(PKA)弱[9-11]。本 研 究 首 先 对 PRKX 在 肝 癌 细 胞 系SMMC-7721中的表达情况进行了研究。我们的实验结果显示,PRKX蛋白在SMMC-7721肝癌细胞有表达。人们最先在肾脏发育的研究中发现PRKX具有某些重要的生物学功能[11]。之后有学者对PRKX在小鼠胚胎和成后年在不同器官组织的表达进行了研究,发现PRKX在大脑、肾脏、肝组织中的表达随发育的不同阶段表达不同,在胚胎的表达较丰富,成年后表达降低[12]。粘附是肿瘤细胞侵袭的第一步,是调节某些肿瘤细胞转移的重要步骤,这种行为可能会影响转移过程中的几个阶段[13]。本实验中,过表达PRKX后,SMMC-7721肝癌细胞对基质胶的粘附能力显著增加,提示PRKX可能对肝癌细胞的粘附能力具有促进作用。
研究中过表达PRKX后,肝癌细胞SMMC-7721的迁移能力显著增加。与采用固定、染色、显微镜下人工计数穿过细胞数的方法不同[14,15],在本实验中通过荧光染料预先标记待测细胞,检测时通过测量标记细胞的荧光表达量来进行定量比较。有研究报道,体外过表达PRKX可以激活肾脏上皮细胞系FIB4细胞的迁移;促进MDCK细胞系上皮样细胞分支形态的形成[11]。已有证据表明,蛋白激酶家族中蛋白激酶B(PKB/Akt)、蛋白激酶C(PKC)等在肝癌细胞的增殖、浸润、迁移中发挥调节作用[16,17]。采用反义寡核苷酸技术降低PKC-α的表达,可以抑制肝癌细胞的增殖、迁移和侵袭[16]。值得注意的是,前面提到的PRKX在肾脏上皮细胞的作用研究中,PKA没有发挥相似的激活促进作用[11]。以上结果和文献证据提示,PRKX可能通过某些不同于PKA的生物学功能发挥其促进肿瘤转移的作用。PRKX促进肿瘤细胞迁移和转移的机制尚不清楚。有研究表明,PRKX可以通过激活CREB依赖的转录因子的表达发挥其活性[18]。推测本研究显示的PRKX对促进肝癌细胞粘附和迁移能力的作用可能与某些转录因子的异常表达有关,尚需进一步的研究证实。
综上所述,我们的研究表明,蛋白激酶PRKX与肝癌细胞的粘附和迁移活动密切相关,是一个潜在的肝癌治疗的新的药物靶点。在后续的工作中,我们将对与此有关的信号转导过程进行深入的探讨。弄清这些问题,将有利于进一步认识肝癌的发生发展机制,为肝癌的治疗提供新的思路。
[1]郑小卫,王增,程斌.晚期肝癌靶向药物治疗的临床研究进展.中国药师,2012,15(1):107-109
[2]李贞,程留芳.肝癌细胞侵袭转移分子机制研究进展.辽宁医学院学报,2007,28(5):87-89
[3]高苗苗,徐芳野,木合布力·阿布力孜.肝癌治疗靶点及肝靶向抗癌药物研究进展.新疆医科大学学报,2012,35(2):146-152
[4]Li X,Iomini C,Hyink D,et al.PRKX critically regulates endothelial cell proliferation,migration,and vascular-like structure formation.Dev Biol,2011,356(2):475-485
[5]佟玲,王文萍,邢玉庆.肿瘤转移的分子机制研究进展.肿瘤学杂志,2004,10(3):185-187
[6]王鲁,汤钊猷,薛琼等.α干扰素对肝癌切除术后转移复发干预作用的实验研究.中华肝脏病杂志,2001,9(3):154-156
[7]陈宏,周京旭,周殿元等.蛋白激酶C在肿瘤侵袭转移中的信号调控.国外医学(生理、病理科学与临床分册),2001,21(1):68-71
[8]唐帅,李静,耿美玉.Aurora蛋白激酶及其抑制剂的研究进展.现代生物医学进展,2009,9(11):2175-2178,2143
[9]Klink A,Schiebel K,Winkelmann M,et al.The human protein kinase gene PKX1on Xp22.3displays Xp/Yp homology and is a site of chromosomal instability.Hum Mol Genet,1995,4(5):869-878
[10]Zimmermann B,Chiorini JA,Ma Y,et al.PrKX is a novel catalytic subunit of the cAMP-dependent protein kinase regulated by the regulatory subunit type I.J Biol Chem,1999,274(9):5370-5378
[11]Li X,Li HP,Amsler K,et al.PRKX,aphylogenetically and functionally distinct cAMP-dependent protein kinase,activates renal epithelial cell migration and morphogenesis.Proc Natl Acad Sci USA,2002,99(14):9260-9265
[12]Li W,Yu ZX,Kotin RM.Profiles of PrKX expression in developmental mouse embryo and human tissues.J Histochem Cytochem,2005,53(8):1003-1009
[13]孙长伏,郝永强,于秉治.蛋白激酶C对肿瘤细胞粘附性影响的研究进展.口腔颌面外科杂志,1999,9(4):44-46
[14]卢根林,邓勇,樊海宁等.缺氧应激对人肝癌细胞黏附、侵袭和迁移能力的影响.第三军医大学学报,2008,30(8):721-723
[15]肖秀丽,王晓瑜,蒲霞等.黄芩素对人肝癌细胞株SMMC-7721体外迁移及侵袭的影响.中国肿瘤临床,2012,39(6):305-309
[16]张国新,赵志泉,王宏娣等.蛋白激酶B调节骨桥蛋白在肝癌HepG2细胞中的表达.中华消化杂志,2004,24(3):19-22
[17]Wu TT,Hsieh YH,Hsieh YS,et al.Reduction of PKC alpha decreases cell proliferation,migration,and invasion of human malignant hepatocellular carcinoma.J Cell Biochem,2008,103(1):9-20
[18]Di Pasquale G,Stacey SN.Adeno-associated virus Rep78 protein interacts with protein kinase A and its homolog PRKX and inhibits CREB-dependent transcriptional activation.J Virol,1998,72(10):7916-7925

