血清中炎性介质SAA和CRP的含量以及SAA-CRP-CEA联合检测对术前评估结肠癌的临床价值
周晓红 刘 君
(1.泰山医学院,山东 泰安 271016; 2.泰山医学院附属泰山医院普外科,山东 泰安 271000)
目前普遍认为慢性炎症可以增加罹患肿瘤的危险性,近来伴随着对慢性炎症在肿瘤发生过程中的逐步认识,有关炎症指标及免疫指标的检测正逐步用于临床诊断指导。研究最多的就是C反应蛋白(C-reactive protein,CRP)。近年来CRP在诊断胃肠道恶性肿瘤方面的意义逐渐受到医学工作者的关注[1-2],但血清的CRP 在消化系统尤其是消化系统恶性肿瘤早期诊断的临床意义尚未明确,另外CRP 与其它肿瘤标志物(如SAA, CEA等)在消化系统疾病中的联合检测并利用ROC曲线详细评估整体消化系统的相关报道还比较少。炎性介质血清淀粉样蛋白A (SAA),近几年来各项研究发现其在多种恶性肿瘤的患者表达有所上调,大量研究资料[3]表明,SAA 蛋白质表达水平增高可能与多种肿瘤相关,但其机制仍不清楚。因此,深入研究 SAA,将有助揭示其在肿瘤发生发展过程中的作用。近几年来,越来越多的证据表明SAA在不同种类的癌症的不同阶段会出现不同程度的提升[4-18],SAA参与联系了慢性炎症和肿瘤的起始以及后期的肿瘤发展。CEA是目前诊断结肠癌应用最广泛的一种肿瘤标志物,但是用作早期诊断筛查结肠癌仍有一定的局限性。因此需要寻找能与CEA相互补充的标志物。血清中SAA,CRP和CEA含量的测定对结肠癌诊断的临床价值少有报道,三者联合检测在结肠癌诊断中的临床意义还没有相关报道。本课题采用血清 CEA、CRP、SAA炎性介质联合检测,探究结肠癌患者中上述标志物的相关性以及与结肠癌临床指标的关系,以确定肿瘤标志物联合炎性介质评估结直肠癌患者的临床价值 。
1 材料与方法
1.1 主要实验器材
37℃恒温箱,离心机,全自动电化学发光仪,双波长酶标仪,移液器。
1.2 主要试剂及耗材
(1) SAA ELISA 试剂盒由上海希美生物科技有限公司生产;(2) CRP ELISA 试剂盒由武汉博士德生物工程有限公司生产;(3) CEA电化学发光试剂盒由德国 ROCH 公司生产。
1.3 标本来源
选取2011年12月至2012年12月期间在泰安市中心医院的结肠癌患者81例,其中男39例,女42例,年龄18~81(中位年龄57.84)岁。选取标准为所有标本经病理组织学证实,并为首次发现且未行化疗的患者。排除标准:1个月内有炎症病史或入院后发生感染或有感染征象者;合并其他慢性疾病者;有免疫系统疾病者;采集前曾接受肿瘤辅助治疗者。正常对照组为门诊查体中心健康体检者81例(并观察其他指标排除肿瘤疾病的存在)。
1.4 实验操作程序
SAA及CRP 测定采用双抗体夹心酶联免疫吸附试验(ELISA)。
计算所测血清的浓度:根据标准品的浓度及对应的 OD 值,运用应用软件来绘出标准曲线的直线回归方程,并计算出对应的样品浓度,最终浓度为实际测定浓度乘以稀释倍数。
血清中 CEA 浓度的检测:均有本院实验室采用电化学发光法测得。
1.5 联合检测阳性率判定方法
SAA、CRP 的截断点(临界值)采用 ROC 曲线分析确定, CEA 的截断点(临界值)由本院实验室测得3.4 ng/ml。血清 SAA、CRP 与 CEA 两两联合检测,二者中有一项阳性定为阳性,余为阴性,三者联合检测三者中有一项阳性定为阳性,余为阴性。
1.6 统计学处理
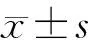
2 结 果
2.1 结肠癌组和健康对照组血清中SAA 、CRP、CEA的浓度比较
结肠癌组三种标志位的浓度均明显高于健康对照组,差异有统计学意义(P<0.01) ,见表1。
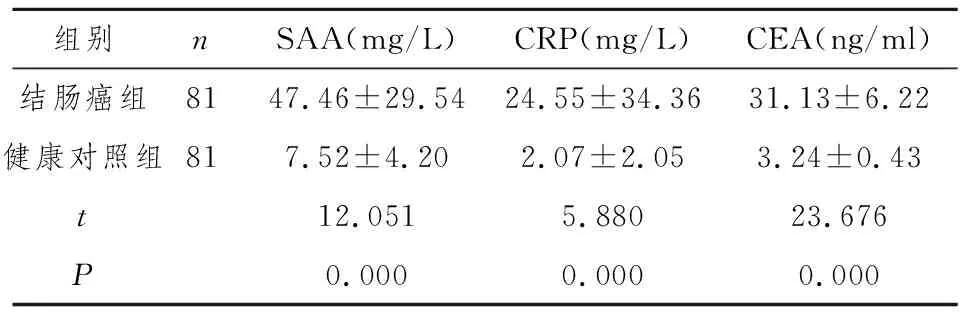
表1 两组SAA、CRP、CEA的结果比较
2.2 结肠癌患者血清中SAA 、CRP、CEA的浓度与临床指标的关系
SAA的浓度女性组高于男性组,有统计学意义(P<0.05),CRP、CEA在不同性别间差异无统计学意义 (P>0.05)。 CEA的浓度高龄组高于低龄组,有统计学意义 (P<0.05)。SAA 、CRP在不同年龄组间差异无统计学意义 (P>0.05)。肿块突破浆膜层的患者CRP浓度高于未侵及浆膜层患者,有统计学意义 (P<0.05),SAA、CEA在不同浸润深度之间差异无统计学意义 (P>0.05) 。SAA、CEA的浓度在不同肿块大小间的差异无统计学意义 (P>0.05);肿瘤直径≥ 5cm的结肠癌患者血清中CRP的浓度高于肿瘤直径<5 cm者,有统计学意义(P<0.05)。见表2。
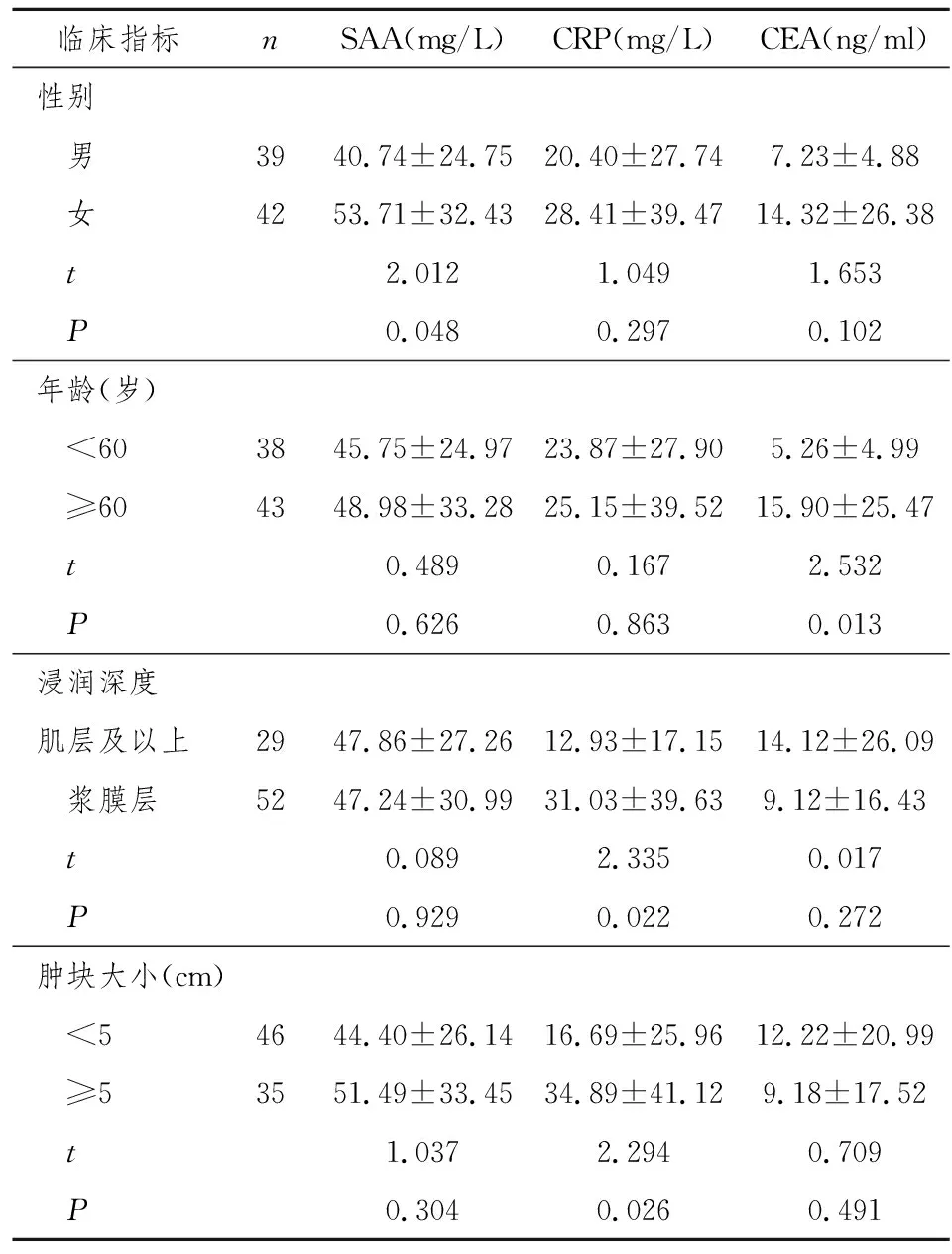
表2 结肠癌患者血清中三种标志位的浓度与临床指标的关系
2.3 结肠癌患者SAA、CRP、CEA及联合检测的阳性率
利用 ROC 曲线分析确定SAA及CRP的截断点(即临界值),选取光滑 ROC 曲线最靠左上角的那点作为截断点,其对应的 SAA 浓度为 11.225 mg/L,对应的CRP浓度为 2.5 mg/L。血清CEA的切割值由本院实验室测定为3.4 ng/ml。根据确定的切割值,计算各检测方法的阳性率。SAA、CRP 对结肠癌诊断的阳性率均高于 CEA,但两两联合检测、三者联合检测均高于 SAA、CRP、CEA 的单项检测,见表3。
2.4 运用流行病学对三项指标单独对结肠癌检测效能的评价
计算 SAA、CRP、CEA 的敏感度、特异度、Kappa 值、误诊率(假阳性率)、漏诊率(假阴性率)、Youden指数、阳性似然比、阴性似然比、阳性预测值(PPV)和阴性预测值(NPV),SAA 的敏感度高于CRP及CEA,经多重比较(Scheffe 法)发现:SAA 高于 CEA 有统计学意义(P<0.05),SAA 高于 CRP 无统计学意义(P>0.05);经χ2检验,三者特异度、误诊率差异无统计学意义(χ2=5.07,P>0.05);经χ2检验,三者对结肠癌诊断的漏诊率差异无统计学意义(χ2=10.18,P>0.05),经多重比较(Scheffe 法)发现,SAA低于 CEA 有统计学意义(P<0.05),SAA 低于 CRP 无统计学意义(P>0.05);SAA 的Youden 指数、Kappa 值最高;经χ2检验,阳性预测值、阴性预测值之间的差异无统计学意义(P>0.05),见表4。
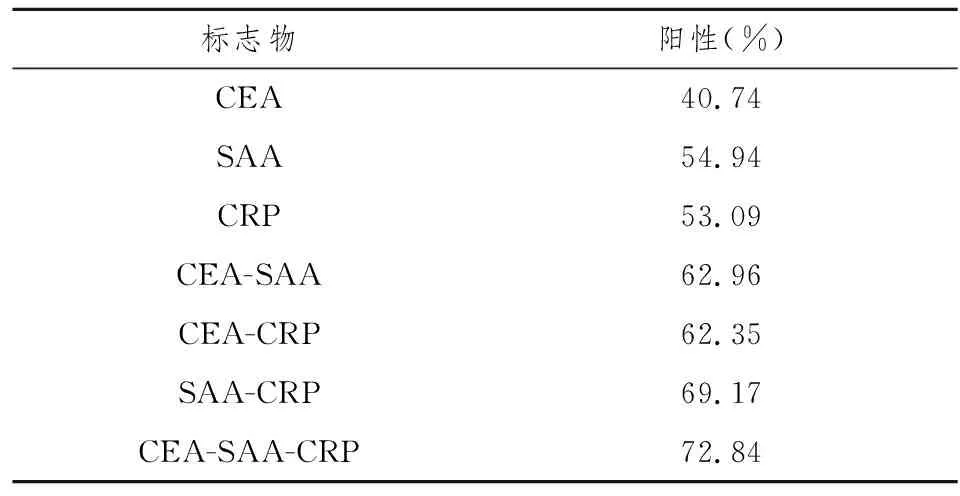
表3 结肠癌患者SAA、CRP、CEA及联合检测的阳性率
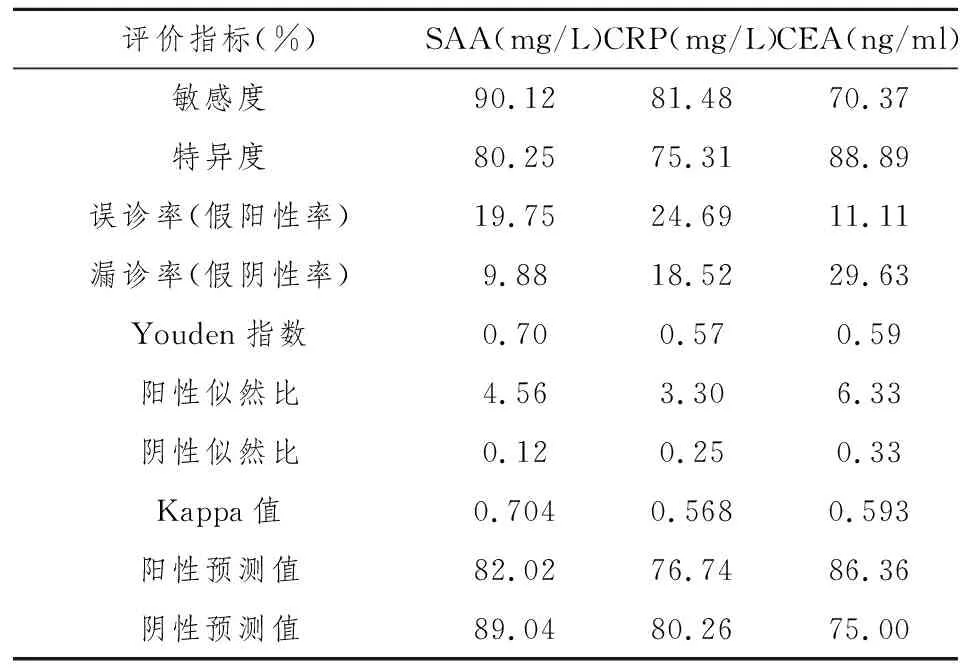
表4 结肠癌患者SAA、CRP、CEA单项诊断性试验分析结果
2.5 运用流行病学对三项指标各项组合检测对结肠癌检测效能的评价
计算CEA-SAA、CEA-CRP、SAA-CRP、CEA-SAA-CRP 的敏感度、特异度、约登指数、误诊率(假阳性率)、漏诊率(假阴性率)、Youden 指数、阳性似然比、阴性似然比、Kappa 值、阳性预测值(PPV)和阴性预测值(NPV):经χ2检验,各项组合之间的敏感度差异无统计学差异(P>0.05),见表5。
2.6 SAA、CRP与CEA的相关性
应用行×列表χ2关联性试验分别对SAA与CEA、CRP与CEA进行相关性分析,SAA与CEA有相关性(P<0.05),CRP与CEA也有明显相关性(P<0.05)。
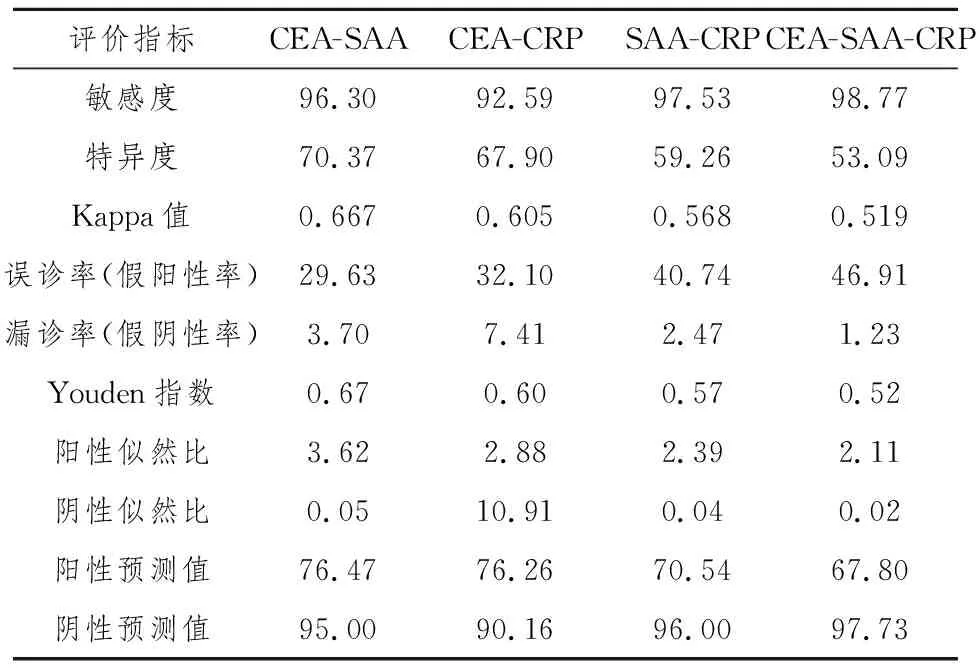
表5 结肠癌患者SAA、CRP、CEA并联诊断性试验分析结果(%)
3 讨 论
结肠癌是目前临床上较为常见的恶性肿瘤,近些年,它在我国的发病率呈现不断增高的趋势。结肠癌的症状比较隐蔽,早期通常没有明显的临床表现,同时病情的进展较为缓慢,当症状表现出来的时候大多已经到了中晚期阶段,因而,结肠癌的死亡率偏高,仅次于肺癌和肝癌,排名恶性肿瘤的第三位[19]。因此结肠癌已经成为全世界范围内严重的社会医疗问题。结肠癌的临床表现主要分为早期症状、腹部包块、中毒、晚期症状[20-21]。
电子结肠镜检查在行业内虽被认为是诊断结肠癌的金标准, 但侵入性检查既需要一定的设备和仪器又对职业意识的操作要求较高, 在检查过程中有发生穿孔及出血的危险,在疾病的诊断过程中具有很大的局限性。肿瘤标志物检测是诊断结肠癌的常用方法之一, 最早临床上应用较为广泛的是癌胚抗原 (CEA)等,对于结肠癌的早期诊断和及时治疗在临床上较为重要[22]。本研究表明,结肠癌患者血清中CEA的浓度显著高于健康对照者,差异具有统计学意义(P<0.05),这与先前学者的研究结果相符[23]。我们进一步证实了血清中的CEA可以作为诊断结肠癌的标志物,它能够预测和反映结肠癌的产生。在不同性别之间的结肠癌患者之间, 血清中CEA的浓度均无显著性差异,说明结肠癌患者血清中CEA的水平在不同的性别的人群中不具有浮动性,无需区别对待。目前CEA作为肿瘤标志物已广泛应用于结直肠癌的诊断和随访, 但是由于敏感度和特异度均不高而限制了其在临床上的广泛应用。
最新的研究结果表明,肿瘤的进展和转移可能与炎症反应有关,为应用CRP和 SAA等炎性介质对结直肠癌进行术前评估提供了理论依据[24]。有文献报道前列腺癌[25]、肾细胞癌[26]、肺癌[27]、胃癌[28]等恶性肿瘤的患者 SAA的表达有上调, 并且表现出了很高的特异度和敏感度。探寻多种肿瘤标志物的联合检测已经越来越多的成为学者关注的焦点。对于结直肠癌的诊断血清淀粉样蛋白或许可以作为一种可靠的非特异性的肿瘤标志物,在临床常规推荐使用。
本实验采用ELISA法测定结肠癌患者血清中SAA、CRP 和 CEA 的浓度分别为:(47.46±29.54)mg/L、(24.55±34.36)mg/L、(31.13±6.22) ng/ml,前两者分别利用ROC曲线确定其临界值(截断值)为: 11.225 mg/L、2.5mg/L,CEA的截断值由本院实验室测得为3.4 ng/ml。因此, 利用三者的该截断值作为诊断浓度,检测结肠癌的阳性表达率分别为40.74 %、54.94 %、53.09 %。根据联合检测阳性率的判定方法: 对血清中SAA、CRP 与 CEA 进行两两联合检测,若二者中有一项为阳性则定性为阳性,若二者均为阴性则定性为阴性; 三者联合检测三者中有一项阳性则定性为阳性,全为阴性则定性为阴性。SAA-CRP-CEA、SAA-CRP、SAA-CEA、CRP-CEA的阳性率分别为72.84%、69.17%、62.96%、62.35%。表明SAA、CRP 的阳性率均比CEA高,单项检测以SAA的阳性率最高,并且联合检测的阳性率均比单项检测要高,以SAA-CRP-CEA的阳性率最高,高于其它检测有段,且具有显著的统计学意义。因此, 以上结果表明SAA-CRP-CEA三者联合起来能够提高结肠癌的检出率。
分别计算 SAA、CRP、CEA 的敏感度、特异度、Kappa 值、误诊率(假阳性率)、漏诊率(假阴性率)、Youden 指数、阳性似然比、阴性似然比、阳性预测值(PPV)和阴性预测值(NPV),结果提示:SAA 检测的敏感度高于CEA,漏诊率低于CEA,且具有显著的统计学差异,说明与CEA相比,通过血清中SAA去诊断结肠癌的价值更高;SAA的特异度、误诊率、阳性预测值、阴性预测值与CRP 相比无显著的统计学差异;SAA 的Youden 指数和 Kappa 值均高于 CRP,表明与CRP相比 SAA用于结肠癌的诊断具有更高的准确率;CRP 的 Youden 指数略低于CEA,说明相对于CEA来说,利用CRP诊断结肠癌并无更高的真实性;且CRP 的其它评价指标与CEA相比,无显著的差异,一方面可能与样本量不足有关,另一方面表明它们在其它指数上具有较大的相似性。综上所述,血清中的SAA和CRP 可以作为结肠癌诊断的临床指标。用行×列表χ2关联性检验分别对 SAA-CEA和CRP-CEA 进行相关性分析后发现,SAA 与 CEA 有显著相关性(P<0.05);CRP 与 CEA 也有明显的相关性(P<0.05),说明SAA、CRP和CEA 在临床上都具有重要地位,它们彼此存在一定的关联性。为了验证联合检测是否可以应用于临床,我们分别计算了SAA-CEA、CRP-CEA、SAA-CRP、SAA-CRP-CEA的相关流行病学指标,计算结果表明 SAA-CRP-CEA联合检测的敏感度最高(97.73%);并且Kappa值、约登指数、阳性预测值(PPV)和阴性预测值(NPV)也都是比较高的,说明三者联合检测可以应用于临床检测,具有较好的可靠性、真实性和实用性。
综上所述,炎性介质和肿瘤标志物具有一定的相关性,并且 CRP、SAA和 CEA在结直肠癌的术前分期中有较大的临床实用价值,因此 SAA-CRP-CEA的联合检测对筛选需要接受新辅助治疗的结肠肿瘤患者可能具有广阔的前景。
[1] Dongxiao Zhang, Ming Sun, David Samols,et al. STAT3 Participates in Transcriptional Activation of the C-reactive Protein Gene by Interleukin-6[J]. The Journal of Biological Chemistry, 1996,271(16):9503-9509.
[2] 戴越刚.C反应蛋白金标快速定量测定在肿瘤患者中的应用[J]. 上海医学检验杂志,2002, 3:184-185.
[3] Kimura M, Tomita Y, Imai T, et al. Significance of serum amyloid A on the prognosis in patients with renal cell carcinoma[J]. Cancer (Phila.), 2001, 92:2072-2075.
[4] Agaram N, Shia J, Klimstra DS, et al. Globular hepatic amyloid: a diagnostic peculiarity that bears clinical significance[J]. Hum Pathol, 2005,36:845-849.
[5] Alessi P, Leali D, Camozzi M, et al. Anti-FGF2 approaches as a s trategy t o c om pe ns ateresistance to anti-VEGF therapy: long-pentraxin 3 as a novel antiangiogenic FGF2-antagonist[J]. Eur Cytokine Netw,2009,20:225 -234.
[6] Ba reggi SR, C ornelli U. Clioquinol: review of its mechanisms of action and clinical uses in neurodegenerative disorders[J]. CNS Neurosci Ther,2010,25:456-461.
[7] Cho WC, Yip TT, Cheng WW, et al. Serum amyloid A is elevated in the serum of lung cancer patients with poor prognosis[J].Br J Canc,2010, 102:1731-1735.
[8] Cocco E, Bellone S, El-Sahwi K, et al. Serum amyloid A(SAA): a novel biomarker for uterine serous papillary cancer[J]. Br J Canc, 2009,101:335-341.
[9] Cocco E, Bellone S, El-Sahwi K, et al. Serum amyloid A: a novel biomarker for endometrial cancer[J]. Cancer, 2010,116:843-851.
[10] Cohen AD, Comenzo RL. Systemic light-chain amyloidosis: advances in diagnosis, prognosis, and therapy[J]. Am Soc Hematol Educ Program, 2010,101:287-294.
[11] Comenzo RL.Current and emerging views and treatments of systemic immunoglobulin light-chain (Al) amyloidosis[J]. Contrib Nephrol, 2007,153:195 -210.
[12] Cremona M, Calabro E, Randi G, et al. Elevated levels of the acute-phase serum amyloid are associated with heightened lung cancer risk[J]. Cancer,2010, 116:1326-1335.
[13] Junker K, Von Eggeling F, Muller J, et al. Identification of biomarkers and therapeutic targets for renal cellcancer using ProteinChip technology[J]. Urologe A, 2006,45:305-306.
[14] Klock G, Baiersdorfer M, Koch-Brandt C. Chapter 7: Cell protective functions of secretory Clusterin (sCLU)[J]. Adv Canc Res, 2009,104:115-138.
[15] Liu DH, Wang XM, Zhang LJ, et al. Serum amyloid A protein: a potential biomarker correlated with clinical stage of lung cancer[J]. Biomed Environ Sci,2007,20:33-40.
[16] Maru Y. Logic al str ucture s ext racte d from met asta sis experiments[J]. Canc Sci, 2009,100:2006-2013.
[17] Merchant S, Sun J, Korbelik M. Dying cells program their expedient disposal: serum amyloid P component upregulation in vivo and in vitro induced by photodynamic therapy of cancer[J]. Photochem Photobiol Sci,2007,6:1284-1289.
[18] Michaeli A, Finci-Yeheskel Z, Dishon S, et al. Serum amyloid A enhances plasminogen activation : implication for a role in colon cancer[J]. Biophys Res Commun, 2008,368:368 -373.
[19] Levin B, Lieberman DA, McFarland B, et al. Screening and surveillance for the early detection of col orectal cancer and adenomatouspolyps[J]. Gastroenterology, 2008, 134 (5) : 1570-1595.
[20] 邹小明,王锡山,李云龙,等.黑龙江省1997-2007年胃肠道恶性肿瘤临床特点分析[J].中华胃肠外科杂志,2009,12(6):577-580.
[21] Timothy R, Church M,Mark W, et al. A randomized trial of drect mailing of fecal occult bl ood tests t o increase col orectal cancer screening[J]. JNCI , 2004, 96 (10) : 770-780.
[22] Kim Y,Lee S, Park S, et al. Gast orintestinal tract cancer screening using fecal carcinoembryonic antige[J]. Ann Clin Lab Sci, 2003, 33 (11) : 32-38.
[23] Goldstein MJ, Mitchell EP. Carcinoembryonic antigen in the staging and follow up of patients with colorectal cancer[J]. Cancer Invest, 2005, 23(4): 338-351.
[24] MazharD, Ngan S. C-reactive protein and colorectal cancer[J]. QJM, 2006, 99 (8) : 555-559.
[25] Glojnaric I, CaslMT, Simic D, et al. Serum amyloid A protein (SAA) in col orectal carcinoma[J]. Clin Chem Lab Med, 2001, 39 (2) : 129-133.
[26] Kaneti J, Winikoff Y, Zimlichman S, et al . Importance of serum amyloid A ( SAA ) level in monitoring disease activity and response to therapy in patients with prostate cancer[J]. Urol Res, 1984, 12 (5) : 239-241.
[27] KimuraM, Tomita Y, Imai T, et al. Significance of serum amyloid A on the prognosis in patients with renal cell carcinoma[J]. Cancer, 2001, 92 (8) : 2072-2075.
[28] Biran H, Friedman N, Neumann PM, et al. Serum amyloid A (SAA) variations in patients with cancer : correlation with disease activity, stage, primary site, and prognosis [J]. J Clin Pathol, 1986, 39: 794-797.

