VEGF对新生大鼠细菌性脑膜炎病理进程的影响
邹华芳
(广东医学院附属医院儿科,广东 湛江 524000)
新生儿细菌性脑膜炎(bacterial meningitis, BM)是严重威胁新生儿健康的中枢神经系统(central nervous system, CNS)感染性疾病,其病死率可达10%~15%,幸存者中20%~50% 留有癫痫、认知缺陷、听力丧失、视觉缺损、行为发育异常等严重的后遗症[1-2]。迄今为止,该病对CNS损伤的机制仍不十分清楚。因此,进一步深入探讨新生儿BM发病机制具有重要的意义。血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)是在生长发育、创伤修复、肿瘤生长、局部缺血等病理变化过程中具有促进血管增生、增加血管渗透性的重要调节因子,故可通过抑制VEGF的表达来降低血管渗透性,从而达到缓解疾病恶化的目的[3-4]。多项研究[5-6]表明,在炎症反应过程中,血管内皮细胞分泌的VEGF亦有不同程度的升高,血管渗透性增加,使更多炎症因子穿过血管管壁参与炎症反应,加重了CNS的炎症损伤。同时,VEGF也参与炎症损伤后的修复和血管的新生,而新生儿血-脑屏障通透性的增加是病原体能够进入颅内引起脑炎的重要前提。相关文献[7-9]证实,在各种病原体引起的脑膜炎中,血-脑屏障通透性的增加与VEGF有关,故研究VEGF在新生儿BM病理进展中的变化关系,对临床治疗具有重要的指导意义。
本研究通过建立新生大鼠BM模型,检测不同时间点脑脊液(CSF)中WBC计数、脑组织中VEGF mRNA、VEGF蛋白表达水平,以及动物临床表现的观察,并对神经行为学进行评分,以探讨VEGF与新生儿BM发生、发展的关系,期望为临床治疗提供新思路和可靠的实验室依据。
1 材料与方法
1.1材料
1.1.2实验动物及分组 同窝出生SD第11天龄新生大鼠150只,雌雄兼有,体质量14.1~21.2 g(17.9±2.3)g,新生大鼠随母鼠一起购自中南大学湘雅医学院动物学部(符合国家二级动物标准),动物合格证号:医动字第20-010号。将150只新生大鼠按随机数字表法分为3组:正常对照组(38只)、生理盐水对照组(NS对照组,42只)和实验组(70只)。
1.2实验方法
1.2.1致病菌的制备 首先,将GBSⅢ 干燥菌种使用血清肉汤培养基37 ℃ 培养24 h后,接种于血平皿。18~24 h后,挑取单个GBSⅢ 菌落于血清肉汤培养基中,至对数生长中期收集GBSⅢ 菌液。然后,通过紫外分光光度仪检测GBSⅢ菌液的浊度,调整GBSⅢ菌液的浊度对应的OD值与1/2标准比浊管(体积分数为1×108cfu·ml-1)相同,得出菌液体积分数为108cfu·ml-1,再稀释菌液至体积分数为104cfu·ml-1。
1.2.2实验动物模型的建立 按文献[10]的方法,实验组、NS对照组采用1.0%戊巴比妥钠 15~25 mg·kg-1腹腔注射,麻醉。麻醉后,用10 μl穿刺针于小脑延髓池处穿刺,抽出10 μl脑脊液弃去。然后,实验组注入10 μl GBSⅢ 菌液,NS对照组注入10 μl无菌生理盐水,整个操作过程在1~2 min内完成。待复苏后,放回鼠笼由母鼠继续喂养。正常对照组不作任何处理。分别于≤16、>16~≤24、>24~≤48、>48~≤72 h 3组各抽取8只存活的新生大鼠进行取材,抽取新生大鼠脑脊液行WBC计数、脑组织行VEGF mRNA检测,并取脑组织行免疫组织化学方法检测VEGF蛋白的水平。
1.2.3神经行为学评分标准 分别于≤16、>16~≤24、>24~≤48、>48~≤72 h 从3组存活的新生大鼠中各抽取8只进行神经行为学评分:抓其背部,能正常运动,并在5 s内翻身为5分;5 s内翻身,但自发性运动减少为4分;5 s后出现翻身为3分;不能翻身为2分;不能运动为1分[11]。
1.2.4CSF中WBC计数 取3组进行神经行为学评分后的新生大鼠各8只,采用1.0%戊巴比妥钠 15~25 mg·kg-1腹腔注射,麻醉。麻醉后,用10 μl 穿刺针于新生大鼠小脑延髓池垂直进针。有突破感时,回抽取 CSF,取10 μl CSF 置入改良Neubauer计数板的计数池行WBC计数。
1.2.5实时定量逆转录聚合酶反应检测脑组织中VEGF mRNA 表达水平 引物设计与合成:根据 Genebank的资料[12]确定VEGF和β-actin的引物,β-actin作为各标本的内对照。引物(由上海生工生物工程有限公司进行DNA合成)序列如下:1)VEGF引物,上游: 5′-GCA ATG ATG AAG CCC TGG AG-3′,下游:5′-GGT GAG GTT TGA TCC GCA TG-3′,产物大小78 bp;2)β-actin引物,上游:5′-TGA CAG GAT GCA GAA GGA GAT TAC-3′,下游:5′-GGA CAG TGA GGC CAG GAT AGA G-3′,扩增产物大小为120 bp。
脑组织中RNA的提取和PCR产物合成:取3组存活的新生大鼠各8只,断颈处死后,取50 mg脑组织迅速加入Trizol试剂 1 ml,参照Trizol试剂说明提取RNA,逆转录合成参照Taka逆转录试剂盒说明。PCR反应体系:95 ℃ 5 min,95 ℃ 30 s,62 ℃ 30 s,72 ℃ 30 s,共31个循环,最后一个循环再72℃延伸10 min,4℃保存。取PCR产物于1.5%琼脂糖凝胶电泳,120 V电泳40 min。应用Eagle EyeⅡ凝胶成像系统分析,测定PCR产物VEGF cDNA条带和β-actin内对照条带的吸光度比值(D/D0)作为VEGF mRNA的相对表达量。
对比探究2和探究3不难发现,两次实验唯一不同的是,探究2的馒头是用锡纸包裹的,而探究3的馒头没有用锡纸包裹,从而得出造成微波炉不能正常工作的是锡纸。可是,锡纸为什么能造成微波炉里出现火花呢?
1.2.6免疫组织化学方法检测脑组织中VEGF蛋白表达水平 病理切片的制作:分别于≤16、>16~≤24、>24~≤48、>48~≤72 h 从3组存活的新生大鼠中各抽取4只,采用1.0%戊巴比妥钠致死量( 40~60 mg·kg-1)腹腔注射,处死。开胸暴露心脏,用7号头皮针将40~60 ml生理盐水灌入左心室,直至右心耳流出无色清亮液体, 肝脏变白。再用4.0%多聚甲醛液40 ml灌注, 观察肝脏变硬即可。用无菌手术剪沿后囟剪开颅骨, 取出脑组织,置于4%多聚甲醛液中4 ℃ 冰箱固定4 h。然后,乙醇脱水,二甲笨透明,石蜡包埋,冠状切面自额叶向后切片, 切片厚35 μm。
免疫组织化学染色及结果判断标准:从每只新生大鼠脑组织切片中抽取5张切片。脱蜡和水化后,用PBS冲洗3 min,冲洗3次。EDTA抗原修复液进行高压修复1.5 min。室温冷却后,用PBS冲洗3 min,冲洗3次。加50 μl的一抗山羊抗大鼠VEGF抗体,37℃孵育60 min。再置4℃冰箱过夜,取出,用PBS冲洗3 min,冲洗3次。加入50 μl的二抗,37℃孵育30 min。用PBS冲洗30 min,冲洗3次。DAB显色3 min,在光学显微镜下观察3~5 min。流水冲洗,苏木精复染,脱水、透明、中性树胶封片。以胞浆、组织间质有黄色颗粒沉积为阳性染色。在光学显微镜的高倍镜下随机观察5个视野,以阳性细胞百分率和染色强度为判定标准。阳性细胞百分率[阳性细胞百分率=(阳性细胞数/细胞总数)×100%]。判定阴性(-):染色细胞数<10%;弱阳性(±):阳性细胞数10%~40%,染色浅淡;阳性(+):阳性细胞数在40%~80%之间,染色强度中等;强阳性(++):阳性细胞数>80%,染色较深。
1.2.7动物临床表现的观察及抽搐程度判断标准 动物临床表现的观察:观察3组新生大鼠死亡、有无口唇及四肢末端发绀、呼吸困难、反应迟钝及抽搐的情况。
按文献[13]的癫痫动物抽搐分级标准进行抽搐程度判断:0级为无抽搐;Ⅰ级为面部阵挛;Ⅱ级为Ⅰ级+节律点头;Ⅲ级为Ⅱ级+前肢阵挛;Ⅳ级为Ⅲ级+后肢站立;Ⅴ级为Ⅳ级+跌倒。
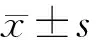
2 结 果
2.1动物临床表现 正常对照组、NS对照组新生大鼠在≤16、>16~≤24、>24~≤48、>48~≤72 h时均未出现死亡、口唇及四肢末端发绀、呼吸困难、反应迟钝及抽搐。实验组新生大鼠临床表现见表1。

表1 实验组不同时间点的临床表现情况
2.2神经行为学评分
正常对照组新生大鼠在≤16、>16~≤24、>24~≤48、>48~≤72 h时神经行为学评分值与NS对照组比较差异均无统计学意义(均P>0.05),实验组新生大鼠在≤16、>16~≤24、>24~≤48、>48~≤72 h时神经行为学评分值均明显低于正常对照组、NS对照组(均P<0.05)。见表2。
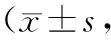
表2 各组不同时间点的神经行为学评分比较分)
注:#P>0.05与正常对照组比较,*P<0.05与正常对照组、NS对照组比较。
2.3CSF中WBC计数
NS对照组新生大鼠在≤16 h时CSF中 WBC计数值与正常对照组比较差异无统计学意义(P>0.05),实验组新生大鼠在≤16、>16~≤24、>24~≤48、>48~≤72 h时CSF中 WBC计数值均明显高于正常对照组、NS对照组(P<0.05或P<0.01)。见表3。
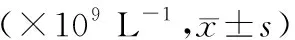
表3 各组不同时间点的CSF中 WBC计数比较
注:-:无此项;#P>0.05与正常对照组比较,*P<0.05、**P<0.01与正常对照组、NS对照组比较。
2.4脑组织中VEGF mRNA表达水平 各组新生大鼠脑组织中均可检测到内参照基因β-actin的稳定表达。3组新生大鼠PCR 产物琼脂糖凝胶电泳结果显示,VEGF基因片段PCR 产物( 长度为78bp)和β-actin基因片段PCR 产物(长度为 120 bp), 证实了逆转录cDNA 的完整性(图1)。NS对照组新生大鼠在≤16 h 时脑组织中 VEGF mRNA 表达水平与正常对照组比较差异无统计学意义(P>0.05),实验组新生大鼠在≤16、>16~≤24、>24~≤48、>48~≤72 h时脑组织中 VEGF mRNA 表达水平均明显高于正常对照组、NS对照组(P<0.05或P<0.01)。见表4。

表4 各组不同时间点的脑组织中VEGF mRNA表达水平比较
注:-:无此项;#P>0.05与正常对照组比较,*P<0.05、**P<0.01与正常对照组、NS对照组比较。
2.5脑组织中VEGF mRNA表达水平与CSF中的WBC计数、动物神经行为学评分的相关性 实验组新生大鼠脑组织中VEGF mRNA表达水平与CSF中的 WBC计数、动物神经行为学评分均无相关性(r=0.405、-0.548,均P>0.05),实验组新生大鼠CSF 中的WBC计数与神经行为评分呈负相关(r=-0.980,P<0.05)。
2.6脑组织中VEGF蛋白表达水平 NS对照组新生大鼠在≤16 h 时脑组织中VEGF蛋白表达水平与正常对照组比较差异无统计学意义(P>0.05),实验组新生大鼠在≤16、>16~≤24、>24~≤48、>48~≤72 h时脑组织中VEGF蛋白表达水平均明显高于正常对照组、NS对照组(P<0.05或P<0.01)。见表5。

表5 各组不同时间点的脑组织中VEGF蛋白表达水平比较
注:-:无此项;#P>0.05与正常对照组比较,*P<0.05、**P<0.01与正常对照组、NS对照组比较。
光学显微镜下观察显示,正常对照组未见明显的VEGF蛋白阳性染色,NS对照组≤16 h VEGF蛋白阳性染色细胞数目少。实验组在≤16 h 时脑室腔中性粒细胞呈VEGF蛋白阳性染色,脑室腔中性粒细胞、纤维结缔组织呈VEGF的阳性染色,实验组在>16~≤24 h时脑膜、浅皮质中性粒细胞、单核细胞呈VEGF蛋白阳性染色,大脑皮质呈VEGF阳性染色的中性粒细胞、单核细胞,实验组在>24~≤48 h 时脉络膜丛、纤维结缔组织呈VEGF蛋白阳性染色,脉络膜丛血管炎性损伤区周围、纤维结缔组织VEGF阳性染色,实验组在>48~≤72 h时海马齿状回颗粒细胞周围呈VEGF蛋白阳性染色,海马颗粒状细胞周围呈VEGF阳性染色。见图2。

1:正常对照组; 2:实验组≤16 h;3:实验组>16~≤24 h;4:NS对照组; 5:实验组>24~≤48 h;6:实验组>48~≤72 h
图1 各组RT-PCR琼脂糖凝胶电泳图

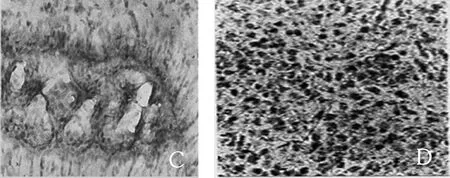
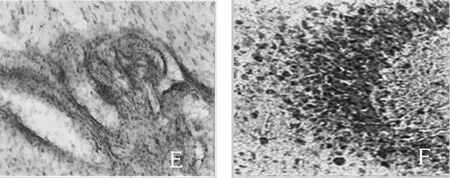
A:正常对照组;B:NS对照组≤16 h;C:实验组≤16 h;D:实验组>16~≤24 h;E:实验组>24~≤48 h;F:实验组>48~≤72 h。
图2 脑组织中VEGF蛋白表达情况(免疫组化染色)
3 讨 论
近年来,国外在成人、儿童脑膜炎及成年大鼠脑膜炎模型研究中发现VEGF表达水平增高[7,14-15],但在新生儿BM中VEGF表达情况国内外尚无报道。本实验通过将GBSⅢ菌液直接注入新生大鼠小脑延髓池,成功建立新生大鼠BM模型,且病理学改变、动物表现、实验室检查均证实这一点[10],并在此动物模型基础上,进一步研究VEGF与新生鼠BM发病机制的关系。
3.1VEGF在新生大鼠BM中的表达水平 本研究观察了VEGF mRNA及VEGF蛋白在新生大鼠BM病程变化中不同时间点的表达情况,通过RT-PCR检测发现,新生大鼠接种GBSⅢ 菌液后脑组织中VEGF mRNA 表达一直处于升高趋势,直至模型72 h达到高值,与正常对照组、NS对照组比较,其升高有明显差异,且免疫组织化学VEGF蛋白染色与之相符,阳性细胞比例及表达强度逐渐升高。Flier等[16]在成人BM的研究中发现,CSF 中VEGF表达水平升高,脑组织病理标本上中性粒细胞、单核细胞呈VEGF阳性染色,可能的机制是:BM的早期,细菌及其产物引发宿主的炎症反应,炎性细胞(如巨噬细胞、单核细胞、中性粒细胞、星形胶质细胞)和血小板等均可产生VEGF。同时,炎性细胞释放出多种细胞因子,如TNF-α、血小板源性生长因子、白细胞介素-1β(IL-1β)、IL-1、IL-6、γ-干扰素等,均能使VEGF和其受体表达增高,提高其生物学活性[2-3,16]。这些细胞因子通过增强VEGF的生成及表达引起血管通透性增高,并且VEGF与这些细胞因子相互作用,促进了宿主的炎症反应[16]。文献[17-18]报道,VEGF通过:1)使得血管内皮细胞紧密联结蛋白重新排列,造成血-脑屏障渗透性增高,并促使基质金属蛋白酶-9表达增加,引起血-脑屏障损伤;2)引起血管通透性增高、导致血管性脑水肿;3)损伤血-脑屏障,使正常隐蔽的中枢神经系统抗原与血源性免疫介质发生反应,通过增加血管细胞黏附分子-1、细胞间黏附分子-1和主要组织相容性复合体Ⅰ、Ⅱ的表达等,参与中枢神经系统免疫反应。VEGF通过多种途径参与BM的进程。故本实验新生大鼠VEGF表达升高,参与BM的炎症反应。
3.2VEGF与炎性细胞的关系 有文献[7-8,17,19]报道,BM、结核性脑膜炎、隐球菌脑膜炎、嗜酸性粒细胞增多性脑膜炎患者CSF中VEGF水平及WBC数均较正常对照组增高。本研究结果显示,实验组CSF中WBC计数均较正常对照组、NS对照组升高,且在≤16、>16~≤24、>24~≤48 h时呈VEGF阳性染色的细胞主要为脑室腔、脑膜、大脑皮质中性粒细胞、单核细胞,分析其可能的原因是:本实验将GBSⅢ菌液直接注入小脑延髓池,细菌在蛛网膜下腔和脑室内大量繁殖,GBS Ⅲ通过荚膜多糖抗原、脂磷壁酸、神经氨酸毒力因子[1-2]等引发机体炎症反应,诱导中性粒细胞、单核细胞等浸润蛛网膜下腔,引起CSF中的WBC数增高,分泌产生VEGF增加,VEGF则进一步引起血管通透性增高,使更多的中性粒细胞渗出至CSF,导致CSF检测呈炎性改变,但本研究实验组新生大鼠脑组织中VEGF mRNA表达水平与CSF中的 WBC计数并无相关性(r=0.405,P>0.05),其可能的因素有:VEGF除产生于炎性细胞之外,还可产生于血管内皮细胞、神经细胞[3]等,并且在BM的病程中VEGF及CSF WBC水平各自持续时间不同。
3.3VEGF与新生大鼠 BM 病理进程的关系 本研究中,≤24 h时呈VEGF蛋白阳性染色的细胞以脑室腔、脑膜、大脑皮质浸润的中性粒细胞、单核细胞为主,而>24 h 时VEGF蛋白阳性染色主要位于脉络膜丛血管炎性损伤区周围和海马齿状回颗粒细胞,且虽然CSF中WBC计数逐渐下降,但VEGF mRNA表达水平仍持续升高,至>48~≤72 h 时达一高峰,分析其可能的原因是:在BM的进程中,由于炎性细胞浸润,内皮细胞增生,广泛血管痉挛,引起血管管腔狭窄,甚至闭塞,继发脑缺血或梗死,均可导致组织缺氧[2]。在缺氧的情况下,缺氧诱导因子-1α(HIF-1α)水平升高,且与VEGF基因5′端启动子相应区域结合,启动VEGF的转录,使VEGF mRNA水平又进一步升高。Yang J等[20]在兔脑缺血模型中发现,缺血敏感区皮质和海马神经细胞上VEGF及HIF-1α表达增加,推测这可能是机体对脑缺血的一种保护机制: VEGF一方面,促进血管生成,增加缺血暗带区的血流量。另一方面,拮抗凋亡,发挥直接神经营养和保护作用,促进损伤修复。本研究中>48~≤72 h时幸存的新生大鼠发绀、呼吸困难逐渐减少,运动功能逐渐好转,抽搐的频率、程度较前减轻,且此时海马齿状回颗粒细胞周围呈VEGF蛋白阳性染色,推测此时VEGF的表达可能与改善局部血供,促进神经康复有关。
总之,新生大鼠BM脑组织中VEGF mRNA表达水平升高,且随时间的不同,有逐渐增高的趋势。新生大鼠BM脑组织在不同时期,表达VEGF蛋白的部位不同。提示,VEGF表达异常可能与新生大鼠BM发病机制相关,且在新生大鼠BM的不同时期,VEGF可能起不同的作用。
[1] Baud O, Aujard Y. Neonatal bacterial meningitis[J]. Handb Clin Neurol, 2013, 112:1109-1113.
[2] Waldo E,Nelson.尼尔逊儿科学[M].第15版.北京:世界图书出版公司,2002:765-769.
[3] Weis SM, Cheresh DA. Pathophysiological consequences of VEGF-induced vascular permeability[J]. Nature, 2005, 437(7058):497-504.
[4] Weis SM. Evaluation of VEGF-induced vascular permeability in mice[J]. Methods Mol Biol, 2011,763:403-415.
[5] Arnaud L, Haroche J, Duhaut P,et al. Pathogenesis of primary large vessel arteritis[J]. Rev Med Interne,2009, 30(7):578-584.
[6] Easton AS. Regulation of permeability across the blood-brain barrier[J].Adv Exp Med Biol, 2012,763:1-19.
[7] Misra UK, Kalita J, Singh AP,et al. Vascular endothelial growth factor in tuberculous meningitis[J]. Int J Neurosci, 2013,123(2):128-132.
[8] Tsai HC, Liu YC, Lee SS,et al. Vascular endothelial growth factor is associated with blood brain barrier dysfunction in eosinophilic meningitis caused by Angiostrongylus cantonensis infection[J]. Am J Trop Med Hyg, 2007, 76(3):592-595.
[9] van der Flier M, Coenjaerts FE, Mwinzi PN,et al. Antibody neutralization of vascular endothelial growth factor (VEGF) fails to attenuate vascular permeability and brain edema in experimental pneumococcal meningitis[J]. J Neuroimmunol,2005, 160(1-2):170-177.
[10] 赵玲玲,殷萍,邹华芳.新生SD大鼠细菌性脑膜炎动物模型的建立[J].中国现代医学杂志,2006,16(19):2891-2897
[11] Loeffler JM, Ringer R, Hablutzel M, et al. The free radical scavenger (alpha)-phenyl-Tert-butyl nitrone aggravates hippocampal apoptosis and learning deficits in experimental pneumococcal meningitis[J]. J Infect Dis, 2001,183(2):247-252.
[12] Jin M, Zhang Y, Pan L, et al.The Chinese medicine formula HB01 reduces choroidal neovascularization by regulating the expression of vascular endothelial growth factor[J]. J Transl Med, 2012,10:118.
[13] Racine RJ. Modification of seizure active by electrical stimulationⅡmotor seizure[J]. Electroencephalogr Clin Neurophysiol, 1972,32: 281-294.
[14] Zucchi FC, Tsanaclis AM, Moura-Dias Q Jr, et al. Modulation of angiogenic factor VEGF by DNA-hsp65 vaccination in a murine CNS tuberculosis model[J].Tuberculosis (Edinb), 2013,93(3):373-380.
[15] van der Flier M, Hoppenreijs S,van Rensburg AJ, et al. Vascular endothelial growth factor And blood-brain barrier disruption in tuberculous meningitis[J]. Pediatr Infect Dis J,2004,23(7):608-613.
[16] Van der Flier M, Stockhammer G, Vonk GJ, et al. Vascular endothelial growth factor in bacterial meningitis: detection in cerebrospinal fluid and localization in postmortem brain[J]. JInfect Dis, 2001, 183(1): 149-153.
[17] Misra UK, Kalita J, Maurya PK. Stroke in tuberculous meningitis[J]. J Neurol Sci, 2011,303(1-2):22-30.
[18] Croll SD, Ransohoff RM, Cai N, et al. VEGF-mediated inflammation precedes angiogenesis in adult brain[J]. Exp Neurol,2004, 187(2):388-402.
[19] Coenjaerts FE, van der Flier M, Mwinzi PN, et al.Intrathecal production and secretion of vascular endothelial growth factor during Cryptococcal Meningitis[J].J Infect Dis, 2004,190(7):1310-1317.
[20] Yang J, Guo L, Liu R, et al. Neuroprotective effects of VEGF administration after focal cerebral ischemia/reperfusion: dose response and time window[J].Neurochem Int, 2012,60(6):592-596.

