银杏内酯B对内皮祖细胞氧化损伤的保护作用及其机制
马骏,季亢挺,官学强,李继武,唐疾飞
(温州医科大学附属第二医院 心内科,浙江 温州 325027)
内皮祖细胞(endothelial progenitor cells,EPCs)是一类机体出生后存在的干/祖细胞,能特异性归巢于血管损伤及新生部位,并分化成内皮细胞,参与血管新生和再内皮化[1]。氧化低密度脂蛋白(oxidative low-density lipoproteins,Ox-LDL)造成内皮细胞损伤是高胆固醇血症导致动脉粥样硬化、冠心病的关键环节[2]。目前研究[3-5]表明高胆固醇血症不仅造成内皮细胞损伤,同样影响EPCs的数量和功能。
近年来国内外的研究[6-7]多集中于银杏内酯B对损伤的心肌细胞和内皮细胞的保护机制的探讨,罕见关于银杏内酯B对EPCs的保护机制的报道。本研究采用Ox-LDL诱导损伤人外周血EPCs,建立EPCs氧化损伤模型,观察不同浓度的银杏内酯B对EPCs的影响,并探讨其可能的作用机制,为临床药物使用的有效性及药物使用浓度提供依据。
1 材料和方法
1.1 主要试剂及仪器 纤维连接蛋白购于Chemicon公司,血管内皮生长因子(VEGF)及碱性成纤维细胞生长因子(bFGF)购于PeproTech公司,胎牛血清、二甲基亚砜(DMSO)及银杏内酯B(纯度大于90%,HPLC)购于Sigma公司,胰酶及M199培养液购于GIBCO公司,CCK8细胞计数试剂盒购于日本同仁化学研究所,超氧化物歧化酶(SOD)试剂盒(WST法)、丙二醛(MDA)试剂盒(TBA法)及细胞裂解液购于碧云天生物技术研究所,Ox-LDL购于上海麦莎生物科技有限公司,VIII因子相关抗原免疫组化试剂盒购于武汉博士德生物工程有限公司,中国科学院上海生科院细胞资源中心提供SGC-7901胃癌细胞株,FITC-VECadherin购于Bender system公司,PE-CD34购于CALTAG LABORATORIES公司,PE-KDR(VEGFR-2)及FITC-CD133购于R&D Systems公司, 细胞培养板与培养瓶购于Corning公司,流式细胞分析仪购于BD公司,680型全自动酶标仪购于美国伯乐公司。
所有外周血均采自温州医科大学附属第二医院行心内电生理检查的住院患者,并经患者授权同意。1.2 实验方法
1.2.1 细胞培养:采用密度梯度离心法分离外周血,收集到的悬浮细胞接种到24孔培养板(纤维连接蛋白预包被),每孔加入1 mL M199培养液(含10%胎牛血清、10 ng/mL VEGF、10 ng/mL bFGF、100 U/mL青霉素及100 U/mL链霉素),将培养板置于5% CO2、饱和湿度、37 ℃孵箱中培养,每3 d去除未贴壁细胞及碎片,更换一半培养液,继续培养。
1.2.2 人外周血EPCs鉴定:予胰酶消化下培养6 d的贴壁细胞,上流式细胞仪分析细胞VEGFR-2、VECadherin、AC133及CD34的表达。用免疫组化法测定贴壁细胞VIII因子相关抗原,胃癌细胞株作为阴性对照。
1.2.3 实验分组:将银杏内酯B粉剂溶解于DMSO分装,储存浓度为100 mg/mL。其中DMSO终浓度≤0.1%,此浓度对体外培养细胞无毒性。在培养至第6天,换用不含胎牛血清的M199培养液使细胞同步化。继续培养24 h后将各孔细胞消化下来制成细胞悬液,接种到细胞培养板,继续培养。随机分为4组,每组设6个平行孔。
正常对照组:细胞在含0.1% DMSO的无血清M199培养液中正常培养24 h。
银杏内酯B 0.05 mg/mL组:细胞用含0.05 mg/mL银杏内酯B+0.05% DMSO的无血清M199培养液预处理6 h后,弃原液;用含0.05 mg/mL银杏内酯B+0.05% DMSO+0.05 mg/mL Ox-LDL的无血清M199培养液继续培养18 h。其DMSO的终浓度为0.1%。
银杏内酯B 0.1 mg/mL组:细胞用含0.1 mg/mL银杏内酯B的无血清M199培养液预处理6 h后,弃原液;用含0.1 mg/mL银杏内酯B+0.05 mg/mL Ox-LDL的无血清M199培养液继续培养18 h。其DMSO的终浓度为0.1%。
Ox-LDL损伤组:细胞用含0.1% DMSO的无血清M199培养液预处理6 h后,弃原液;用含0.05 mg/mL Ox-LDL+0.1% DMSO的无血清M199培养液继续培养18 h。
按照上述步骤干预后,进行细胞功能检测。
1.2.4 外周血EPCs活力的检测:收集贴壁细胞并接种到培养板,按1.2.3方法分组干预,并用含0.1%DMSO的无血清M199培养液设空白孔。干预后加入CCK8试剂,继续培养后测定450 nm吸光度,参比波长为630 nm。根据所测OD值计算细胞生存率。
1.2.5 细胞裂解液SOD活力及MDA含量检测:贴壁细胞按1.2.3方法分组干预,取得细胞裂解液;分别依据试剂盒说明书步骤,配制测定孔及各种空白对照孔;将培养板置于酶标仪,测定450 nm吸光度,根据所测OD值计算SOD活力;测定540 nm吸光度,据所测OD值计算MDA含量。
1.3 统计学处理方法 应用SPSS17.0软件包。所有结果以 ±s表示,采用单因素方差分析比较各组均数。P<0.05为差异具有统计学意义。
2 结果
2.1 EPCs的表型及鉴定 培养7 d左右绝大多数细胞分化为梭形细胞,中央的圆形细胞逐渐脱落。培养2周后,细胞可见铺路石样排列,自发排列成索条状或管腔状结构,表现为成熟内皮细胞的形态特点。继续培养,细胞不再增殖,消化后能重新贴壁。人外周血单个核细胞培养6 d后流式细胞仪分析细胞表达VEGFR-2、VE-Cadherin、AC133及CD34。其中VEGFR-2阳性细胞比例为(30.46±9.23)%,VE-Cadherin阳性细胞比例为(44.69±9.74)%,AC133阳性细胞比例为(19.68±0.81)%,CD34阳性细胞比例为(65.09±11.89)%。培养2周后细胞VIII因子相关抗原免疫组化阳性,胞浆呈棕黄色,一抗以PBS替代的空白对照不显色,作为对照的胃癌细胞也不显色。
2.2 银杏内酯B对Ox-LDL诱导损伤后EPCs活力、SOD活力及MDA水平的影响 见表1。共同孵育人外周血EPCs与Ox-LDL 18 h后,其细胞增殖能力明显受抑制,其加入CCK8试剂后在450 nm的OD值明显低于正常对照组。而经过银杏内酯B预处理后EPCs的OD值较Ox-LDL损伤组升高,且与银杏内酯B呈浓度依赖(见图1)。各组OD值结果提示银杏内酯B呈浓度依赖性升高Ox-LDL损伤后EPCs的细胞生存率(见图2)。
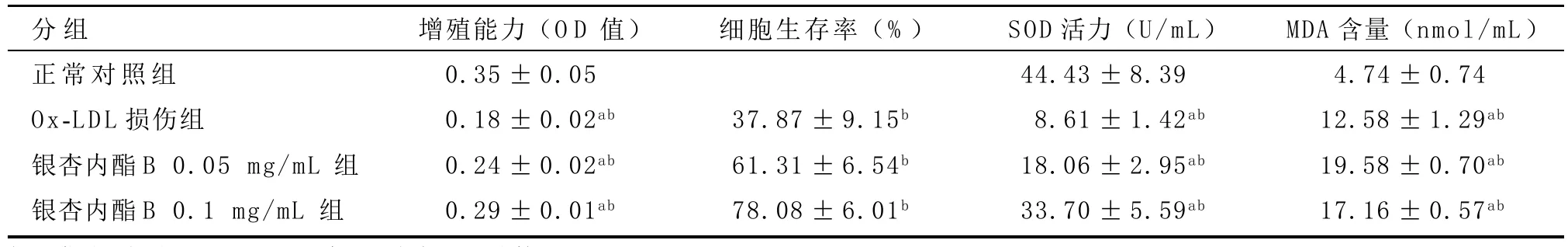
表1 银杏内酯B对Ox-LDL诱导损伤EPCs增殖能力、细胞生存率、SOD活力及MDA含量的影响( ±s)
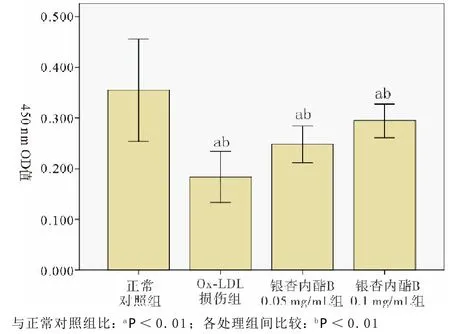
图1 CCK8试剂盒测定各组EPCs的增殖能力
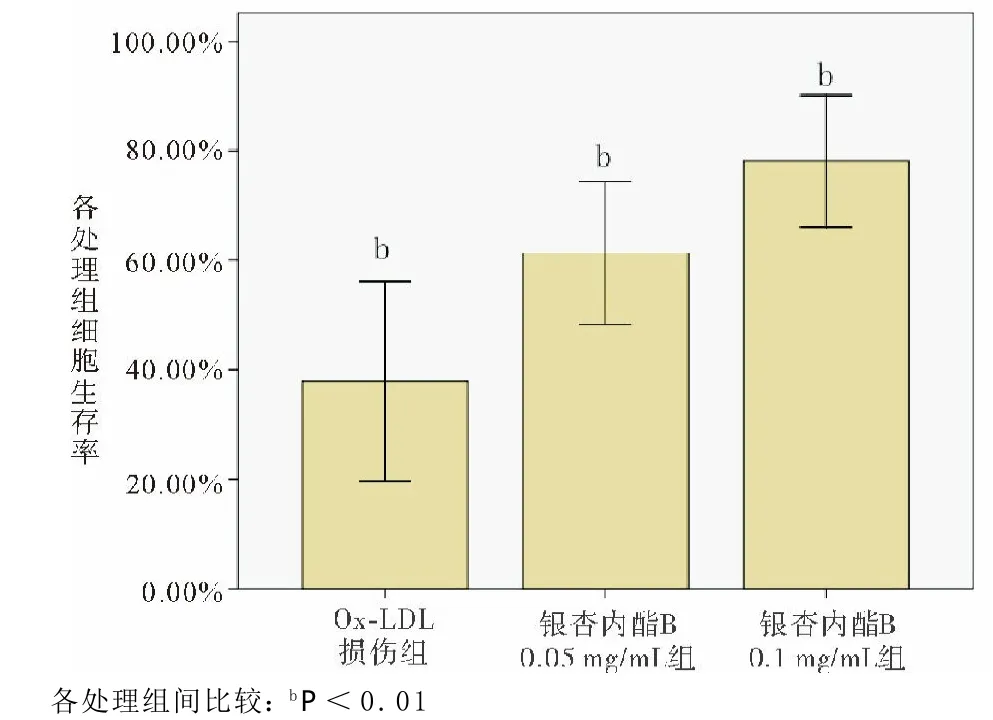
图2 银杏内酯B对细胞生存率的影响
Ox-LDL诱导损伤后EPCs细胞裂解液的SOD活力较正常对照组明显下降。经银杏内酯B预处理后,EPCs与Ox-LDL共同孵育18 h的SOD活力虽不及正常对照组,但较Ox-LDL损伤组有明显增高,且银杏内酯B增高SOD活力的效应呈明显的浓度依赖性(见图 3)。
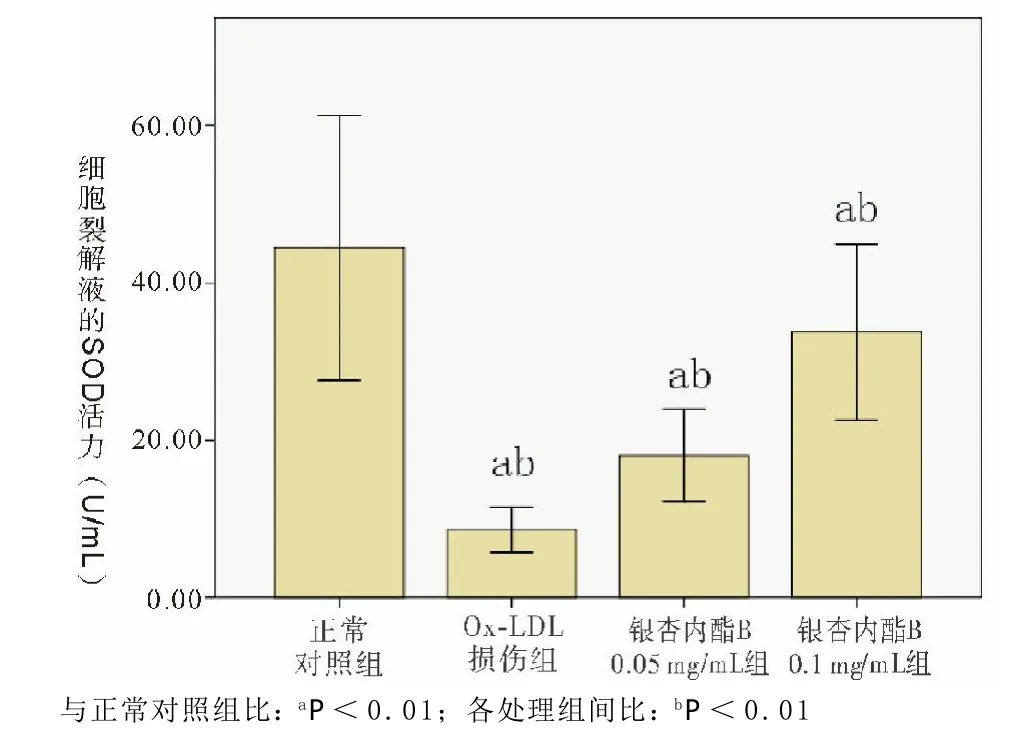
图3 各组SOD水平
Ox-LDL诱导损伤后EPCs细胞裂解液的MDA水平较正常对照组明显升高。而经不同浓度银杏内酯B预处理后MDA的水平虽然明显降低,但较正常对照组仍有明显差异,且不同浓度银杏内酯B降低MDA的水平亦有差异(见图4)。
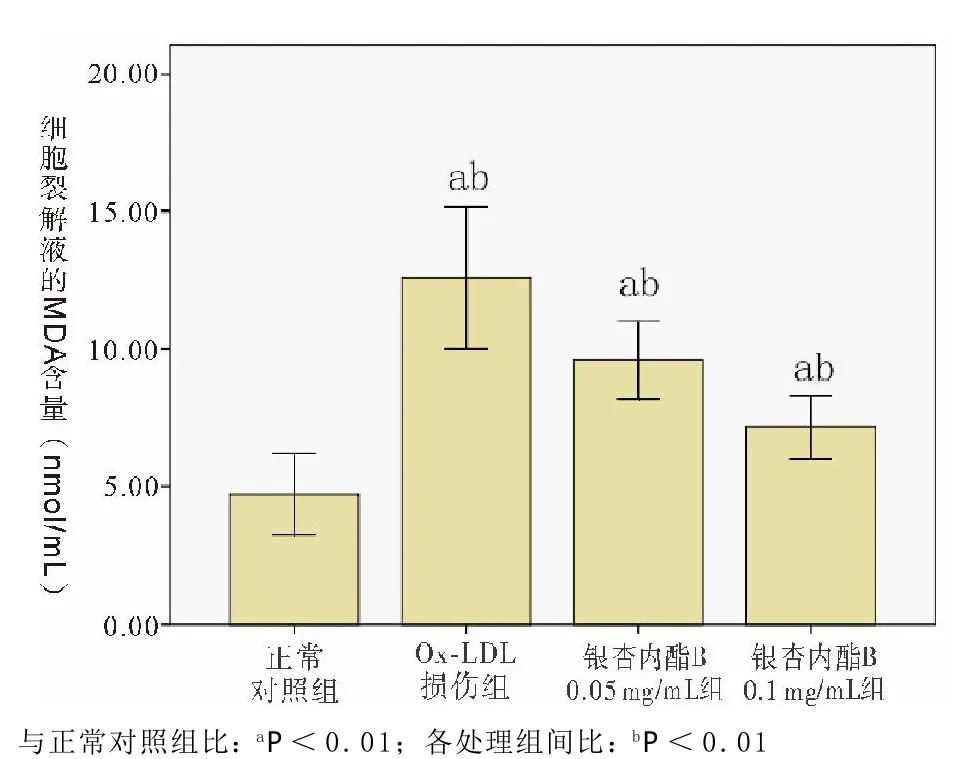
图4 各组MDA水平
3 讨论
动脉内皮损伤是动脉粥样硬化的始动因素,当EPCs数量减少及功能缺陷时,损伤的内皮得不到快速而完整的修复,由于缺乏负反馈,炎症反应进一步加强,大量的炎症因子导致内皮进一步损伤,最终导致动脉粥样硬化的发生、发展[8-9]。Ox-LDL增加细胞内活性氧的产生,导致细胞氧化应激损伤;也可抑制SOD和过氧化物酶的活性,增加细胞膜脂质过氧化而损伤细胞膜,最终导致内皮细胞的死亡和凋亡[10-11],使动脉内皮功能障碍和损伤。Ox-LDL通过直接损伤EPCs、增加EPCs的凋亡、影响EPCs的分化和动员,导致EPCs数量减少和功能减弱。其中氧化应激损伤在Ox-LDL直接损伤EPCs过程中可能起重要作用[12]。
银杏内酯B是银杏叶提取物中主要的活性成分之一,其作为强大的血小板活化因子(PAF)拮抗剂,已得到许多实验的证实,在改善脑缺血-再灌注、抗休克、急性胰腺炎的救治、保护心肌等众多治疗领域发挥作用。Zhou等[13]、Kitamoto等[14]证实银杏内酯B具有抗感染、清除自由基、抗脂质过氧化的作用。银杏内酯B对离体大鼠心脏缺血再灌注损伤的保护作用[6]、对神经系统缺血再灌注的保护作用[7],均认为与其清除脂质过氧化物、保持抗氧化酶活性相关。但银杏内酯B对动脉粥样硬化血管内皮功能的保护作用和机制了解较少。对EPCs的保护作用更是鲜有文献报道。本研究率先通过观察银杏内酯B对EPCs氧化损伤模型的影响,以验证其保护作用,探讨其可能的机制。
本研究采用CCK8细胞计数试剂盒来衡量细胞的存活情况。结果表明经Ox-LDL诱导后EPCs活力下降、细胞凋亡增加、生存率降低。而经不同浓度银杏内酯B预处理后,其EPCs的存活率虽仍较正常低,但较Ox-LDL损伤组明显升高,提示银杏内酯B可抑制细胞损伤及凋亡,且其效应呈浓度依赖性。进一步检测各组SOD活力,可见经Ox-LDL诱导后各组SOD的活力明显较对照组下降。而银杏内酯B保护组SOD活力则较损伤组显著升高。同时银杏内酯B呈浓度依赖性地降低由Ox-LDL诱导升高的MDA含量。
SOD在细胞对抗氧化应激中至关重要,被称为生物体抗氧化系统的第一道防线。SOD活力的高低间接反映机体清除氧自由基的能力。氧自由基攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化作用,并形成分解代谢产物MDA。MDA具有细胞毒性,其高低间接反映了氧自由基的浓度。MDA目前是常用的膜脂质过氧化指标,能够较好地反映细胞氧化损伤的程度。脂质过氧化损伤在冠心病、动脉粥样硬化等疾病的发病中日益受到重视[15]。
由此可见,本研究表明银杏内酯B对EPCs氧化系统和抗氧化系统有重要影响。银杏内酯B可能通过提高EPCs的抗氧化酶活性及抑制脂质过氧化物生成,从而对Ox-LDL诱导的EPCs氧化应激损伤起保护作用。
既往银杏内酯B对内皮细胞氧化损伤保护的研究与本研究结果不尽相同。林宇等[16]研究证明银杏内酯B能够抑制TNFα诱导的小鼠脑血管内皮细胞内的ROS的水平,保护内皮细胞免受氧化应激损伤,此作用可能是通过抑制ROS介导的ERK2激酶及转录因子AP-1的表达而实现。Li等[17]利用Ox-LDL诱导人脐静脉内皮细胞损伤模型研究银杏内酯B抗氧化作用,认为银杏内酯B小剂量时就具有直接抗氧化作用,但在细胞水平抑制ROS的产生需要大剂量;机制可能是银杏内酯B对内皮细胞的保护作用并非通过直接抑制MDA的生成,而是通过抑制转录因子的上游蛋白质分子—丝裂原活化蛋白激酶(MAPK)的磷酸化,进而阻断下游的信号传导通路来实现的。于晓红等[18]利用银杏内酯B抑制TNFα诱导人脐静脉内皮细胞氧化损伤,其作用可能是通过抑制NADPH氧化酶途径的ROS产生实现的。目前对银杏内酯B的血管内皮保护研究刚刚起步,同时国内提纯以及合成银杏内酯的工艺造价高,限制了银杏内酯的广泛研究,其对血管内皮细胞氧化损伤的保护机制了解甚少。而本研究探讨的银杏内酯B对EPCs的氧化损伤保护作用,其保护作用是否同血管内皮细胞完全相似,有待进一步实验验证。
本研究从氧化损伤角度证实了银杏内酯B对EPCs的保护作用,而血管内皮损伤有多种机制参与。银杏内酯B是否也通过抑制细胞内钙超载、抑制NF-κB信号通路等其他机制发挥保护EPCs的作用,有待进一步实验验证。
[1] Urbich C, Dimmeler S. Endothelial progenitor cells: Characterization and role in vascular biology[J]. Circ Res, 2004,95(4): 343-353.
[2] Ross R. The pathogenesis of atherosclerosis: a perspective for the 1990s[J]. Nature, 1993, 362(6423): 801-809.
[3] Hill JM, Zalos G, Halcox JP, et al. Circulating endothelial progenitor cells, vascular function, and cardiovascular risk[J]. N Engl J Med, 2003, 348(7): 593-600.
[4] 朱军慧, 王兴祥, 陈君柱, 等. 高胆固醇对内皮祖细胞数量和功能的影响[J]. 中华内科杂志, 2004, 43(4): 261-264.
[5] 朱军慧, 陈君柱, 王兴祥, 等. 氧化低密度脂蛋白对外周血内皮祖细胞数量和功能的影响[J]. 中华内分泌代谢杂志,2005, 21(1): 13-17.
[6] Varga E, Bodi A, Ferdinandy P, et al. The protective effect of EGb 761 in isolated ischemic/reperfused rat hearts: a link between cardiac function and nitric oxide production[J]. J Cardiovasc Pharmacol, 1999, 34(5): 711-717.
[7] 吴雪丰, 王秋娟, 楼凤昌. 银杏内酯对大鼠局灶性脑缺血的保护作用[J]. 中国药科大学学报, 2001, 32(2): 141-145.
[8] Dong C, Crawford LE, Goldschmidt-Clermont PJ. Endothelial progenitor obsolescence and atherosclerotic inflammation[J]. J Am Coll Cardiol, 2005, 45(9): 1458-1460.
[9] Dimmeler S, Zeiher AM. Vascular repair by circulating endothelial progenitor cells: the missing link in atherosclerosis[J]. J Mol Med, 2004, 82(10): 671-677.
[10]Salonen JT, Nyyssönen K, Salonen R, et a1. Lipoprotein oxidation and progression of carotid atherosclerosis[J].Circulation, 1997, 95(4): 840-845.
[11]Bastiaanse EM, Höld KM, Van der Laarse A. The effect of membrane cholesterol content on ion transport processes in plasma membranes[J]. Cardiovasc Res, 1997, 33(2): 272-83.
[12]Papaharalambus CA, Griendling KK. Basic mechanisms of oxidative stress and reactive oxygen species in cardiovascular injury[J]. Trends Cardiovasc Med, 2007, 17(2): 48-54.
[13]Zhou LE, Wang WJ, Bai JY, et al. Effects of Ginkgolide B on arachidonic acid metabolizing enzymes and level of intracellular calcium in rat polymorphonuclear leukocytes[J].Acta Pharm Sin, 2001, 36(2): 92-95.
[14]Kitamoto S, Egashira K. Endothelial dysfunction and coronary atherosclerosis[J]. Curr Drug Targets Cardiovasc Haematol Disord, 2004, 4(1): 13-22.
[15]Wick G, Perschinka H, Xu Q. Autoimmunity and atherosclerosis[J]. Am Heart J, 1999, 138(2): S444-449.
[16] 林宇, 许莉, 王小明. 银杏内酯B对内皮细胞损伤的保护作用及机制[J]. 齐齐哈尔医学院学报. 2006, 27(8): 897-898.
[17]Li R, Chen B, Wu W, et al. Ginkgolide B suppresses intercellular adhesion molecule-1 expression via blocking nuclear factor-κB activation in human vascular endothelial cells stimulated by oxidized low-density lipoprotein[J]. J Pharmacol Sci, 2009, 110(3): 362-369.
[18] 于晓红. 银杏内酯B, α-玉米赤霉醇对TNFα刺激内皮细胞的保护作用及机制[D]. 中国协和医科大学, 2006.

