甘珀酸对大鼠大脑中动脉缺血再灌注后星形胶质细胞增殖及活化的影响
杨 洁 苏 醒 张秋佳 谢敏杰 喻志源 王 伟
(华中科技大学同济医学院附属同济医院神经内科 湖北 武汉430030)
胶质细胞增殖活化是脑缺血损伤后中枢神经系统最早期及最显著的反应之一。星形胶质细胞可以通过缝隙连接形成一个巨大的功能合胞体[1],在大脑中动脉缺血再灌注损伤过程中,缝隙连接在梗死灶范围的二次扩展中起到了重要的作用[2]。本研究通过观察大鼠大脑中动脉缺血再灌注不同时间点,缝隙连接阻断剂甘珀酸对梗死半暗带中星形胶质细胞增殖和活化的影响,以期为脑梗死的治疗提供新的思路。
材料和方法
1.试剂与仪器
甘珀酸购自美国Sigma公司,抗GFAP鼠多克隆抗体(美国Thermo公司),抗Ki67兔多克隆抗体(美国Millipoe公司),FITC标记的山羊抗鼠IgG(美国Jackson ImmunoResearch公司),HRP标记的山羊抗鼠IgG(中国武汉博士德生物工程有限公司),抗PCNA鼠单克隆抗体(美国Santa公司)。其他化学试剂均为国产分析纯试剂。鼠脑立体定位仪为日本Narishige公司SN26型。手术显微镜为德国Zeiss公司12FR型。微量注射器(中国上海安亭,5μl型),恒温冰冻切片机(德国 Leica公司,CM1900型);荧光显微镜(日本 Olympus公司,BX51型)。
2.实验动物与分组
成年雄性SD大鼠80只,体质量约250g-300g,由华中科技大学同济医学院实验动物中心提供。动物随机分为生理盐水组(n=35)、CBX干预组(n=35)和假手术组(n=10)。
3.方法
3.1 甘珀酸侧脑室注射方法:
大鼠按0.5ml/100g体重经腹腔注射麻醉药(氯胺酮0.2g+氯丙嗪10mg+生理盐水4ml),将大鼠固定于鼠脑立体定位仪上,头顶正中矢状位切开皮肤,暴露颅骨找到Bregma点,将定位仪的原点与Bregma点对齐,移动定位仪,使其向后0.8 mm旁开1.4 mm处钻孔,钻破颅骨后立即停止,将微量注射器固定在定位仪上,从颅骨表面开始计算,进针3.8mm,回抽见有清亮液体流出即进针正确。CBX干预组缓慢注射10mmol/L的CBX溶液8μl,注射完毕后,停留10min,缓慢拔针。生理盐水组,给予同等体积的生理盐水。术毕缝合头皮。
3.2 局灶性脑缺血再灌注模型的制备
雄性SD大鼠(由华中科技大学同济医学院实验动物中心提供)称重,按1ml/200g体重剂量腹腔注射氯胺酮+氯丙嗪混和麻醉剂进行麻醉。胶带固定上下肢,垫高颈部。牵出舌头,颈部备皮,消毒,沿颈正中线切开皮肤,钝性分离两侧甲状腺,暴露右侧胸锁乳突肌,暴露胸骨舌骨肌三角区。分离结扎动脉:分离颈总动脉与迷走神经,找到颈外动脉和颈内动脉的交叉处。在外科显微镜下,结扎颈内、外动脉分叉处的颈外动脉,同时结扎颈总动脉的近心端。在颈总动脉远心端各松打一个结,并用动脉夹夹闭颈总动脉。在颈总动脉两结之间斜剪切口,快速插入线栓(头端圆钝),并用颈总动脉远心端的结线固定后,松开动脉夹。线栓顺颈总动脉走向缓慢推进至颈内动脉直至感觉有少许阻力为止(从颈内、外动脉分叉处起始插入约20mm),阻断右侧大脑中动脉的血流,造成右侧大脑中动脉供血区缺血。保留线栓1h后缓慢退出线栓即可实施再灌注。再次结扎固定栓子带线,整理组织,缝皮。手术结束后,将动物放回笼中,待其自然苏醒,正常饮食。
3.3 鼠脑标本采集
术后的大鼠,在再灌注6h,1d,3d,7d断头取脑,用OTC胶包裹,置于-80℃的异戊烷中快速冷冻。标本收集好后,取梗死层面,在-20℃的切片机中连续切片,片厚10μm贴于多聚赖氨酸包被的载玻片上,置于-80℃保存。
3.4 免疫印迹测量相对蛋白含量
在各个时间点各取5只鼠脑,每只鼠脑取右侧梗死边缘区半暗带组织。按照组织质量0.1g加1ml RIPA裂解液(含1%蛋白酶抑制剂混合物cooktail)的比例混合投入1.5ml匀浆器中,冰浴中用玻璃匀浆器匀浆,直至充分碾碎。冰上裂解和超声裂解各两次;4℃下12000rpm离心10min;取上清转入另一个1.5ml Ep管中。每一样品取1μl用于蛋白浓度的测定,剩余样本各取400μl,加入5×SDS加样缓冲液100μl(临用前加入25%的β巯基乙醇),震荡混匀;95℃热变性蛋白10min后取出,冷却、分装、编号后置于-80℃冻存。
用BCA法测定蛋白浓度,根据60μg总蛋白量,计算出每孔的上样体积。常规Western Blots方法进行电泳,转膜,封闭,孵育一抗,孵育二抗然后用ECL进行显影曝光。曝光出的条带在Image J软件中计算出相对灰度进行统计计算。
3.5 免疫荧光染色
将制备好的标本在染色前投入4℃预冷的4%多聚甲醛溶液中固定。经过破膜,封闭后滴加一抗,4℃冰箱中反应过夜,然后取出后PBS漂洗3次,滴加二抗避光室温孵育1h,PBS漂洗后用50%的甘油封片。
4.统计学分析
采用图像分析软件(Image Pro-Plus)对图像进行数字化分析GFAP+Ki67双阳性细胞数。所得数据用均数±标准差(±SD);所有数据经计算机SPSS 11.0软件采用独立样本t检验进行统计学分析;以P<0.05为差异有统计学意义。
结 果
1.CBX对半暗带区星形胶质细胞活化的影响
星形胶质细胞在缺血半暗带区增生活化,首先表现为胞体肥大,轴突增多,轴突的分支逐渐增多密集,在第3d时增生达到高峰。给予缝隙连接阻断剂CBX后,半暗带区的星形胶质细胞活化明显减慢,到第7d时才达到高峰(图1A)。用免疫印迹方法检测GFAP蛋白表达情况,可见CBX干预组在6h、1d和3d时明显抑制GFAP的表达(图1B,C)(P<0.05)。
2.大鼠大脑中动脉缺血再灌注边缘区的Ki67表达
Ki67抗体是一种原型的细胞周期相关核蛋白,表达在增殖细胞中,在处于静止期的细胞中是缺乏的。采用Ki67与GFAP免疫荧光双染色发现:在缺血再灌注早期,6h时Ki67阳性的星形胶质细胞数量较少,与正常对照组相比没有显著性差异,在第3d,半暗带区星形胶质细胞增殖达到高峰(图2B),同时CBX干预组与生理盐水组对比Ki67和GFAP双阳性的细胞明显减少(*P<0.01;**P<0.05)(图2A,B)。
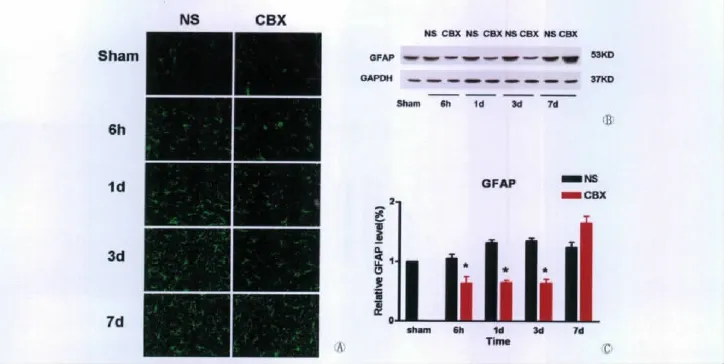
图1 (A)各时间点半暗带区免疫荧光显示GFAP表达量的变化(绿色荧光显示的是星形胶质细胞);(B)不同时间点CBX干预组和生理盐水组GFAP的表达量;(C)不同时间点GFAP表达量统计图(n=12*与sham组相比P<0.05)Fig.1 The expression of GFAP in penumbra zone after ischemia-reperfusion 6h、1d、3d and 7d.Figure A:GFAP staining(green)(×400);Figure B:Representative Western blots show that GFAP were downregulated after ischemia-reperfusion 6h、1d and 3d upon CBX treatment;Figure C:Statistical data of the protein expression levels of GFAP vs.control(n=12*P<0.05).

图2 (A)MCAO3d缺血半暗带区Ki67和GFAP的表达;(B)Ki67和GFAP双阳性的细胞占GFAP阳性细胞比例统计图(n=25*与sham组相比P<0.01;**与sham组相比P<0.05)。Fig.2 The expression of Ki67 and GFAP in penumbra zone after ischemia-reperfusion.Figure A:Double immunolabeling of Ki67(red)and GFAP(green)in penumbra zone after ischemia-reperfusion 3d;Figure B:Statistical analysis of the percentage of Ki67(+)astrocytes in the control and CBX-treated conditions.
3.大鼠大脑中动脉缺血半暗带区PCNA表达情况
增殖细胞核抗原(the proliferating cell nuclear antigen,PCNA)是一种在G1早期和S期表达的核抗原。在对MCAO缺血再灌注边缘区进行蛋白定量测定时发现:与生理盐水组相比,CBX干预6h,1d,3d,7d后,CBX干预组PCNA的表达量较生理盐水组并没有明显的下降(P>0.05)(图3A,B)。

图3 (A)不同时间点半暗带区PCNA的表达量;(B)不同时间点半暗带区PCNA表达量统计图。Fig.3 The expression of PCNA in penumbra zone after ischemia-reperfusion 6h、1d、3d and 7d.Figure A:PCNA was determined in penumbra zone by Western blotting;Figure B:Statistical data of the protein expression levels of PCNA after ischemia-reperfusion 6h、1d、3d and 7d.
讨 论
脑缺血后,由于坏死物质不断刺激,梗死周围区的星形胶质细胞开始出现胞体肥大,轴突增多形成反应性星形胶质细胞[3]。反应性胶质细胞通过缝隙连接通讯将坏死信号逐渐向远处传递,使半暗带区更多的星形胶质细胞增殖活化进而逐渐扩大梗死面积[4],同时将坏死组织局限在原位。小胶质细胞增生活化吞噬坏死组织。不断增殖的星形胶质细胞覆盖及填充坏死区域逐渐形成胶质瘢痕[5]。在这一过程中,反应性星形胶质细胞及垂死的星形胶质细胞会吞噬半暗带区的神经元,影响神经元的突触重塑[6]。因此,星形胶质细胞的活化和增殖对最终脑缺血损伤的加重和抑制具有至关重要的作用。
甘珀酸(carbenoxolone CBX)是一种广泛的缝隙连接阻断剂,在早期CBX主要通过去磷酸化使缝隙连接通道关闭。晚期也通过减少缝隙连接蛋白的表达量减少缝隙连接通讯。本实验采用侧脑室注射的方法快速阻断中枢神经系统的缝隙连接通讯,同时减少腹腔注射带来的降低血压减慢心率的副作用。
本实验采用大鼠大脑中动脉缺血再灌注模型,结果发现:经过CBX预处理后,半暗带区星形胶质细胞的活化明显受到抑制。在MCAO缺血再灌注6h、1d、3d时CBX干预组缺血半暗带区表达的GFAP含量显著少于生理盐水组,(P<0.05,差异有统计学意义)。GFAP是星形胶质细胞表达的特异性蛋白,是星形胶质细胞活化的标志。免疫荧光显示,在缺血半暗带不同时间点,CBX干预组GFAP的表达量均少于生理盐水组。既往的研究表明,在脑缺血时,星形胶质细胞的缝隙连接通道仍处于开放状态[7]。钙离子、谷氨酸等凋亡信号通过缝隙连接从梗死中心逐渐向周围扩散,激活更多的胶质细胞参与应激[8]。推测CBX阻断凋亡信号的传播从而减少星形胶质细胞的过度活化。
Ki67是细胞周期相关抗原,是处于增殖期的细胞核表达的特异抗原。本实验运用免疫荧光双标的方法观察到:生理盐水组在缺血再灌注3d时,Ki67的表达量达到高峰。在缺血再灌注的1d、3d、7d时,CBX干预组与生理盐水组相比Ki67和GFAP双阳性的细胞明显减少(*P<0.01;**P<0.05),说明CBX抑制星形胶质细胞的增殖。PCNA是所有增殖细胞表达的核抗原,本实验结果表明:CBX干预6h,1d,3d,7d后,CBX干预组PCNA的表达量与生理盐水组比较并没有显著性差异(P>0.05),说明CBX并不抑制所有增殖细胞的增殖反应。在脑缺血后小胶质细胞的增殖异常活跃,这可能掩盖了CBX对星形胶质细胞增殖的抑制作用。
以上结果表明:甘珀酸可以抑制缺血导致的星形胶质细胞的活化和增殖。这种抑制作用在缺血再灌注的早期较为明显。甘珀酸可能是通过阻断凋亡信号的传递从而达到抑制的目的。通过调节缝隙连接通讯可以调节反应性增生的星形胶质细胞,这为脑缺血损伤的治疗提供了新的药物作用靶点,为今后研发新的治疗药物提供了一定实验依据。
[1]E Dere and A Zlomuzica.The role of gap junctions in the brain in health and disease.Neurosci Biobehav Rev,2012,36(1):206-217
[2]M Xie,C Yi,X Luo,et al.Glial gap junctional communication involvement in hippocampal damage after middle cerebral artery occlusion.Annals of Neurology,2011,70(1):121-132.
[3]T Nakase,S Fushiki,G Sohl,et al.Neuroprotective role of astrocytic gap junctions in ischemic stroke.Cell Commun Adhes,2003,10(4-6):413-417
[4]A Hazell.Excitotoxic mechanisms in stroke:An update of concepts and treatment strategies.Neurochemistry International,2007,50(7-8):941-953
[5]DJ Rossi,JD Brady,and C Mohr.Astrocyte metabolism and signaling during brain ischemia.Nat Neurosci,2007,10(11):1377-1386
[6]W Guo,H Wang,M Watanabe,et al.Glial-Cytokine-Neuronal Interactions Underlying the Mechanisms of Persistent Pain.Journal of Neuroscience,2007,27(22):6006-6018
[7]ML Cotrina,J Kang,JH Lin,et al.Astrocytic gap junctions remain open during ischemic conditions.J Neurosci,1998,18(7):2520-2537
[8]T Molnar,A Dobolyi,G Nyitrai,et al.Calcium signals in the nucleus accumbens:Activation of astrocytes by ATP and succinate.Bmc Neuroscience,2011,12(10):96-97

