甲状旁腺素促进小鼠软骨细胞成软骨和抑制其终末期分化的实验研究
田 野 徐 莹 付 勤
(中国医科大学附属盛京医院脊柱关节骨科,1中国医科大学附属盛京医院麻醉科,沈阳110004)
骨关节炎是一种以关节软骨破坏和骨赘形成为特征的退变性疾病,患肢关节经常出现严重的疼痛,导致关节功能降低,对病人的生存质量造成明显的影响[1]。近几年的研究表明,骨关节炎软骨细胞和骨骺软骨生长板内的细胞一样,都要经历终末期成熟分化的过程[2];对于骨关节炎的治疗,则以抑制骨关节炎软骨细胞的病理生理过程,即以抑制其终末期成熟分化为基础[3]。本研究以新生小鼠胸骨软骨细胞为细胞模板,探索甲状旁腺素(PTH)是否对其具有促进成软骨和抑制其终末期成熟分化的作用。
材料和方法
1.实验动物和主要试剂
昆明新生小鼠(出生4日内,由中国医科大学实验动物中心提供);1-34重组人甲状旁腺素(Sigma公司);高糖DMEM培养基(Gibco公司);标准胎牛血清(FBS,Hyclone);链霉蛋白酶和二型胶原酶(上海艾研生物科技有限公司);Alcian蓝染色试剂(Sigma公司);ALP 染色 one-step试剂(Pierce 公司);RNeasy试剂盒(Qiagen公司);逆转录试剂盒(Invitrogen 公 司);SYBR Green(Applied Biosystems公司);ALP兔抗鼠单克隆抗体(santa cruz biotechnology公司);Runx2兔抗鼠单克隆抗体(abcam公司);Sox9和Aggrecan兔抗鼠单克隆抗体(santa cruz biotechnology公司);β-actin兔抗鼠单克隆抗体(Sigma公司)。
2.方法
2.1 细胞分离和培养:分离新生小鼠的胸骨和肋骨,PBS冲洗1次,加入链霉蛋白酶(2mg/ml),37℃水浴震荡1h;PBS冲洗3次,加入二型胶原酶(3mg/ml),37℃水浴震荡1h;PBS冲洗3次,将消化剩余物移入表面皿中,再次加入二型胶原酶(3mg/ml),置于孵育箱内4-6h,每隔1h震荡一次;通过0.7μm过滤器过滤,收集滤过液,1200rpm离心5m,收集沉淀,重悬细胞,将细胞种植于6孔或12孔培养板中,置于37℃、5%CO2孵箱中培养。
2.2 细胞分组和处理:将细胞分为两组:盐水对照组和PTH处理组,于种植后24h,开始用生理盐水或PTH(100n M)每日处理细胞。每日观察细胞形态,并于第3-7日间,每日收集细胞进行染色、RT-PCR和Westernblot等实验。
2.3 Alcian蓝染色:吸除细胞培养液,PBS清洗2次,于室温下以10%中性福尔马林固定细胞20min;吸除福尔马林,PBS清洗2次,加入Alcian蓝染色剂(p H2.5),室温下孵育2h;吸除染色剂,70%乙醇清洗细胞2次,去离子水清洗细胞3次,室温下自然干燥过夜。
2.4 碱性磷酸酶(ALP)染色:吸除细胞培养液,PBS清洗2次,于室温下以10%中性福尔马林固定细胞15min;吸除福尔马林,PBS清洗2次,加入ALP one-step染色剂,于37℃孵育45min;吸除染色剂,PBS清洗2次,室温下自然干燥过夜。
2.5 RNA 提 取 和 实 时 RT-PCR(Real-time RT-PCR):用RNeasy试剂盒提取细胞总RNA,按逆转录试剂盒说明书逆转录合成cDNA,然后稀释3倍,取1μl稀释后的cDNA进行实时PCR反应。特异性小鼠引物序列如下:ALP:Sense:TGACCTTCTCTCCTCCATCC,Antisense:CTTCCTGGGAGTCTCATCCT; Runx2:Sense: GGAATGATGAGAACTA,Antisense:ACCGTCCACTGTCACTTT;Sox9:Sense:CTAATGCTATCTTCAAGGCGCTGC, Antisense: CTCGCTTCAGATCAACTT TGCCAG;Aggrecan:Sense:CGTGTTTCCAGAGAAAAGGA, Antisense:TGTGCTCGATCAAAGTCCAG;β-actin:Sense:AGATGTGGATCAGCAAGCAG; Antisense:GCGCAAGTTAGGTTTTGTCA.反应条件为:95℃预变性15min后,95℃变性20s,58℃退火30s,72℃延伸30s,共45个循环,于72℃延伸阶段检测荧光产物,生成扩增曲线。在同一次反应中,各组均设3个平行重复。以β-actin为内参基因,通过Rotor Gene分析软件进行定量分析。
2.6 Western Blot检测蛋白:以Golden lysis buffer液提取细胞总蛋白,BCA法测定蛋白浓度,每泳道上样40μg,经10%聚丙烯酰胺凝胶电泳分离蛋白,转至PVDF膜。加入一抗(1∶1000)4℃孵育过夜,洗膜后,加入二抗(1∶3000)室温下孵育1h。以β-actin为内参基因,Supersignal west Pico试剂孵育10分钟,曝光20s,照相并分析。
3.统计学处理
全部数据以均数+标准差表示,用SPSS13.0统计软件进行统计学分析,组间比较采用t检验和单因素方差分析;当P<0.05时认为有统计学意义。
结 果
1.新生小鼠胸骨软骨细胞的分化特征
未经处理的新生小鼠胸骨软骨细胞的ALP染色强度逐渐增强 (图1);成软骨因子基因表达逐渐减弱,促病理性肥大基因表达逐渐增强(图2)。以上结果表明,新生小鼠胸骨软骨细胞具有自发性成熟分化的特点。
2.PTH对新生小鼠胸骨软骨细胞形态学的影响
未经处理的新生小鼠胸骨软骨细胞于种植后24小时贴壁生长,于5天达到80%-90%融合,之后细胞开始逐渐失去软骨细胞形态。但与对照组相比,经PTH处理后,于5-7天细胞融合后,细胞仍更多的保持软骨细胞形态 (图3)。
3 PTH对新生小鼠胸骨软骨细胞Alcian蓝染色和ALP染色的影响
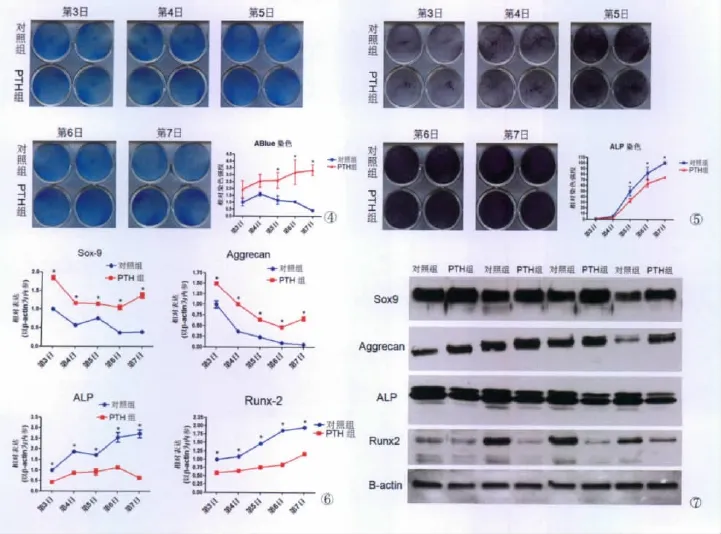
对照组新生小鼠胸骨软骨细胞Alcian蓝染色强度,随培养时间逐渐减弱;经PTH处理组染色强度,随时间逐渐增强,且于第5、6和7日,与对照组相比,有明显统计学差异(P<0.05)(图4)。两组新生小鼠胸骨软骨细胞ALP染色强度,均随时间逐渐增强,但PTH组与对照组相比增强缓慢,于第5、6和7日,PTH明显降低了ALP的染色强度,二者比较,有显著统计学差异(P<0.05)(图5)。
4.PTH对新生小鼠胸骨软骨细胞成软骨和促病理肥大因子基因m RNA表达的影响
对照组和PTH组新生小鼠胸骨软骨细胞Sox9和Aggrecan基因的表达,均随时间逐渐下降;但在每一时间点,与对照组相比,PTH均明显提高细胞内Sox9和Aggrecan基因的表达,差异有统计学意义(P<0.05)。同时,两组细胞内ALP和Runx2基因的表达,均随时间逐渐升高,但与对照组相比,PTH组ALP和Runx2基因表达升高幅度较缓,在每一时间点,PTH均明显降低二基因的表达,差异有统计学意义(P<0.05)(图6)。
5.PTH对新生小鼠胸骨软骨细胞成软骨和促病理肥大因子蛋白表达的影响
与其基因表达一致,与对照组相比,PTH显著提高细胞内Sox9和Aggrecan蛋白的表达,显著降低细胞内ALP和Runx2蛋白的表达(图7)。
讨 论
人类甲状旁腺素(PTH)是含有84个氨基酸的多肽蛋白,具有调节血钙、血磷,维持细胞外液内环境的重要作用,其人工合成体PTH(1-34),含有34个PTH N端氨基酸序列相似分子片段,这一部分能够与PTH受体结合而发挥相同的生物学作用[4-6]。在体实验表明,PTH(1-34)能够抑制大鼠膝关节骨性关节炎疾病的进展,但是具体的细胞学机制不甚明了[7]。
本研究表明,新生小鼠的胸骨软骨细胞具有自发性成熟分化的特征,正如前述,骨关节炎软骨细胞也具有向终末期成熟分化的特征。因此新生小鼠胸骨软骨细胞的部分生物学特征与骨关节炎软骨细胞极为相似,我们以此为依据,探索PTH(1-34)是否对离体软骨细胞具有抑制终末期分化的作用。
近年来的研究结果证实,骨关节炎软骨细胞经历了终末期、病理肥大分化和基质分泌减少的病理生理过程[8]。对于骨关节炎的治疗研究,可以基于抑制软骨细胞终末期、病理肥大分化和促进软骨细胞基质形成两方面[9]。在骨关节炎细胞中,促成熟分化因子和部分酶类,如碱性磷酸酶(ALP)、X型胶原(Col10)和MMP等的表达,明显增高;成软骨因子,如Ⅱ型胶原(Col2)和Aggrecan等的表达,则明显减低。在转录水平,转录因子Sox9和Runx2在调控软骨细胞增生和分化的方面发挥着关键性的作用。Sox9是软骨细胞增生和成软骨因子,如Col2、Aggrecan等合成的重要调节因子;Runx2则是软骨细胞终末期、病理肥大分化的关键启动因子,在骨关节炎的病理生理过程中起着关键性的作用[10-12]。
我们的研究结果显示,PTH明显增强Alcian蓝染色的强度,降低ALP染色的强度,表明PTH一方面增强了软骨细胞中软骨基质-蛋白多糖的合成,另一方面则起到抑制碱性磷酸酶合成的作用,而后者是软骨细胞终末期分化的重要标志性蛋白。另外,RT-PCR和 Westernblot结果显示,无论在m RNA水平,或是蛋白水平,PTH均显著提高成软骨因子Sox9和Aggrecan的表达,降低病理性肥大分化因子Runx2和ALP的表达。
综上所述,PTH能够直接促进软骨细胞的成软骨作用,抑制软骨细胞的终末期成熟分化,本研究为PTH抑制骨关节炎疾病的进展,在细胞学水平提供了一定的依据。
[1]Umlauf D,Frank S,Pap T,et al.Cartilage biology,pathology,and repair.Cell Mol Life Sci,2010,67:4197-4211
[2]Rountree RB,Schoor M,Chen H,et al.BMP receptor signaling is required for postnatal maintenance of articular cartilage.PLoS Biol,2004,2:e355
[3]Samuels J,Krasnokutsky S,Abramson SB,et al.Osteoarthritis:a tale of three tissues.Bull NYU Hosp Jt Dis,2008,66:244-250
[4]Kent GN,Loveridge N,Reeve J,et al.Pharmacokinetics of synthetic human parathyroid hormone 1-34 in man measured by cytochemical bioassay and radioimmunoassay.Clin Sci(Lond),1985,68:171-177
[5]Mosekilde L,Tornvig L,Thomsen JS,et al.Parathyroid hormone and growth hormone have additive or synergetic effect when used as intervention treatment in ovariectomized rats with established osteopenia.Bone,2000,26:643-651
[6]Koh AJ,Demiralp B,Neiva KG,et al.Cells of the osteoclast lineage as mediators of the anabolic actions of parathyroid hormone in bone.Endocrinology,2005,146:4584-4596
[7]Chang JK,Chang LH,Hung SH,et al.Parathyroid hormone 1-34 inhibits terminal differentiation of human articular chondrocytes and osteoarthritis progression in rats.Arthritis Rheum,2009,60:3049-3060
[8]Martinek V.Anatomy and pathophysiology of articular cartilage.Dtsche Z Sportmed,2003,54:166-170
[9]Abramson SB,Attur M.Developments in the scientific understanding of osteoarthritis.Arthritis Res Ther,2009,11:227
[10]Goldring MB.The role of cytokines as inflammatory mediators in osteoarthritis:lessons from animal models.Tissue Res,1999,40:1-11
[11]Fernandes JC,Martel-Pelletier J,Pelletier JP.The role of cytokines in osteoarthritis pathophysiology.Biorheology,2002,39:237-246
[12]Goldring SR,Goldring MB.The role of cytokines in cartilage matrix degeneration in osteoarthritis.Clin Orthop Relat Res,2004,427:27-36
图 版 说 明
图1 新生小鼠胸骨软骨细胞ALP染色强度的变化
图2 新生小鼠胸骨软骨细胞成软骨因子和促病理性肥大因子基因mRNA表达的变化
图3 PTH对新生小鼠胸骨软骨细胞形态学的影响
图4 PTH对新生小鼠胸骨软骨细胞Alcian蓝染色的影响。★P<0.05
图5 PTH对新生小鼠胸骨软骨细胞ALP染色的影响。★P<0.05
图6 PTH对新生小鼠胸骨软骨细胞细胞因子mRNA表达的影响。★P<0.05
图7 PTH对新生小鼠胸骨软骨细胞细胞因子蛋白表达的影响
EXPLANATION OF FIGURES
Fig.1 ALP staining of mouse sternal chondrocytes
Fig.2 Chondrogenic and hypertrophic marker genes m RNA expression of mouse sternal chondrocytes
Fig.3 Morphology changes of mouse sternal chondrocytes by PTH treatment
Fig.4 Alcian blue staining changes of mouse sternal chondrocytes by PTH treatment,★denotes statistical significance from controls(P<0.05)
Fig.5 ALP staining changes of mouse sternal chondrocytes by PTH treatment,★denotes statistical significance from controls(P<0.05)
Fig.6 Marker genes expression of mouse sternal chondrocytes by PTH treatment,★denotes statistical significance from controls(P<0.05)
Fig.7 Westernblot changes of mouse sternal chondrocytes by PTH treatment