甘草酸二铵脂质配位体对非酒精性脂肪肝大鼠白细胞浸润的影响
刘梅梅 王 齐 刘晓利 陈晓宇*
(安徽医学高等专科学校组织学与胚胎学教研室,合肥230601;1安徽医科大学,合肥230032)
非酒精性脂肪肝(nonalcoholic fatty liver dieases,NAFLD)已经成为一种累及世界范围内大量人群的全球性疾病,在总人群中NAFLD的患病率已达约20%[1]。NAFLD的确切发病机制目前仍不清楚,但是炎症细胞浸润是NAFLD的关键病理环节[2,3]。炎症反应既可以引发肝细胞脂肪变性、损伤,又会进一步促进氧化和纤维化的进程,因此,抑制炎症细胞浸润在NAFLD治疗中是非常关键的。甘草酸二铵脂质配位体(diammonium glycyrrhizinate lipid ligand,DGLL,天晴甘平)是中药甘草有效成分的第3代提取物,具有较强的抗炎和保护肝细胞膜以及改善肝功能的作用。以往的药理实验证明,DGLL能减轻高脂饮食大鼠引起的肝损伤,降低血清ALT、AST、TC、TG含量,从而起到保护肝脏的作用[4]。我们近来的研究表明,DGLL对于治疗高脂饲料诱导大鼠非酒精性脂肪肝中肝脏组织及血清中炎症因子TNF-α的释放有明显的抑制作用,这种抑制作用与其抑制NF-κB炎症反应系统的活化相关[5]。然而,DGLL对NAFLD过程中炎症细胞的浸润是否有抑制作用及其作用机制尚不清晰。本研究通过高脂饲料建立大鼠非酒精性脂肪肝模型,观察DGLL对非酒精性脂肪肝大鼠肝脏组织中白细胞浸润的影响及其内在机制。
材料和方法
1.材料
1.1 药品和试剂 DGLL肠溶胶囊,江苏正大天晴药业股份有限公司(批号:091205)。联苯双酯片(BDP),北京协和药厂产品(批号:090802)。髓过氧化物酶(myeloperoxidase,MPO)活性检测试剂盒购自南京建成生物工程研究所。兔抗大鼠MPO、ICAM-1多克隆一抗、辣根过氧化物酶标记山羊抗兔IgG二抗均购自Santa Cruz公司。FITC标记的大鼠CD11b和CD18抗体购自BD Biosciences公司。
1.2 动物 Spague-Dawlay(SD)大鼠,雄性,体重180-200 g,由安徽医科大学实验动物中心提供(皖医实动准第01号)。动物自由进食,饮水,喂标准颗粒饲料,室温18℃-22℃,常规饲养1周后用于实验。
1.3 主要仪器 Leica荧光显微镜,德国Leica公司。722S分光光度仪,上海精密科学仪器公司产品。超薄切片机,LKB-NOVA型,瑞典。医学图像分析系统,成都泰盟科技有限公司。PowerPac300型电泳仪,美国BIO-RAD公司。FACS Calibur流式细胞仪,美国BD公司。
2.方法
2.1 造模、分组与给药 60只SD大鼠适应性饲养1周后随机分6组:正常对照组、模型组、DGLL(30、60、120mg/kg)组,阳 性 对 照 药 BDP(200mg/kg)组[6,7],每组10只。NAFLD模型的建立参照文献方法[8]。正常组给予相应溶媒,模型组及给药组均给予高脂乳剂灌胃(10ml/kg)。高脂乳剂灌胃3周后,DGLL干预组在造模的同时每日灌胃给予相应浓度DGLL或BDP 1次,正常组和模型组给予等量生理盐水。每周称重一次,相应调整灌胃量。
2.2 样本采集和处理 实验6周末禁食12h后股动脉取血,血液以肝素抗凝,用于测定外周血白细胞粘附分子的表达;放血处死动物,迅速取部分肝组织,用于检测肝组织MPO的活性以及ICAM-1的蛋白表达。
2.3 MPO活性检测 采用酶联免疫吸附法(ELISA)检测肝脏组织中的 MPO活性,操作严格按试剂盒说明书进行。
2.4 免疫组化染色 取部分受试动物同部位肝组织,置于4%多聚甲醛中固定。经乙醇脱水、二甲苯透明、石蜡包埋、5μm连续切片,采用SABC法进行免疫组化染色:3%H2O2溶液处理,热修复抗原,5%BSA封闭,滴加大鼠MPO单克隆抗体一抗(浓度1∶200),4℃过夜,隔夜滴加生物素化养抗兔IgG二抗,37℃孵育20 min,再滴加试剂SABC,DAB显色。
2.5 外周血粘附分子检测 在抗凝缺血中加入FITC标记的大鼠CD11b和CD18抗体(1μg/100μl全血),室温避光孵育30 min。溶血素溶血,PBS洗涤后上流式细胞仪检测,计算单核细胞以及中性粒细胞表面CD11b和CD18的表达量,结果以平均荧光强度表示[9]。
2.6 Western blot分析 提取肝脏组织总蛋白,采用考马斯亮蓝G-250染色法检测蛋白含量。用牛血清白蛋白制作标准曲线,测量样品在595nm处的吸光度,计算各组肝组织总蛋白含量。采用Western blot法检测肝组织中ICAM-1蛋白的表达。各组以30μg蛋白/泳道上样,经10%SDSPAGE电泳分离后,电转移到PVDF膜上,5%脱脂奶粉封闭液室温封闭1hr,加入小鼠抗大鼠ICAM-1一抗(1∶1000,4℃,过夜)及抗辣根过氧化物酶标记的羊抗鼠IgG(1∶2000)进行杂交,ECL超敏发光试剂盒检测杂交信号,显影于感光胶片上。另以β-actin作为内参,于医学图像分析系统上分析ICAM-1蛋白表达的相对含量。
结 果
1.DGLL对高脂乳剂诱导SD大鼠NASH模型肝脏组织MPO表达和活性的影响
免疫组化结果显示,肝脏组织MPO蛋白阳性染色呈棕黄色(箭头所示)。正常组大鼠几乎没有MPO蛋白表达,模型组MPO蛋白阳性细胞,比正常组细胞数明显增多,染色加深。与NAFLD模型组比较,30、60、120 mg/kg DGLL 组 MPO 蛋白表达随着剂量的增加而逐渐减弱,200mg/kg BDP组MPO蛋白在肝细胞中表达也减弱,结果见图1。与免疫组化结果相似,相比于正常组,高脂模型组MPO活性同样显著升高,而DGLL剂量依赖性地抑制了肝脏组织中 MPO的活性(P<0.05,图2)。该结果表明DGLL可以抑制高脂饮食造成的非酒精性脂肪肝大鼠肝脏组织中炎性细胞的活化和浸润。
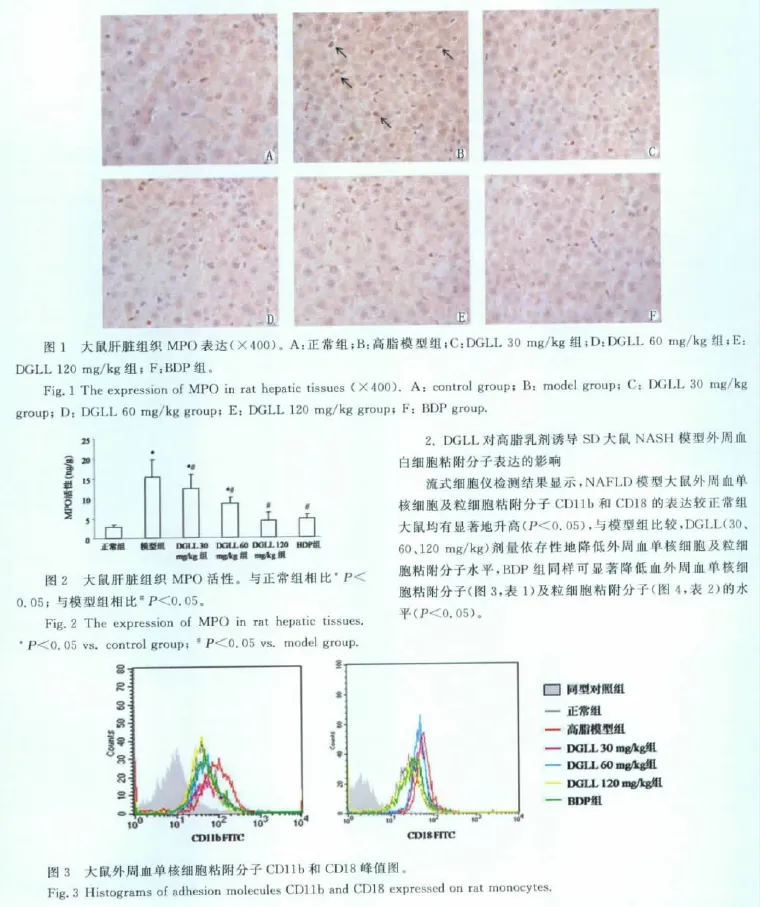
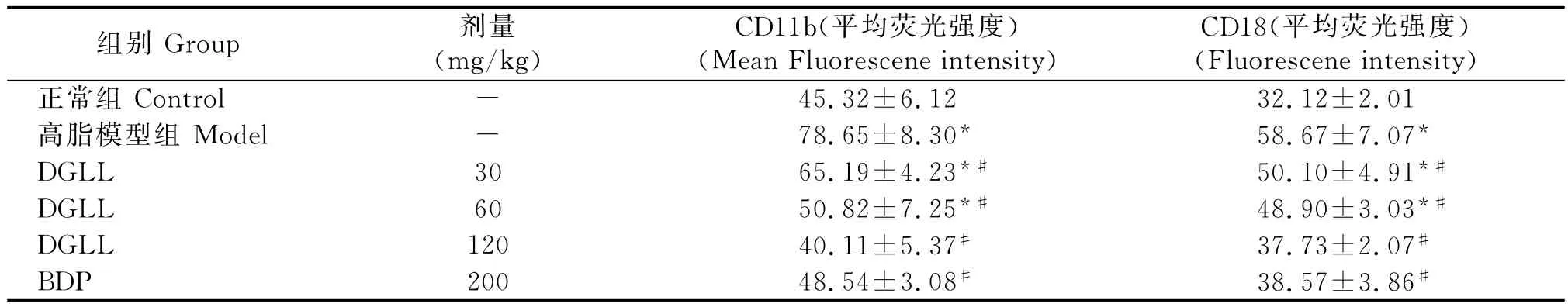
表1 大鼠外周血单核细胞粘附分子表达水平Table 1 The expression of adhesion molecules on rat monocytes

图4 大鼠外周血粒细胞粘附分子CD11b和CD18峰值图。Fig.4 Histograms of adhesion molecules CD11b and CD18 expressed on rat neutrophils.
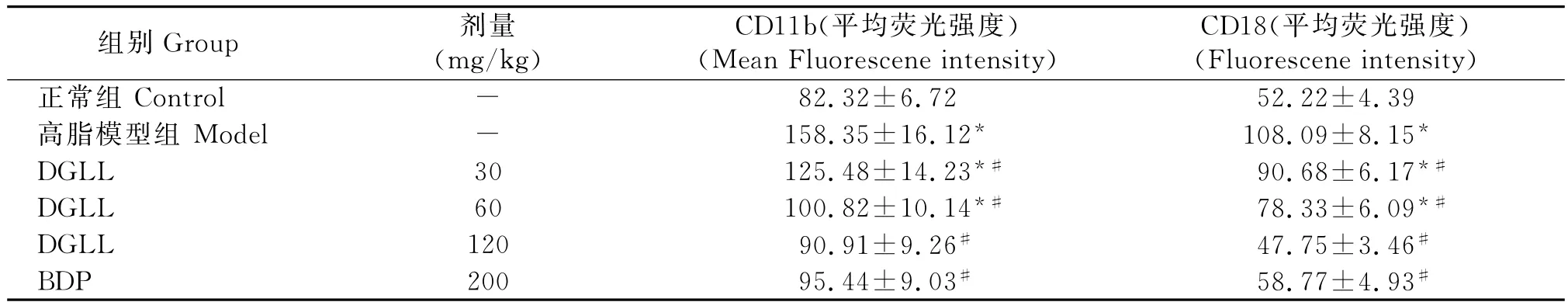
表2 大鼠外周血单核细胞粘附分子表达水平Table 2 The expression of adhesion molecules on rat neuthophils
3.DGLL对高脂乳剂诱导SD大鼠NASH模型肝脏组织中内皮细胞粘附分子表达的影响
图5A为Western blotting检测肝组织中ICAM-1蛋白表达的结果。以β-actin为内参照,将每组3例样本目的条带光密度扫描进行半定量分析,统计结果见图5B。相比于正常对照组,高脂模型组ICAM-1的蛋白表达显著增加(P<0.05),DGLL治疗组剂量依存性的显著下调了ICAM-1的蛋白表达(P<0.05),BDP组ICAM-1的蛋白表达同样较高脂模型组显著降低(P<0.05)。

图5 大鼠肝脏组织ICAM-1蛋白的表达。与正常组相比*P<0.05;#与模型组相比#P<0.05。Fig.5 The expression of ICAM-1 in rat hepatic tissues.*P<0.05 vs.control group;#P<0.05 vs.model group.
讨 论
流行病学调查表明,NAFLD患病率趋于超越病毒性肝炎和酒精性肝病,已成为全球普遍关注的医学问题和社会问题。在NAFLD发病过程中,肝脏组织中炎性介质的释放和炎性细胞的浸润是关键的病理环节。大量的临床试验和动物实验表明,在NAFLD病人及动物模型中,IL-6、IL-18、C反应蛋白以及 TNF-α等炎性介质均明显增加[5,10],由此引发的炎性细胞(如白细胞)的活化以及向肝脏组织的浸润是NAFLD过程中炎症反应加重,进而导致肝脏细胞损伤以及纤维化的关键环节[11,12]。我们以往的研究表明,DGLL对于NAFLD大鼠模型中肝脏组织及血清中的炎症因子如TNF-α的释放有明显的抑制作用,然而其对白细胞的活化以及组织浸润的过程是否有改善作用尚未见报道。组织中MPO的表达和活性是白细胞的活化以及组织浸润的标志物,本研究采用免疫组织化学的方法,证明了DGLL可以抑制高脂饮食诱导的大鼠NAFLD中MPO在肝脏组织的表达。同时,本实验还用ELISA的方法定量的检测了肝脏组织中MPO的活性,与免疫组织化学的结果一致,DGLL显著地下调了NAFLD大鼠肝脏组织中的MPO的活性。综合以上的结果,本实验首次证明了DGLL可以抑制高脂饮食诱导的大鼠NAFLD过程中白细胞的活化以及向肝脏组织的浸润。这为其在临床中治疗NAFLD提供了新的理论依据。
在NAFLD早期病理过程中,肝脏中的Kuffer细胞被激活,释放出包括TNF-α在内的多种炎性因子[13],同时,NAFLD 病理过程中,活性氧(reactive oxygen species,ROS)释放显著增加,这些炎性介质以及ROS均可以通过与白细胞以及内皮细胞的相互作用,上调白细胞与内皮细胞表面粘附分子的表达[14],增强白细胞与内皮细胞的粘附,而白细胞与内皮细胞的粘附是白细胞活化进而向组织浸润的初始环节。在白细胞与内皮细胞的粘附过程中,白细胞表面的粘附分子CD11b/CD18及其配体内皮细胞粘附分子ICAM-1的相互作用起着关键的作用[15]。本研究中,我们采用流式细胞技术定量的检测了NAFLD大鼠外周血中单核细胞以及粒细胞表面粘附分子表达,结果显示模型组中单核细胞以及粒细胞表面粘附分子CD11b和CD18的表达均有显著地升高,而采用DGLL对高脂诱导大鼠进行干预治疗,结果显示DGLL可剂量依赖性的显著抑制NAFLD大鼠外周血白细胞粘附分子的表达。同时,本研究还采用 Western blot的方法证实了NAFLD大鼠肝脏组织中的内皮细胞粘附分子ICAM-1的水平显著升高,DGLL干预组同样可以剂量依赖性的抑制内皮细胞表面粘附分子的水平,提示DGLL是通过抑制NAFLD大鼠外周血白细胞以及肝脏血管表面粘附分子的表达而抑制了白细胞与内皮细胞的粘附,从而进一步抑制了白细胞的活化以及向组织的浸润过程。我们前期实验已经证实DGLL可以抑制高脂导致的肝脏SOD活性的降低并减少肝脏MDA含量、抑制NAFLD大鼠肝线粒体损伤和肝微粒体CYP2E1的过度表达,从而抑制ROS的过量产生以及DGLL可以抑制NAFLD大鼠 TNF-α的释放以及 NF-κB信号系统的活化[5],因此,DGLL抑制粘附分子表达的作用可能与其抑制NAFLD大鼠过氧化物的产生以及炎症信号通路的作用相关。
[1]胡迎宾.非酒精性脂肪性肝炎的发病机制:病理生理学和分子生物学.世界华人消化杂志,2009,17(13):1329-1334
[2]Park SH.Nonalcoholic steatohepatitis:pathogenesis and treatment.Korean J Hepatol,2008,14(1):12-17
[3]Farrell GC,van Rooyen D,Gan L,et al.NASH is an inflammatory disorder:pathogenic,prognostic and therapeutic implications.Gut Liver,2012,6(2):149-171
[4]刘梅梅,王栋,刘晓利等.甘草酸二铵脂质配位体对非酒精性脂肪肝大鼠的影响.安徽医科大学学报,2010,45 (6):770-773
[5]刘梅梅,陈晓宇,王栋等.甘草酸二铵脂质配位体对非酒精性脂肪肝大鼠肿瘤坏死因子-α表达的影响及机制.安徽医科大学学报,2011,46(8):725-728
[6]黄咏梅,苏玉枝.舒肝汤对BCG/LPS所致小鼠免疫性肝损伤保护作用的研究.新中医,2009,41(3):106-108
[7]陈诗慧.加味四逆散对卡介苗加脂多糖所致小鼠肝损伤的保护作用.中国实用医药,2009,4(14):130-131
[8]王建青,李俊,邹宇宏等.非酒精性脂肪性肝炎模型的建立.安徽医科大学学报,2006,41(1):61-62
[9]Andonegui G,Bonder CS,Creen F,et al.Endotheliumderived Toll-like receptor-4 is the key molecule in LPS-induced neutrophil sequestration into lungs.J Clin Invest,2003,11(7):1011-1019
[10]Kuqelmas M,Hill DB,Vivian B,et al.Cytokines and NASH:a pilot study of the effects of lifestyle modification and vitamin E.Hepatology,2003,38(2):413-419
[11]Adler M,Taylor S,Okebugwu K,et al.Intrahepatic natural killer T cell populations are increased in human hepatic steatosis.World J Gastroenterol,2011,17(13):1725-1731
[12]Ezguer M,Ezguer F,Ricca M,et al.Intravenous administration of multipotent stromal cells prevents the onset of non-alcoholic steatohepatitis in obese mice with metabolic syndrome.J Hepatol,2011,55(5):1112-1120
[13]Tosello-Trampont AC,Landes SG,Nguyen V,et al.Kuppfer cells trigger nonalcoholic steatohepatitis development in diet-induced mouse model through tumor necrosis factor-αproduction.J Biol Chem,2012,287(48):40161-40172
[14]Markovic N,McCaig LA,Stephen J,et al.Mediators released from LPS-challenged lungs induce inflammatory responses in liver vascular endothelial cells and neutrophilic leukocytes.Am J Physiol Gastrointest Liver Physiol,2009,297(6):G1066-1076
[15]Carlos TM,Harlan JM.Leukocyte-endothelial adhesion molecules.Blood,1994,84(7):2068-2101

