MOC-31和CD44v6在良恶性腹水鉴别诊断中的应用
陈江帆 姜海娇 祝 迪 王秀茹 李建华
(中国医科大学附属第一医院病理科暨中国医科大学病理教研室,沈阳110001;1沈阳市红十字会医院病理科,沈阳110013)
腹水可由多种疾病引起,鉴别其性质对临床治疗和预后的评估有重要意义。恶性腹水是一种由腹腔原发肿瘤或转移瘤引起的并发症,也是恶性肿瘤晚期常见的问题。腹水细胞病理学检查是临床病理学检查的主要手段之一,也是帮助临床查找病因、了解病情进展的重要方法。膜式超薄液基细胞学检测(hologic thinprep cytologytest,HOLOGIC TCT)技术是近年应用于临床细胞病理学诊断的一项新技术,免疫细胞化学在脱落细胞学检查中具有重要意义,陈等[1]研究表明液基细胞学联合免疫细胞化学检查在恶性肿瘤细胞诊断中具有重要意义。本研究是采用酶联免疫吸附法对良恶性腹水标本MOC-31和CD44v6的含量进行检测,并运用液基细胞学联合免疫细胞化学方法检测MOC-31和CD44v6在良恶性腹水细胞中的表达情况,以探讨 MOC-31和CD44v6在良恶性腹水鉴别诊断中的临床价值。
材料和方法
1.研究对象
收集中国医科大学附属第一医院2011年6月至2012年1月门诊及病房患者腹水标本1680例,应用液基细胞学薄层涂片技术初检,从诊断结果为查到瘤细胞标本中选取390例,另选取良性腹水标本100例,其中男性患者269例,女性患者221例,年龄小于等于50岁者200例,大于50岁者290例,全部病例经临床、CT、磁共振及组织病理学确诊。
2.试剂
MOC-31、CD44v6鼠抗人单克隆抗体和辣根过氧化物酶标记的羊抗鼠二抗均购自北京中杉生物技术有限公司,人 MOC-31、CD44v6酶联免疫吸附测定试剂盒购自武汉博士德生物工程有限公司。
3.实验方法
3.1 液基细胞薄层检测技术(HOLOGIC TCT):取50ml腹水2管2000r/min离心5min后,弃掉上清液,加入50ml新柏氏细胞清洗液继续2000 r/min离心5min后,吸取适量沉淀物加入新柏氏细胞保存瓶,静置10min左右,用新柏氏液基细胞仪制成薄层细胞涂片,95%的酒精固定10min,常规HE染色。
3.2 MOC-31、CD44v6含量测定:采用 ELISA法测定,MOC-31、CD44v6酶联免疫吸附测定试剂盒由武汉博士德生物工程有限公司生产,操作步骤严格按照说明书进行,采用美国宝特公司Elx800全自动酶标仪(波长450nm)比色定量。对 MOC-31、CD44v6含量在标准曲线最高值以外的标本稀释10倍后重新测定。所有标本均作双管检查。
3.3 细胞包埋切片技术:取50ml腹水2管2000r/min离心5min后,弃掉上清液,加入95%乙醇固定8h。倒掉上清液后加入二甲苯透明0.5-1h,向透明后的细胞团块中加入液体石蜡浸透,一般需经三次,每次0.5-1h,将浸透石蜡的细胞团块放入新包埋器中并倒入熔化的新蜡,待石蜡凝固后,进行4μm厚连续切片。
3.4 免疫细胞化学技术:常规石蜡包埋切片后,采用链霉素抗生物素蛋白-过氧化物酶法(streptavidin-peroxidase,S-P)进行免疫细胞化学染色。切片常规烤片,脱蜡,水化,0.01mol/L柠檬酸盐缓冲液高温高压抗原修复3min;内源性过氧化物酶阻断液37℃孵育30min;非免疫性羊血清37℃孵育40min;一抗4℃孵育过夜,MOC-31、CD44v6稀释比例为1∶100;辣根过氧化物酶标记的羊抗鼠二抗37℃孵育30min;链霉素亲和素过氧化物酶溶液37℃孵育30min;新配置的DAB溶液显色;苏木素复染,中性树胶封片。各步之间用p H值为7.4左右的PBS冲洗三次,每次5min。用PBS代替一抗作阴性对照。
免疫细胞化学结果判定标准:细胞质或细胞膜中出现棕黄色颗粒的细胞为阳性细胞,每张切片在光镜下随机选取5个视野,每个视野计数100个瘤细胞,着色强度分为:无色为0分,浅黄色或黄色为1分,棕黄色为2分。阳性细胞数分为:<10%为0分,10%-50%为1分,>50%为2分,两项得分相乘结果>2记为阳性(+),<2为阴性(-)。
4.统计学方法
应用SPSS13.0统计学软件进行数据处理,计量资料数据以±s表示,两组间比较用t检验,多组间比较用单因素方差分析,计数资料用χ2检验(不满足条件时用Fisher确切概率法),两者相关性用非参数spearman等级相关分析,P<0.05为差异有统计学意义。
结 果
1.HOLOGIC TCT结果
镜下显示细胞散在分布,核异型性明显,核质细腻,N/C比例失调,核膜清晰,核大小不等,HOLOGIC TCT初步诊断为可疑瘤细胞;而在良性腹水中则以炎性细胞为主(如图AB所示)。
2.免疫细胞化学染色结果
我们通过液基薄层细胞涂片(HOLOGIC TCT)筛查出查到瘤细胞的恶性腹水标本,对恶性腹水标本和良性腹水标本做石蜡细胞包埋切片,并进一步做免疫组化(如图1所示)。

图1 图A恶性腹水中脱落细胞液基薄层涂片(HOLOGIC TCT)×400;图B良性腹水中脱落细胞液基薄层涂片(HOLOGIC TCT)×400;图C MOC-31在细胞膜上阳性表达(S-P)×400;图D CD44v6在细胞膜上阳性表达(S-P)×400;Fig.1 A Exfoliated cells of malignant ascites(HOLOGIC TCT)×400;B Exfoliated cells of benign ascites(HOLOGIC TCT)×400;C MOC-31 positive expression in the cell membrane(S-P)×400;D CD44v6 positive expression in the cell membrane(S-P)×400;
3.MOC-31在良、恶性腹水标本内的浓度分别为21±4 ng/ml、98.1±19.3 ng/ml,差异具有统计学意义(P<0.05);CD44v6在良、恶性腹水标本内的浓度分别为291±32 ng/ml、891±116 ng/ml,差异具有统计学意义(P<0.05)(如表1)。MOC-31在良、恶性腹水标本内的表达率分别为3.00%和75.90%,差异具有统计学意义(P<0.05);CD44v6在良、恶性腹水标本内的表达率分别为0%和71.28%,差异具有统计学意义(P<0.05)(如表2)。
表1 良、恶性腹水中MOC31和CD44v6的检测结果(±s)Table 1 The test results of MOC-31 and CD44v6 in benign and malignant ascites
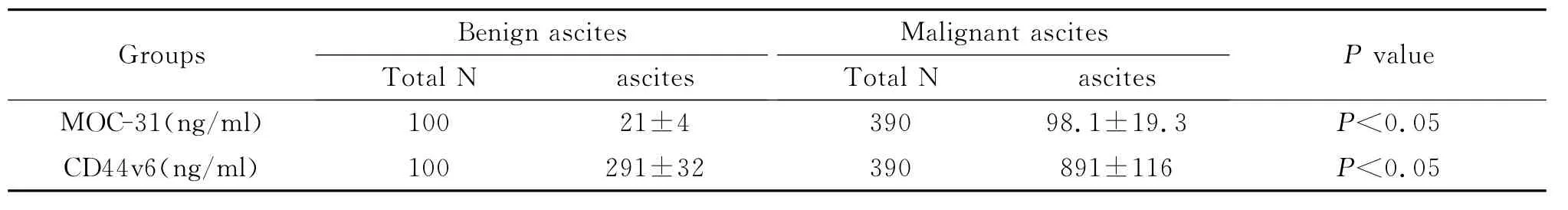
表1 良、恶性腹水中MOC31和CD44v6的检测结果(±s)Table 1 The test results of MOC-31 and CD44v6 in benign and malignant ascites
Groups Benign ascites Total N ascites Malignant ascites Total N ascites P value MOC-31(ng/ml) 100 21±4 390 98.1±19.3 P<0.05 CD44v6(ng/ml) 100 291±32 390 891±116 P<0.05

表2 100例良性腹水与390例恶性腹水中免疫细胞化学指标的表达Table 2 The expression of imunocytochemistry in 100 cases benign ascites and 390 cases malignant ascites
4.MOC-31和CD44v6在390例恶性腹水细胞学标本中总的阳性率分别为64.10%(250/390)和68.21%(266/390)二者阳性表达率之间成正相关(R=0.155,P=0.002)(如表3)。

表3 390例恶性腹水中MOC-31与CD44v6表达之间的关系Table 3 The relationship between MOC-31 and CD44v6 expressions in 390 cases of malignant ascites
5.390例恶性腹水标本经过临床及组织病理学确诊为肝癌62例,胃癌117例,结肠癌105例,卵巢癌55例,胰腺癌27例,胆管癌24例。MOC-31在结肠癌所致恶性腹水中阳性表达率相对较高,CD44v6在胃癌所致恶性腹水中阳性表达率相对较高(如表4)。
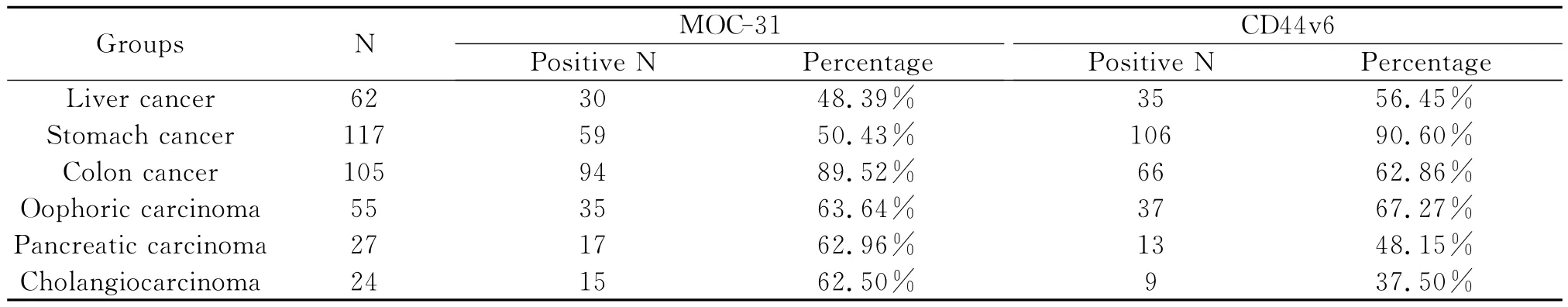
表4 MOC-31和CD44v6在恶性腹水中的检测结果Table 4 Results of MOC-31 and CD44v6 detection in malignant ascites
讨 论
腹水是临床上常见的症状,可由腹盆腔恶性肿瘤、肝硬化、结核性腹膜炎等多种疾病引起。不同病因引起的腹水其治疗和预后截然不同,因此,腹水病因的鉴别尤其是良、恶性腹水的鉴别极为重要。细胞学检查仍为恶性腹水确诊的金标准,但其敏感度仅为50%左右[2],即使有些患者腹水细胞学检查阴性也不能排除肿瘤诊断。肿瘤标志物是由肿瘤细胞合成、分泌或脱落到体液或组织中的生物活性物质,在肿瘤发生发展早期影像学检查尚未有阳性表现时,体液中肿瘤标志物已有不同程度升高,通过测定其含量和表达情况对肿瘤有辅助诊断价值[3]。因此,检测肿瘤标志物是早期发现肿瘤的一个重要手段。在众多的肿瘤相关标志物中,MOC-31和CD44v6被认为是特异性和敏感性均较高的指标[4,5],对诊断与鉴别诊断恶性腹水有较高的应用价值。
MOC-31又称做人类全癌上皮相关糖蛋白-2(human pancarcinoma associated epithelial glycoprotein-2,EGP-2)[6],是上皮分化的可靠标记物。理论上讲,只有上皮来源的细胞才能表达MOC-31,非上皮来源的细胞不表达,因此检测 MOC-31表达与否有助于确定腹腔积液内细胞的来源,良性腹水内只存在炎症细胞和间皮细胞,没有上皮来源细胞,如果出现MOC-31表达阳性的细胞多意味着上皮性肿瘤细胞转移所致。Delahaye等[7]用浆膜腔积液细胞涂片作MOC-31免疫细胞化学染色,显示有76%的恶性浆膜腔积液呈阳性,而在增生间皮细胞中均呈阴性。免疫细胞化学实验显示有64.10%(250/390)的恶性腹水肿瘤细胞表达 MOC-31,仅有5例良性腹水增生间皮细胞表达且表现为弱阳性;ELISA结果也进一步证实了MOC-31在良恶性腹水中的浓度具有显著性差异。
CD44是广泛存在于细胞表面的异质型跨膜糖蛋白粘附分子,CD44v6是CD44的一种拼接异构体,主要介导肿瘤细胞与宿主细胞和细胞外间质之间特异性的粘连过程。CD44v6改变了肿瘤细胞表面黏附分子的构成和功能,使肿瘤细胞侵袭与转移能力增强。研究发现,人类多种恶性肿瘤组织[8-10],如胃癌、结肠癌、肝癌、乳腺癌、肺癌、卵巢癌、鼻咽癌等普遍存在CD44v6的过量表达,而且CD44v6的高表达与肿瘤进展、转移及预后密切相关。目前,一般认为CD44v6表达失控与基因突变有关。CD44v6可通过蛋白水解酶的作用从细胞膜上脱落下来到血或体液中,从而为利用体液及外周血检测CD44v6奠定了基础。我们的实验结果显示,有68.21%(266/390)的恶性腹水肿瘤细胞表达CD44v6,而在良性腹水中低表达。在良、恶性腹水标本内的浓度分别为291±32 ng/ml、891±116 ng/ml,差异具有统计学意义(P<0.05)。
本研究中还观察到表达MOC-31阳性的恶性腹水肿瘤细胞常常伴随CD44v6的阳性表达,且两者之间的表达呈正相关(R=0.155,见表3),提示MOC-31和CD44v6在肿瘤转移中起到重要作用,可能存在共同的作用机制。390例恶性腹水最终经过临床以及组织病理学确诊,MOC-31在结肠癌引起的恶性腹水中阳性表达率较高89.52%,CD44v6在胃癌引起的恶性腹水中阳性表达率较高90.60%(见表4),与国外文献报道趋于一致[11,12]。本研究认为,ELISA和免疫细胞化学染色联合检测MOC-31和CD44v6在腹水中的含量和表达情况有助于良、恶性腹水的鉴别诊断,并有可能作为结肠癌和胃癌诊断的一个较为可靠参考指标,而且为恶性顽固型腹水的基因治疗提供有效靶点,值得在临床良、恶性腹水鉴别诊断中推广应用。
[1]陈江帆,杜明伟,姜海娇等.免疫细胞化学方法对胸腔积液中恶性肿瘤细胞的分类与诊断.中国组织化学与细胞化学杂志,2013;22(1):49-53
[2]李香菊.免疫细胞化学在辅助浆膜腔积液细胞病理学诊断中的应用.诊断病理学杂志,2003,10(1):45-48
[3]邬万新,唐正英,张燕萍等.免疫细胞化学鉴别良恶性体腔积液的抗体选择和组合.实用肿瘤学杂志,2006,20(5):365-368
[4]Morgan RL,De Young BR,McGaughy VR,et al.MOC-31 aids in the differentiation between adenocarcinoma and reactive mesothelial cells.Cancer,1999,87(6):390-394
[5]Yanaguch A,Goi T,Yu J,et al.Expression of CD44v6 in advanced gastric cancer and its relationship to hematogenous metastasis and long-term prognosis.J Surg Oncol,2002,79(4):230-235
[6]Markus Heine,Barbara Freund,et al.High interstitial fluid pressure is associated with low tumour penetration of diagnostic monoclonal antibodies applied for molecular imaging purposes.PLoS ONE,2012,7(5):1-11
[7]Delahaye M ,vander Ham F,vander K wast TH.Complementary value of five carcinoma markers for the diagnosis of malignant mesothelioma,adenocarcinoma metastasis,and reactive mesothelium in serous effusions.Diagn Cytopathol,1997,17(2):115-120
[8]Chen D,Zhang Y,Wang J,et al.MicroRNA-200c overexpression inhibits tumorigenicity and metastasis of CD117+CD44+ovarian cancer stem cells by regulating epithelial-mesenchymal transition.J Ovarian Res,2013,6(1):50-58
[9]Yamaguchi A,Coi T,Yu J,et al.Expression of CD44v6 in advanced gastric cancer and itsrelationship to hematogenous metastasis and long-term prognosis.J Surg Oncol,2002,79:230-235
[10]Doventas A,Bilici A,Demirell F,et al.Prognostic significance of CD44 and c-erb-B2 protein overexpression in patients with gastric cancer.Hepatogastroenterology,2012,59(119):2196-2201
[11]Yamamichi K,Uehara Y,Kitamura N,et al.Increased expression of CD44v6 mRNA significantly correlates with distant metastasis and poor prognosis in gastric cancer.Int J Cancer,1998,79(2):256-262
[12]Koutselini HA,Lazaris AC,et al.Papillary serous carcinoma of peritoneum:case study and review of the literature on the differential diagnosis of malignant peritoneal tumors.Adv Clin Path,200l,5(3):99-104

