非小细胞肺癌Survivin和Skp2的表达及其临床意义
井昶雯, 曹海霞, 马 蓉, 王 卓, 吴建中
肺癌是一种严重危害人类健康的恶性疾病,发病率居恶性肿瘤的前列,并由于环境污染、吸烟等问题,发病率不断上升,5年生存率不足20%[1-2]。非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌最常见的类型。肿瘤的发生发展为多种因素共同作用的复杂生物学过程, 与癌基因及抑癌基因的异常密切相关。Survivin,也被称为含杆状病毒IAP重复序列分子5,是凋亡抑制家族成员之一。研究表明,Survivin能抑制细胞凋亡、增强其增殖能力和促进新生血管形成[3-4]。Survivin在多种人类肿瘤中高表达[5]。S期激酶相关蛋白2(S-phase kinase associated protein 2,Skp2)属于泛素化-蛋白酶体系统。Skp2通过对多种靶蛋白的泛素化降解而与细胞周期调控及肿瘤的发生、发展和预后密切相关。Skp2调控的靶点包括周期素D1,E,P130,E2F1和周期素依赖性激酶抑制物p27,p21,p57[6]。本研究利用实时定量PCR技术和免疫组化技术检测非小细胞肺癌组织中Skp2和survivin mRNA和蛋白的表达情况以探讨其临床意义。
1 对象与方法
1.1 标本来源及一般资料
收集我院2011年1月至2011年12月期间临床病理资料完整的手术切除非小细胞肺癌标本共50例(均经病理学确诊),其中30例有对应的癌旁组织(距癌组织5 cm以外的肺组织)。其中,男29例,女21例;年龄43~79岁,中位年龄60岁。根据1997年国际抗癌联盟(UICC)分期标准进行TNM分期,Ⅰ~Ⅱ期22例, Ⅲ~Ⅳ期28例。中、高分化23例,低分化27例;鳞癌25例、腺癌25例。有淋巴结转移24例,无淋巴结转移26例。标本均在手术时采集,标本采集后迅速置液氮内保存,然后转至-80 ℃冰箱冻存备用。
1.2 试剂及引物
Trizol(Invitrogen公司),反转录试剂盒、Taq酶、2×SYBR Green PCR Master Mix(Takara公司),人抗Skp2抗体和Survivin抗体(北京中杉)。从基因库中检索survivin及β-actin的基因序列,根据Primer 5.0设计实时定量PCR引物序列,经BLAST分析,确定其特异性。所有引物均由Takara公司合成。Survivin基因:上游引物 TGCGGGAATCCAAAGGATAATTCA;下游引物 CTTCATCTTTGTCATACTTCATGGCT。β-actin基因:上游引物 GATGAGATTGGCATGGCTTT;下游引物 CACCTTCACCGTTCCAGTTT。
1.3 检测方法
1.3.1 免疫组化及结果判断标准 采用Envision法,先用poly-L-lysine处理载玻片,做石蜡切片厚4 μm,60 ℃烘干处理1 h,常规脱蜡、水化组织切片;pH=6.0的柠檬酸修复液修复Survivin抗原,胰蛋白酶消化、修复处理Skp2抗原;用蒸馏水冲洗切片1次,再用PBS冲洗2次;为抑制内源性过氧化物酶,用3%H2O2处理切片10 min,再用PBS冲洗3次;滴加一抗,4 ℃反应过夜;PBS冲洗3次,滴加EnvisionTM反应30 min,PBS冲洗切片3次;DAB显色3~5 min;苏木精对比复染,中性树脂封固。
结果判断标准:根据以细胞的胞质或胞核内出现明显的棕黄色或黄褐色颗粒染色强度和染色细胞百分数分别计分,积分之和来判断。按染色强度记为0~3分,不着色为0分,着色轻度为1分,中度为2分,着色较强为3分。按染色细胞百分数记为0~4分,无细胞着色为0分,<25%细胞为l分,25%~50%细胞为2分,50%~75%细胞为3分,>75%的细胞着色为4分。阴性表达为染色指数0~2分,阳性表达为3~7分。
1.3.2 实时定量PCR 采用Trizol法从组织中提取总RNA,逆转录1 μg总RNA得到cDNA,以cDNA为模板用ABI 7300进行实时定量PCR扩增出目的片段Survivin和β-actin。整个反应体系20 μL。反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火31 s,40个循环。
1.4 统计学方法 用SPSS11.0统计分析软件,采用χ2检验进行统计分析,相关性检验的统计学方法为Log-rank检验,以双侧检验水准P<0.05为差异有统计学意义。
2 结果
2.1 非小细胞肺癌和癌旁组织中survivin mRNA表达情况
在30组NSCLC肿瘤组织和对应的癌旁组织中,23组肿瘤组织中survivin mRNA表达量明显高于癌旁组织(P<0.01)。
2.2 非小细胞肺癌组织中Survivin和Skp2的表达
在50例NSCLC癌组织中Survivin阳性例数为37例,阳性率为74.0%,Skp2的阳性例数为35例,阳性率为70.0%。在30例癌旁组织中,Survivin和Skp2的阳性表达率分别为16.7%(5/30)和20.0%(6/30)。Survivin在NSCLC癌组织的阳性表达率显著高于癌旁组织(χ2=25.9,P<0.001)。而NSCLC癌组织中Skp2阳性表达率也显著高于其在癌旁组织的表达(χ2=18.8,P<0.001),见表1。

表1 NSCLC中Survivin和Skp2的表达情况
2.3 Survivin表达与非小细胞肺癌临床病理特征的关系
我们对50例NSCLC中Survivin表达和病理类型的关系进行了统计分析。在此研究中,Survivin的表达与病理类型(χ2=0.94,P>0.05)、分化程度高低(χ2=0.4,P>0.05)、肿瘤分期(χ2=0.03,P>0.05)及是否伴随淋巴结转移(χ2=0.02,P>0.05)无相关性。详见表2。
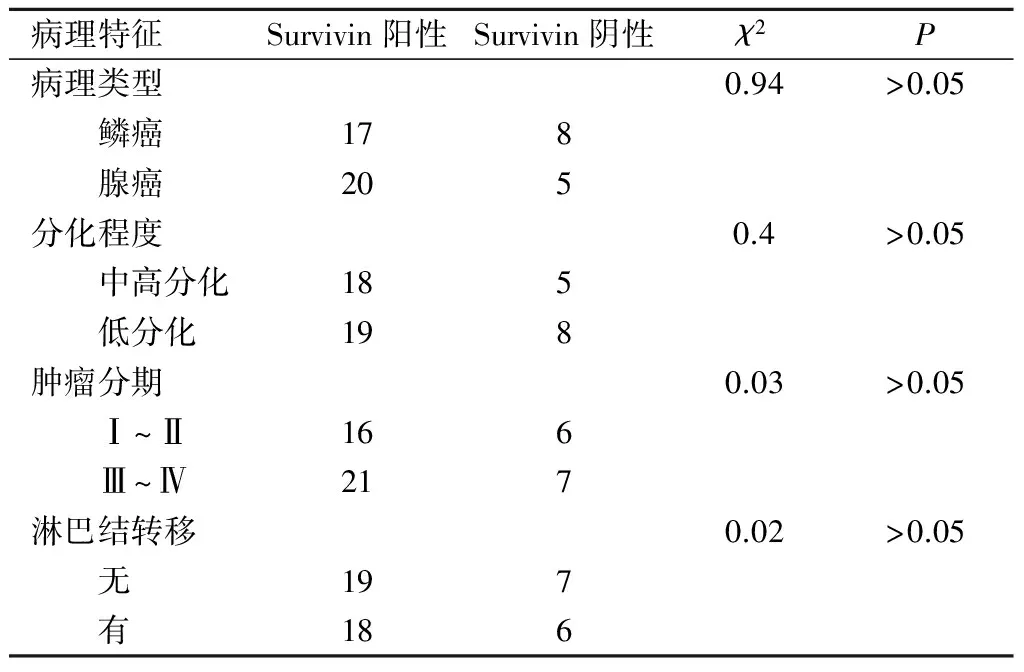
表2 Survivin表达与NSCLC病理特征的关系
2.4 NSCLC癌组织中Survivin和Skp2表达的关系
35例Skp2表达阳性的NSCLC癌组织中,Survivin也阳性的有30例(85.7%,30/35)。而Skp2表达为阴性的癌组织中,Survivin的阳性率为46.7%(7/15)。两者比较差异有统计学意义。表明在NSCLC中Survivin表达与Skp2表达有相关性。见表3。

表3 NSCLC癌组织中Survivin和Skp2表达的关系
3 讨论
Survivin这个凋亡抑制蛋白首次由耶鲁大学利用效应细胞蛋白酶受体cDNA 筛选人基因组文库获得。作为最小的凋亡蛋白抑制因子,在抑制细胞凋亡的过程中充当着重要的角色[7]。Survivin在宫颈癌、子宫内膜癌、肺癌、肾癌等多种恶性肿瘤中高表达,而在一般组织中无表达[8]。本研究结果也证实NSCLC癌组织中的survivin mRNA表达量明显高于癌旁组织;Survivin阳性表达率(74.0%)也明显高于癌旁组织的阳性表达率。
Survivin 的表达水平、定位和NSCLC的组织类型、细胞分化凋亡程度、TNM分期、侵袭转移,以及患者存活时间、预后有关,但各研究结果存在不一致性。有研究发现Survivin是肺癌患者的独立预后因素,其表达水平与TNM分期及淋巴结转移有关[9]。但也有研究表明Survivin 表达与肿瘤分期相关,但不影响患者的生存率[10]。Survivin在女性乳腺癌组织、乳腺增生组织的阳性表达率分别为76.3%、25.0%,而在纤维瘤旁正常乳腺组织中不表达,且Survivin 阳性表达率与乳腺癌TNM分期有关,与病理类型无关[11]。还有学者发现细胞内不同定位的Survivin与预后的关系不同,细胞核内表达Survivin的肺癌患者中位生存期短,是肺癌患者的独立预后因素,而胞浆中的Survivin与预后无关[12]。本实验中survivin mRNA在NSCLC组织中的表达与肿瘤病理类型、细胞分化程度、TNM分期、淋巴结转移无统计学意义的相关性,原因可能是检测方法、样本例数不同。
Skp2基因定位于人5号染色体短臂上,分子质量约45 KD。Skp2属于泛素化-蛋白酶体系统,Skp2作为泛素连接酶E3中的组成部分——F盒蛋白,识别并结合多种周期素蛋白和周期素依赖性激酶抑制物对细胞周期进行调控。Skp2在多种肿瘤中表达明显升高,包括消化道肿瘤、乳腺癌、肺癌等。有研究发现Skp2在肺癌组织中表达明显升高,特异性小干扰RNA片段下调Skp2表达可诱导肺癌细胞凋亡,明显抑制细胞增殖[13]。另有研究通过RT-PCR及免疫组化法检测了79例非小细胞肺癌的Skp2的表达,发现Skp2的表达与肿瘤大小、淋巴结转移、临床分期、脉管内癌栓、组织学分级及生存率相关[14]。本研究显示在50例非小细胞肺癌组织中,Skp2的阳性例数为35例,阳性率为70.0%,明显高于癌旁组织的阳性率20.0%。
此外,本研究发现在Skp2表达阳性的非小细胞肺癌组织中Survivin阳性表达率亦明显升高,两者呈正相关。说明两者可能在非小细胞肺癌发生发展中发挥着一定的协同作用。
总之,我们的研究显示在非小细胞肺癌中Survivin存在过度表达现象,提示其在NSCLC的发生发展过程中起着重要作用;Survivin的表达与Skp2表达密切相关,但要深入探讨二者的关系还需要进一步的研究。
[1] Jemal A,Siegel R,Xu J, et al.Cancer statistics,2010[J].CA Cancer J Clin,2010,60(5):277-300.
[2] Molina JR,Yang P,Cassivi SD,et al.Non-small cell lung cancer: epidemiology, risk factors, treatment, and survivorship[J].Mayo Clin Proc,2008,83(5):584-594.
[3] Samuel T,Okada K,Hyer M,et al.cIAP1 Localizes to the nuclear compartment and modulates the cell cycle[J].Cancer Res,2005,65(1):210-218.
[4] Tran J,Master Z,Yu JL,et al.A role for Survivin in chemoresistance of endothelial cells mediated by VEGF[J].Proc Natl Acad Sci USA ,2002,99(7):4349-4354.
[5] Sah NK,Khan Z,Khan GJ,et al.Structural,functional and therapeutic biology of Survivin[J]. Cancer Lett,2006,244(2):164-171.
[6] Skowyra D,Craig KL,Tyers M,et al.F-box proteins are receptors that recruit phosphorylated substrates to the SCF ubiquitin-ligase complex[J].Cell ,1997,91(2):209-219.
[7] Altieri DC.Survivin,cancer networks and pathway-directed drug discovery[J].Nat Rev Cancer,2008,8(1):61-70.
[8] Kelly RJ,Lopez-Chavez A,Citrin D,et al.Impacting tumor cell-fate by targeting the inhibitor of apoptosis protein Survivin[J].Mol Cancer,2011,10:35.
[9] Akyurek N,Memis L,Ekinci O,et al.Survivin expression in pre-invasive lesions and non-small cell lung carcinoma[J].Virchows Arch,2006,449(2):164-170.
[10] Falleni M,Pellegrini C,Marchetti A,et al.Survivin gene expression in early-stage non-small cell lung cancer[J].J Pathol,2003,200(5):620-626.
[11] 王昌亮,郑春辉,王在国.Survivin 在乳腺癌中的表达及意义[J].中国肿瘤外科杂志,2012,4(1): 56-57.
[12] Bria E,Visca P,Novelli F,et al.Nuclear and cytoplasmic cellular distribution of Survivin as survival predictor in resected non-small-cell lung cancer[J].Eur J Surg Oncol,2008,34(5) : 593-598.
[13] Yokoi S,Yasui K,Iizasa T,et al.Down-regulation of SKP2 induces apoptosis in lung-cancer cells[J].Cancer Sci,2003,94(4):344-349.
[14] Takanami I.The prognostic value of overexpression of Skp2 mRNA in non-small cell lung cancer[J].Oncol Rep,2005,13 (4):727-731.

