低强度脉冲超声波联合引导骨再生术对Beagle犬牙周骨开窗缺损修复效应的研究
高 翔 宋锦璘* 邓 锋 赵纯亮 王智彪
1(重庆医科大学附属口腔医院,重庆市口腔疾病与生物医学研究中心,重庆 401147)2(超声医学工程重庆市市级重点实验室,重庆 400016)
引言
先天畸形、外伤或牙周病等因素,常导致牙槽骨发生不同程度缺损,造成牙齿支持组织破坏,牙周附着丧失,最终导致牙丧失[1]。目前,治疗牙槽骨缺损的主要方法有植骨术、引导组织再生术(guided tissue regeneration,GTR)以及引导骨组织再生术(guided bone regeneration,GBR)等[2]。其中GBR作为一种基于GTR理论发展而来的再生性手术,将GTR术与骨移植治疗联合应用,可以获得牙槽骨再生[3]。GBR术后,牙槽骨完全修复上颌区约需6个月,下颌区约需3个月[4]。术后由于口腔卫生差、吸烟、牙龈厚度不足等原因,常导致屏障膜早期暴露而影响疗效[5-6],亟待促进牙槽骨修复、缩短修复时间的辅助疗法。
低强度脉冲超声波(lowintensitypulsed ultrasound,LIPUS)为强度低于100 mW/cm2的脉冲式超声波,具有产热相对较弱,无侵入性,具有促进牙周组织修复的潜力[7-13]。以往研究侧重LIPUS单独处理对牙周组织的影响[8-10],尚未见 GBR与LIPUS联合应用对牙周骨开窗缺损生物学改建效应的相关报道。
本研究应用GBR辅以LIPUS处理Beagle犬尖牙牙周骨开窗缺损模型,通过Micro-CT检测及组织学分析,探讨LIPUS对GBR修复牙周骨缺损的影响,以期为LIPUS辅助治疗提高临床GBR疗效提供前期实验参考。
1 材料和方法
1.1 实验对象和材料
1.1.1 实验对象
12~18个月龄健康雄性beagle犬5只(重庆医科大学动物实验中心提供),体重7~11 kg。尖牙无龋坏,牙周情况良好,牙龈无红肿出血,牙槽骨无缺损。选择尖牙为实验牙,每只Beagle犬4颗尖牙按简单随机法分配到4个治疗组:LIPUS(90 mW/cm2,20 min/d)组、LIPUS(90 mW/cm2,20 min/d)+GBR组、GBR组、空白对照组。每组5颗实验牙。
1.1.2 实验药品
速眠新Ⅱ注射液(批号:005013,规格:1.5 mL/支,军事医学科学院军事兽医研究所)、地西泮注射液(批号:H50021483,规格:2mL:10 mg/支,西南药业股份有限公司)、康派特医用胶(北京瞬康医用胶有限公司)、医用超声耦合剂、2%盐酸利多卡因、盐酸肾上腺素注射液等。
1.1.3 实验材料和仪器
聚四氟乙烯(polyetrafluoroethylene,PTFE)膜(FP301100,厚度:0.01 mm,Goodfellow Cambridge Ltd,英国)、低强度脉冲超声实验仪(国家超声医疗工程中心提供)、切片机(Leica RM2135型转轮,德国Leica公司)、Nikon DXM1200和NIS-Elements F3.0计算机图像分析系统(日本Nikon公司)、Micro-CT(μCT80瑞士)、HPIntegrity工作站(Itanium®2处理器,64位OpenVMS操作系统)等。
1.2 方法
1.2.1 构建Beagle犬尖牙牙周骨缺损模型
速眠新Ⅱ注射液复合地西泮注射液对Beagle犬实施全身麻醉。麻醉后将Beagle犬固定,消毒铺巾,口内2%碘酊消毒,75%酒精脱碘,严格无菌操作。含肾上腺素2%利多卡因注射液浸润麻醉。实验区颊侧牙龈做三角形切口,翻开全厚粘骨膜瓣,高速裂钻配合骨凿制备大小5 mm×5 mm矩形牙槽骨缺损,完全暴露尖牙根面,刮除残留牙周膜组织,平整根面,SSW HP-700裂钻沿缺损边缘在根面上做连续切迹以便组织学观测,同时在尖牙牙冠做“L”形标记,指示缺损位置,冠部“—”形切迹距离矩形缺损冠向边缘约15 mm(见图1中(a)~(c))。
1.2.2 GBR手术
选择下颌第一磨牙根分叉区牙槽骨作为供骨区,取适量牙槽骨,剪碎后放入生理盐水中备用。将备用骨质植入GBR和LIPUS+GBR治疗组缺损区,用量大致平齐缺损周围骨缘。高温消毒后的PTFE膜修整后(面积比缺损周缘大2~3 mm)用康派特医用胶粘结固定于牙槽骨面,覆盖植骨区[13]。生理盐水冲洗后,龈瓣复位,4-0丝线缝合关闭创面(图1中(d)~(f))。LIPUS组和空白对照组省略此步骤。术后连续4 d给予肌肉注射青霉素(80万单位/d)预防感染,术后 1周内进软食,每日用1.5%洗必泰局部冲洗,1周后拆线。
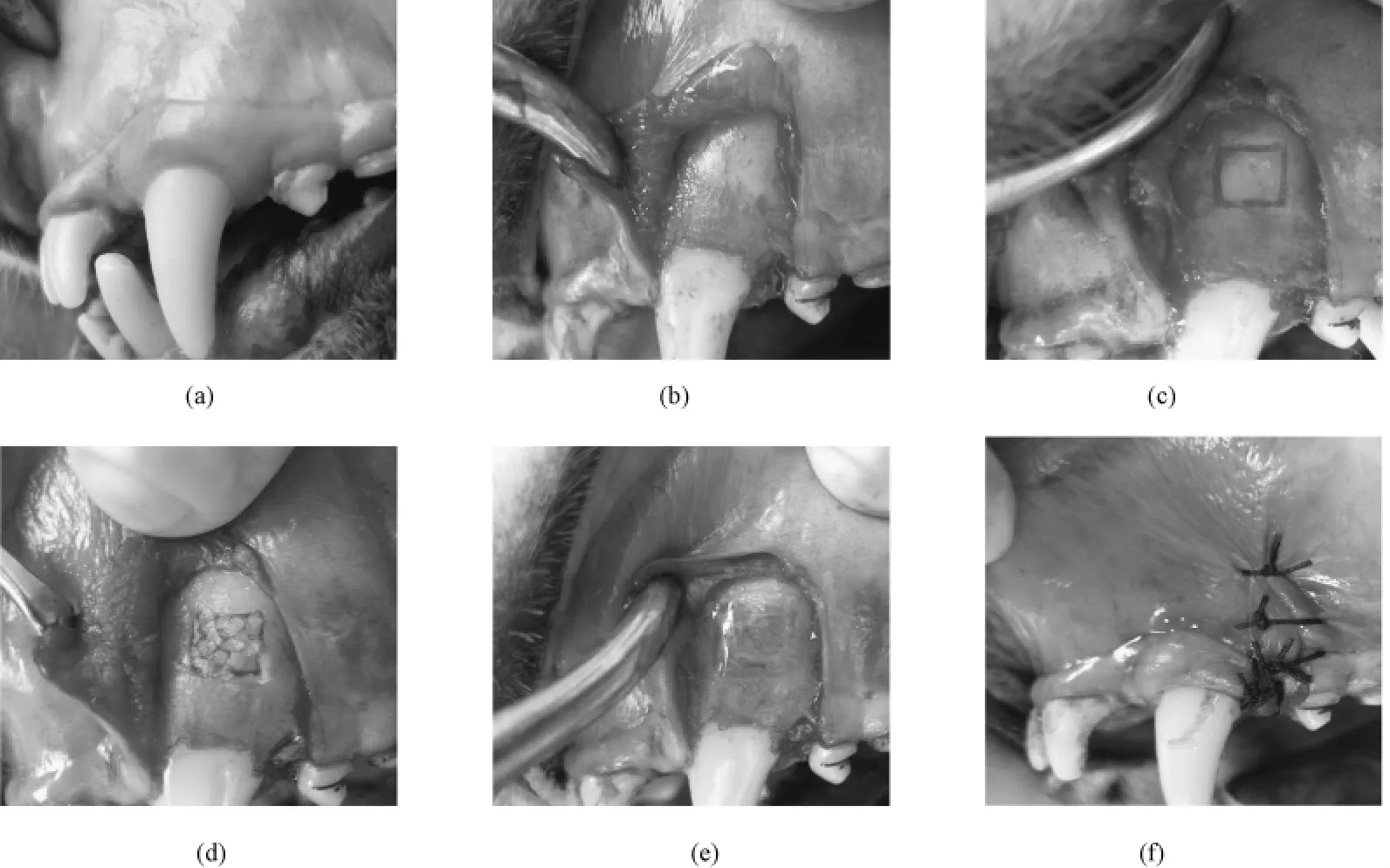
图1 牙周手术过程。(a)~(c)骨开窗建模;(d)~(f)GBR手术Fig.1 The process of periodontal surgery.(a)~(c)Fenestration wounds modeling;(d)~(f)GBR operation
1.2.3 LIPUS参数设定及处理方法
基于安全无创性原则,LIPUS治疗参数为ISATA 90 mW/cm2,频率1.5 MHz,调制信号波宽200 μs,重复率1 kHz,处理时间20 min/d[12,14]。连续4周(28 d)每天辐照1次。参考标记线位置放置超声治疗仪探头(见图2)。
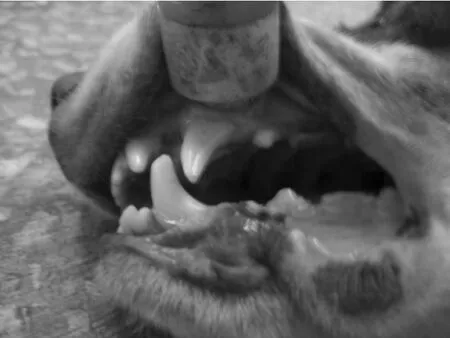
图2 LIPUS处理Fig.2 LIPUS treatment
1.2.4 Micro-CT图像三维重建
4周后,过量麻药处死Beagle犬,用金属片切片将上下颌尖牙完整取出,4%多聚甲醛液(pH=7)固定1周。Micro-CT运行参数为电压55 kV,电流145 μA,图像矩阵2 048像素×2 048像素,层距0.037 0 mm。将标本固定放置于扫描容器中,保证扫描平面与牙长轴垂直,扫描方向从尖牙冠部至根尖部。获取Micro-CT扫描图像(见图3)后,在HP Integrity 64位工作站中对图像进行重建分析。对实验区进行三维重建,对不同组织通过不同显色和透明度区别观察缺损区牙槽骨再生情况。1.2.5 制备组织切片
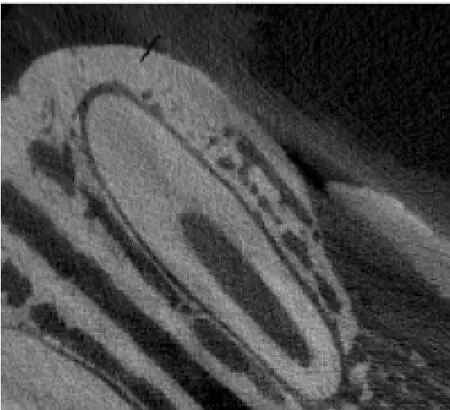
图3 尖牙扫描后重建图像Fig.3 The reconstruction image of canine after scanning
Micro-CT检测后,在生理盐水冲洗下用金属片切片将实验区牙根及牙周组织(不包括牙龈)完整取下(边界大小10 mm×10 mm)并修整。10%EDTA 37℃恒温水浴脱钙2个月后,常规梯度脱水,浸蜡,石蜡包埋,沿牙根长轴做颊舌向连续切片,切片厚度5 μm。每个组织块选取中间段5张切片用于HE染色和Masson染色(4张HE染色,1张Masson染色)。计算机图像分析系统显微镜下采集组织切片图像。
1.2.6 组织学定量分析
用计算机图像分析系统(Nikon DXM1200和NIS-Elements F3.0)采集40倍下切片图像,并用IPP-6.0图像分析软件进行测量分析[7],骨“开窗”缺损新生牙周组织生长模式如图4所示,测量切片缺损总面积、新生骨组织面积。

图4 骨“开窗”模型新生牙周组织生长模式图(N:根面切迹;NC:新生牙骨质;NP:新生牙周膜;NB:新生牙槽骨;BM:聚四氟乙烯膜;ST:软组织)Fig.4 The growth diagram of new periodontal tissue in fenestration defect(N:notch;NC:new cementum;NP:new periodontal ligament;NB:new bone;BM:PTFE membrane;ST:soft tissue)
(1)缺损初始面积(total defect area,TDA):根面缺损的总面积。
(2)新生骨组织面积(new bone area,NBA):缺损区新生骨组织的面积总和。
1.2.7 统计学处理
用SPSS13.0软件包进行统计学处理,数据用均数±标准差(¯x±s)表示,对相关资料进行随机区组设计的方差分析,组间比较进行LSD检验,以P<0.05认为差异有统计学意义。
2 结果
2.1 临床愈合情况
骨开窗模型临床愈合情况有以下3种:(1)失败:龈瓣缺损,PTFE膜移位或脱落;(2)暴露:龈瓣缺损,PTFE膜暴露但没有脱落;(3)完全愈合:牙龈愈合良好,PTFE膜未暴露。失败和暴露牙位不纳入测量分析。各实验组临床愈合情况见表1。
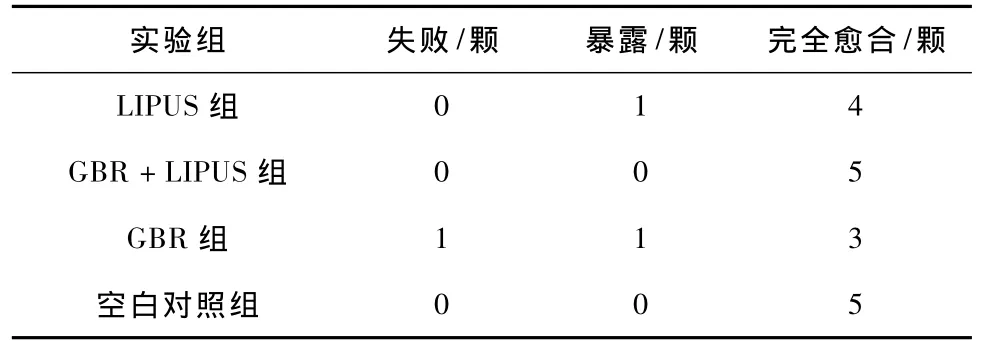
表1 各实验组临床愈合情况Tab.1 The clinical healing between groups
2.2 实验区大体观察
各组牙槽骨缺损面积均不同程度缩小,新生组织从缺损周围标记处向中心生长,缺损处无明显炎症反应。LIPUS+GBR和GBR组PTFE膜被结缔组织包裹,固定于原处,未发生明显移位(见图 5和图6)。
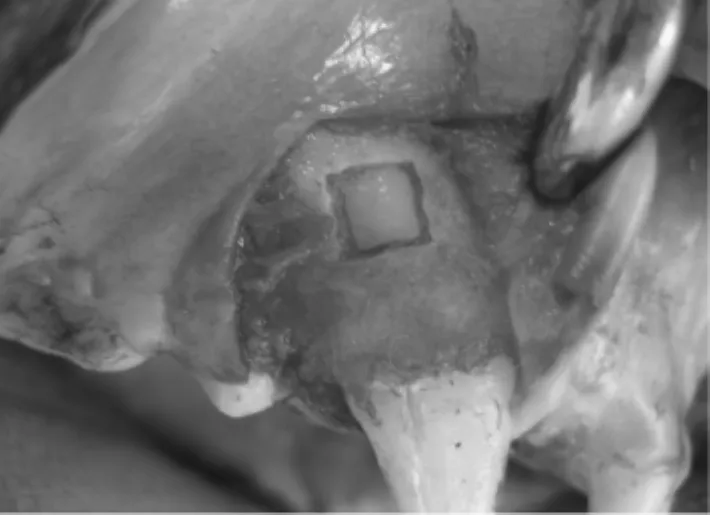
图5 术中缺损大小Fig.5 The size of defect in operation
2.3 Micro-CT三维重建图像分析
从重建的三维图像中观察发现,各治疗组牙槽骨均有一定程度的修复。未进行GBR术治疗组,实验牙内新生牙槽骨面积较进行GBR术治疗组小,且牙槽骨表面空隙较多,提示新生牙槽骨的密度较低;进行GBR术的治疗组,实验牙新生牙槽骨密度较高,提示牙槽骨再生量较高;空白对照组新生牙槽骨表面空隙较多,提示新生牙槽骨密度较低,新生牙槽骨面积在各治疗组中最小;LIPUS+GBR组新生牙槽骨表面空隙较少,新生牙槽骨面积最大,提示新生牙槽骨密度较高,牙槽骨再生量较高。
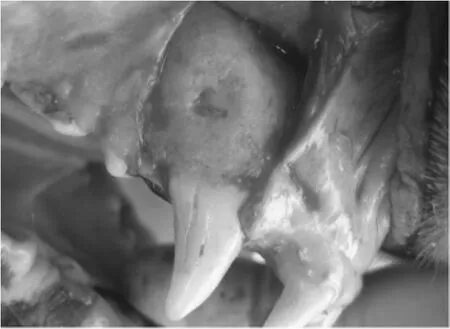
图6 治疗后缺损大小Fig.6 The size of defect after treatment
2.4 组织学观察
2.4.1 LIPUS组:光镜下可见丰富的成纤维细胞,
胶原纤维束及新生毛细血管;成牙骨质细胞、成骨细胞功能活跃(见图7和图8),Masson染色新生组织中成熟骨组织胶原分布较广。

图7 成牙骨质细胞及新生牙骨质(HE染色,200×)Fig.7 Cementoblast cells and new cementum(HE Staining,200×)
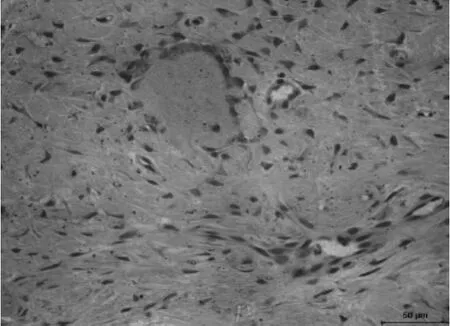
图8 成骨细胞及新生牙槽骨(HE染色,400×)Fig.8 Osteoblasts and new alveolar bone(HE staining,200×)(HE staining,400×)
2.4.2 LIPUS+GBR组:PTFE膜与牙周组织接触良好,未见胶原纤维束穿过,膜下胶原纤维束及新生毛细血管丰富;成纤维细胞、成骨细胞、成牙骨质细胞功能活跃;少量尚未吸收改建,大小不等移植骨颗粒分布缺损区,大量功能活跃的成骨细胞以植骨颗粒为支架编织合成新骨(见图9和图10);陈旧骨与新生骨之间有明显交界线,Masson染色与LIPUS组类似。
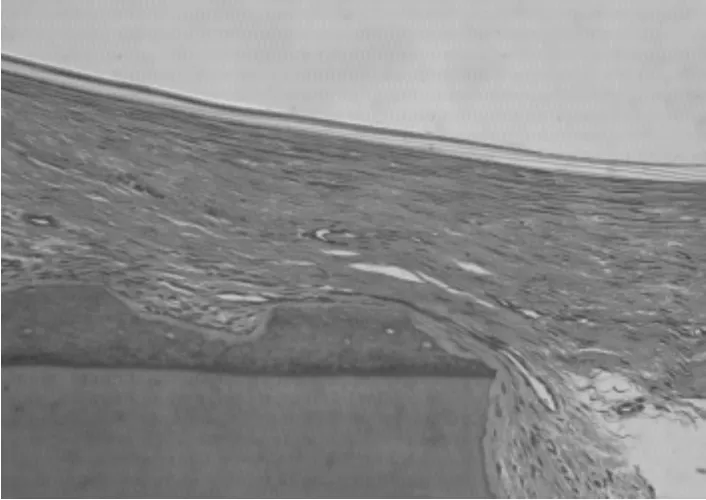
图9 PTFE膜与周围组织(HE染色,40×)Fig 9 PTFE membrane in vivo(HE staining,40×)
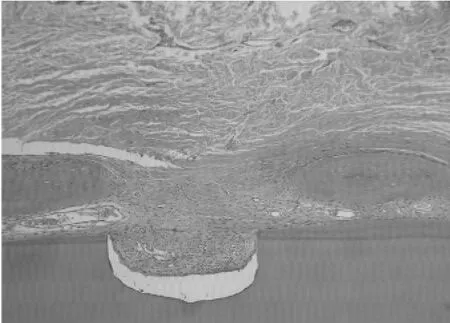
图10 超声处理+GBR组织学表现(HE染色,40×)Fig.10 Histological performance in LIPUS+GBR group(HE staining,40×)
2.4.3 GBR组:缺损处以成纤维细胞及新生毛细血管为主,胶原纤维束较少,成牙骨质细胞靠近根面形成牙骨质,少量植骨颗粒散在分布,Masson染色新生组织中成熟骨组织胶原分布相对较少。
2.4.4 空白对照组:缺损处可见少量新生骨组织,新生骨组织以软骨胶原纤维为主,Masson染色显示主要为非成熟的骨组织胶原成分(见图11)。
2.5 组织学定量检测
各治疗组TDA无显著性差异(P>0.05);各治疗组新生骨组织面积及新生骨占初始缺损面积百分比(NBA%),组间差异有统计学意义(P<0.05),见表2。
3 讨论

图11 空白对照组组织学表现。(a)HE染色,100×;(b)HE染色,200×;(c)染色Masson,100×Fig.11 Histological performance in control group.(a)HE staining,100×;(b)HE staining,200×;(c)Masson staining,100×

表2TDA,NBA及NBA%测量结果Tab.2 The measurements of TDA,NBA and NBA%
牙槽骨缺损修复的动物模型需满足两个要求:一是能够真实反应牙周组织修复的过程;二是利于准确评估处理因素对牙周组织的生物学效应[15]。本研究选择牙槽骨“开窗”模型为矩形“封闭”缺损,可有效排除外界感染因素的影响,有利于准确评估LIPUS在GBR治疗中的生物学效应。
由于具有与人类相似的牙周组织结构,犬常被用于牙周动物实验[16]。研究发现,犬下颌颊侧5 mm直径的环形牙槽骨开窗模型术后16周,通过自愈可获得完全牙槽骨再生[17]。急性牙周损伤建模后,动物组织的自愈性常导致对治疗方法效果的过高评介[18]。LIPUS处理时间过长,Beagle犬牙周组织的自愈性的影响可能会更大。Ikai等发现Beagle犬牙周翻瓣术后,连续4周LIPUS辐照后可以活化成骨细胞、牙周膜细胞,对牙周病组织愈合及牙槽骨修复有促进作用[11]。因此,本研究选择4周LIPUS处理时间,不仅可减少Beagle犬牙周自愈性对实验结果的干扰,而且有利于LIPUS与GBR联合应用对牙槽骨缺损早期修复效应的研究。
Micro-CT是一种高分辨率的三维重建影像技术,具有对组织无创、精确度高、直观性好等特点,主要应用于骨组织或口腔内牙体组织、牙槽骨组织的重建分析[19]。本实验利用HP Integrity工作站对Micro-CT扫描图像进行三维重建后,形态学观察显示,扫描后重建图像,牙体组织和牙槽骨组织图像清晰、真实、直观,牙根面的骨缺损标记线明显,为定量分析新生牙槽骨提供有力保证。但由于重建实验区域图像的密度值主要通过灰度值表达,在牙槽骨修复初期,骨纤维密度灰度值较低,在扫描图像上可能无法显示或者显示灰度值偏低,检测过程中可能造成部分样本丢失,使检测结果较实际组织成骨能力低[20]。此外,在图像重建过程中,牙周膜和牙龈等低密度组织不能显影,故Micro-CT无法对牙周膜和牙龈等组织的修复状况进行分析。因此,Micro-CT对牙周组织修复的检测具有一定的局限性,在实验中应结合组织学分析,以提高牙周组织修复分析的准备度和精确度。
LIPUS作为一种非侵入性机械能,不仅可以诱导成骨细胞分化,刺激细胞、细胞外基质增殖,加快钙盐沉积[21],而且能增强人牙骨质细胞碱性磷酸酶活性,促进胶原合成[22]。本研究中LIPUS组与LIPUS+GBR治疗组HE染色切片可见大量成骨细胞与成牙骨质细胞,细胞形态成立方状,核大,细胞功能活跃,说明LIPUS处理具有促进成骨细胞与成牙骨质细胞功能活性的作用。此外,通过Masson染色对骨组织胶原的染色反应,可以评价骨质的成熟度[23],LIPUS组与LIPUS+GBR治疗组新生组织Masson染色显示成熟骨组织胶原的分布较广,说明LIPUS能够促进新生牙槽骨中骨胶原合成,提高新生牙槽骨成熟度。
本研究通过组织形态学测量方法,评价LIPUS与GBR联合应用对牙周骨缺损牙槽骨修复的作用。研究结果显示LIPUS+GBR组较GBR组有更多的新生牙槽骨,统计学上具有显著性差异,说明LIPUS对牙槽骨修复具有促进作用,但是LIPUS+GBR组新生牙槽骨量有限,仅占缺损总面积8.08%~12.52%,缺损区胶原纤维束较多,原因可能是:移植骨主要为皮质骨,骨细胞及成骨细胞含量少,自身成骨作用有限,主要起支架作用,引导附近相关细胞进入缺损区形成新骨,该修复早期表现可能为先吸收再修复,由于实验时间只有4周,组织学反应主要表现为移植骨吸收。
4 结论
LIPUS辅助GBR治疗,在一定程度上可以促进牙周骨开窗缺损的早期修复。后续研究可考虑GBR术中选择适当的移植材料,比如牙周组织工程复合材料,通过组织工程支架直接引导成骨反应,以期进一步提高修复疗效。
[1]吴鹏,宋锦璘,冯格,等.低强度脉冲超声波对Beagle犬牙槽骨缺损的修复效应[J].华西口腔医学杂志,2010,28(5):522-525.
[2]孟焕新.牙周病学[M](第.3版).北京:人民卫生出版社,2008:264-269.
[3]Keles GC,Sumer M,Cetinkaya BO,et al.Effect of autogenous corticalbone grafting in conjunction with guided tissue regeneration in the treatment of intraosseous periodontal defects[J].Eur J Dent,2010,4(4):403 -411.
[4]Sato N,编,王勤涛,译.牙周外科学临床图谱[M].北京:人民军医出版社,2005:133-136.
[5]Becker W,Dahlin C,Becker BE,et al.The use of e-PTFE barrier membranes for bone promotion around titanium implants placed into extraction sockets:a prospective multicenter study[J].Int J Oral Maxillofac Implants,1994,9(1):31 -40
[6]Gher ME,Quintero G,Sandifer JB,et al.Combined dental implant and guided tissue regeneration therapy in humans[J].Int J Periodontics Restorative Dent,1994,14(4):332 -347
[7]何平,高翔,宋锦璘,等.低强度脉冲超声波对Beagle犬Ⅱ度根分叉病变的辅助效应[J].中国组织工程研究与临床康复,2011,15(7):1219-1223.
[8]董妮,宋锦璘,冯格,等.低强度脉冲超声波对Beagle犬牙周炎组织修复效应的初步研究[J].四川大学学报(医学版),2012,43(2):183-187.
[9]李娜,卢礼,宋锦璘,等.低强度脉冲超声波联合牙周组织翻瓣移植修复Beagle犬骨上缺损型牙周病[J].中国组织工程研究,2012,16(5):766-769.
[10]刘婷,宋锦璘,刘珉懿,等.低强度脉冲超声波对 Beagle犬下颌第三前磨牙慢性牙周炎组织学效应的探讨[J].中国超声医学杂,2011,27(11):970-973.
[11]Ikai H,Tamura T,Watanabe T,et al.Low-intensity pulsed ultrasound accelerates periodontalwound healing afterflap surgery[J].J Periodont Res,2008,43(2):212-216.
[12]杨尊,任蕾西,宋锦璘,等.低强度脉冲超声刺激对人类牙周膜细胞BMP-2表达效应的研究[J].中国美容医学,2011,20(5):767-770.
[13]郑鸿,卢礼,宋锦璘,等.低强度脉冲超声波联合引导组织再生术促进牙周骨开窗缺损修复的动物实验[J].中华口腔医学杂志,2011,46(7):431-436.
[14]Kobayashi Y,Sakai D,Iwashina T,et al.Lou-intensity pulsed ultrasound stimulates cell proliferation,proteoglycan synthesis and expression of growth factor-related genes in human nuclesus pulposus cell line[J].Eur Cell Mater,2009,17(3):15 -22.
[15]Zimmerman WK.Periodontal repair in dogs:supraalveolar defect modelsforevaluation ofsafety and efficacy ofperiodontal reconstructive therapy[J].Journal of Periodontology,1994,65(3):1151-1157.
[16]Weinberg MA,Bral M. Laboratory animal models in periodontology[J].J Clin Periodontol,1999,26(6):335 -340.
[17]Hjorting-Hansen A.Incomplete bone healing of experimental cavities in dog mandibles[J].British Journal of Oral Surgery,1971,9(1):33-40.
[18]Caton J,Motal,Gandinil.Non-human primate models for testing the efficacy and safety of periodontal regeneration procedures[J].J Periodontol,1994,65(12):1143 -1150.
[19]Assaf A.Ridge splitting technique:a 3-D solution for the thin Maxilla[J].Dental Horizons.2006,2(11):7 -11.
[20]Ming Jiang,Ge Wang,Margaret W,et al.Blind Deblurring of Spiral CT Images.IEEE Trans[J].Medical Imaging.2003,22(8):837-845.
[21]Sun Juisheng,Hong RC,Chang W Hong-Shong,et al.In vitro effects of low-intensity ultrasound stimulation on the bone cells[J].J Biomed Mater Res,2001,57(3):449 -456.
[22]Inubushi T,Tanaka E,Rego EB,et al.Effects of ultrasound on the proliferation and differentiation of cementoblast lineage cells[J].J Periodontal.2008,79(10):1984 -1990.
[23]郭建刚,赵然,侯桂英,等.骨组织成分与Masson三色染色反应的关系分析[J].中医正骨,2001,13(11):645-646.

