两种体外人肝细胞的不同培养方式的比较研究
杨 波 刘 宝 林 沈 力
(上海理工大学医疗器械与食品学院,上海 2 00093)
YANG Bo LIU Bao-Lin* SHEN Li
(Institute of Biothermal Engineering,University of Shanghai for Science.&Technology,Shanghai 200093,China)
引言
肝功能衰竭是一种死亡率很高的危重病症。药物保守治疗效果有限,而原位肝移植(orthotropic liver transplantation,OLT)又存在种种棘手的难题。如果能以人工方法替代或部分替代肝功能,给以短暂支持,则可帮助自体肝细胞再生,促进肝功能恢复或作为肝移植的过渡辅助。基于细胞功能构建的生物人工肝(bioartificial liver,BAL)是较为有效的方法。生物人工肝中的核心部分是执行肝功能的肝细胞,其直接决定着治疗效果,因此生物人工肝的关键材料是培养具有正常活性和功能的肝细胞。大量分离的肝细胞并不能直接应用于人工肝系统,因为此时肝细胞处于损伤期,还不具备完善的功能,需要进一步培养以恢复肝细胞特殊的生物功能,而人工肝支持系统的肝细胞培养不同于普通的细胞培养,需要进行大规模的培养。目前大规模培养系统主要有凝胶包裹、微载体、中空纤维、平板培养系统等,这些方法均能显著提高培养肝细胞的规模和质量[1-2]。肝细胞微载体粘附培养是近年来研究和应用较多的高密度肝细胞培养方法[3-6]。
采用cytodex 3型微载体进行人肝细胞L-02的微载体培养,对其功能进行测定,同时与平面贴壁培养的肝细胞进行了对照研究,就目前常用的两种体外方式培养的肝细胞在功能表达上是否存在差异,进行了系统的比较研究。以寻求一种相对简化的肝细胞体外培养方式,同时又使其不失良好的结构和功能表达,使人肝细胞能够更好的应用于体外生物人工肝的生物材料。
1 材料和方法
1.1 材料
实验所用的人肝细胞购于上海细胞生物研究所。cytodex 3微载体(球径133~215 μm,Pharma sia Sweden);实验试剂为标准胎牛血清,RPMI-1640培养液,DMSO(无菌),胰蛋白酶-EDTA消化液(0.25%),曲利苯蓝,尿素标准液,葡萄糖试剂盒等购自上海索莱宝生物科技有限公司。实验仪器有二氧化碳培养箱(上海博讯实业有限公司),立式压力蒸汽灭菌器(日本Tommy有限公司),Nikon显微镜等。
1.2 方法
1.2.1 微载体人肝细胞L-02的培养
主要步骤为:
(1)培养板的硅化:超净台上,取一次性无菌6孔细胞培养板一个,在每个孔中加入60 mL/L甲基硅树脂乙醇溶液12 mL,轻轻摇匀,吸出多余的溶液,置于60℃电烤箱烘干备用;
(2)微载体灭菌处理:在超净台上,干燥的微载体在无Ca2+和Mg2+的磷酸缓冲液(PBS)(每克Cytodex加50~100 mL)中室温下浸泡膨胀至少3 h;弃去上清液,用新配制的无 C a2+、Mg2+PBS(每克Cytodex加30~50 mL)洗涤微载体数分钟;弃去PBS,换上新的无Ca2+、Mg2+的PBS(每克 C ytodex加30~50 mL);然后,微载体溶液用高压灭菌法灭菌(115℃,15 min,15 psi);Cytodex非常稳定,可以反复(至少 5次)、长时间(130℃,12 h,27 psi)进行高压灭菌而不影响其性能;所有溶液的pH应为7.4;
(3)肝细胞接种前的平衡:在超净台上,将上述培养板孔中的液体吸出,再用灭菌的无Ca2+、Mg2+的PBS漂洗1次,吸弃PBS,用温和的含有100mL/L胎牛血清(FBS)及上述RPMI 1640培养基漂洗微载体,将温度调至37℃,培养基的pH=7.1~7.4,通入95%空气和5%C02混合气体,5 min后准备接种;
(4)人肝细胞L-02的小体积接种:在超净台上,将分离的人肝细胞L-02按2×105cells/mL的密度接种于上述培养板孔中,补充上述培养基至5mL,置培养板于37℃、5%CO2、100%湿度的二氧化碳培养箱中;
(5)人肝细胞L-02的“相对”静止培养:前6 h,每15~20min将培养板取出,在超净台上匀速、轻柔、水平摇晃1次,6 h后每1 h再摇晃1次,10 h后每2 h摇晃1次,每次摇晃时间均为1~2 min,16 h停止摇晃,置于培养箱中静止培养;培养24 h后换液,以后根据培养液颜色和透亮度来更换培养液,每次换去约4 mL的培养上清。
1.2.2 平面粘附人肝细胞L-02的培养
主要步骤为:
(1)配置培养液100 mL,取标准胎牛血清10mL,RPMI-1640培养液90 mL,分别加入储存瓶中混匀;吸取10 mL培养液至20 mL培养瓶中;
(2)吸取肝细胞悬液1 mL置于培养瓶;
(3)将培养瓶放入二氧化碳培养箱,在37℃、5%CO2二氧化碳培养箱中培养。
1.2.3 细胞形态学观察
用倒置生物显微镜对培养过程进行观察拍照。
1.2.4 细胞培养上清液检测白蛋白、尿素、葡萄糖含量
两组均每48 h更换一次培养液,收集第2、4、6、8、10 d的上清液;以溴甲酚绿法,二乙酰一肟显色法,葡萄糖氧化酶法在酶标仪(LRM340M,北京博迈杰科技有限公司)上测定白蛋白、尿素和葡萄糖的含量。
1.2.5 统计学处理
数据以¯x表示,采用SPSS V13.0软件对数据作单向方差分析。
2 结果
2.1 L-02人肝细胞上清液的生化指标(白蛋白、葡萄糖和尿素合成量)测定
2.1.1 两种培养方式测定的人肝细胞白蛋白含量

图1 10 d内微载体培养和平面培养肝细胞白蛋白分泌量的变化曲线Fig.1 The curve of hepatocyte albumin concentration of microcarrier culture and plane culture in 10 days
比较两种培养方式的肝细胞的白蛋白合成量的变化趋势。在10 d培养时间内,微载体的肝细胞白蛋白分泌量高于平面贴壁培养的肝细胞(见图1)。两组白蛋白合成量自开始培养后迅速升高,分别于第4和第6 d达最高峰,浓度分别为(40.97±3.28)mg/L和(35.69±1.21)mg/L。随着细胞的生长减慢和部分细胞衰亡,白蛋白的合成量逐渐降低;至第10 d,分别为(15.18±2.37)mg/L和(2.4±2.76)mg/L。表1显示了微载体培养的肝细胞和平面单层贴壁培养肝细胞10 d内测定的白蛋白分泌量,用t检验分析数据后得知微载体组和平面培养组在第6 d比较有显著性差异(P<0.05)。
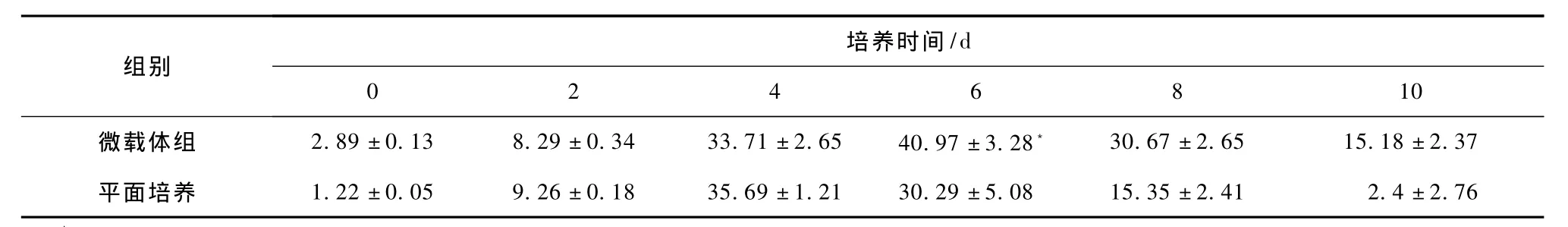
表1 肝细胞白蛋白合成功能(mg/L)Tab.1 Results of human hepatocyte L-02 secreted albumin
2.1.2 两种培养方式测定的人肝细胞尿素合成功能
测定10 d内两种细胞培养方式的人肝细胞尿素合成量,两种尿素合成量从开始培养先慢慢升高后逐渐降低(见图2)。最高尿素合成量均出现在第6天,微载体组最高达(5.08±0.13)mmol/L,平面培养组为(3.94±0.10)mmol/L。用t检验分析数据后得微载体组每天尿素合成量均显著高于平面贴壁培养组(见表2),两组比较有显著性差异(P<0.05)。
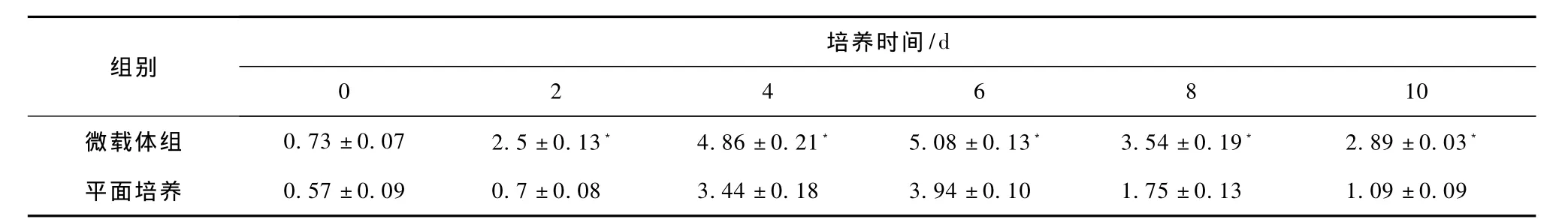
注:*与平面培养组同样培养时间比较有显著差异(P<0.05)
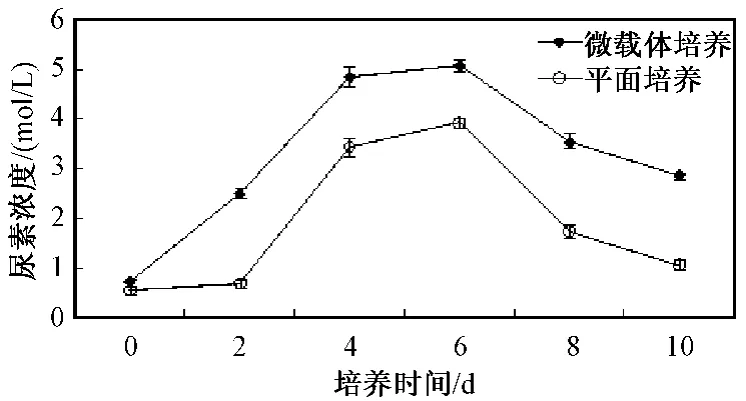
图2 10 d内微载体培养和平面培养人肝细胞尿素合成量的变化曲线Fig.2 The curve of hepatocyte concentration of microcarrier culture and plane culture in 10 days
2.1.2 两种培养方式测定的人肝细胞葡萄糖代谢功能
通过比较两种培养方式肝细胞葡萄糖合成量的变化趋势,发现在10 d培养时间内葡萄糖合成量先升高后逐渐降低(见图3)。两种培养方式葡萄糖最高合成量分别出现在第4、6 d,微载体组达11.19±0.27μmol/L高于平面培养组8.17±0.21μmol/L;由表3可知,微载体组葡萄糖合成量均高于平面培养组,其中第4、6和第8 d差异有统计学意义(P<0.05)。

表3 肝细胞葡萄糖浓度(μmol/mL)Tab.3 Results of human hepatocyle L-02 consumed glucose

图3 10 d内微载体培养和平面培养人肝细胞葡萄糖合成量的变化曲线Fig.3 the curve of hepatocyte glucose concentration of microcarrier culture and plane culture in 10 days
2.2 肝细胞的形态学观察
在倒置显微镜下观察:L-02肝细胞悬液和微载体一起加到限制贴壁培养瓶(图4(a)),1 h后,细胞开始向微载体聚集并粘附生长(见图4(b));18 h后,微载体上的肝细胞已经很多,均附着于微载体上并开始铺展(见图4(c));36 h后,大部分微载体已铺满细胞(见图4(d)),多个细胞包裹的微载体相互粘连,成片状或成团聚集生长。细胞在微载体上可继续生长10 d左右,10 d后已可见细胞从微载体脱落,死细胞开始增多。

图4 不同时间点微载体组肝细胞生长情况(100×)。(a)0 h;(b)1 h;(c)18 h;(d)36 hFig.4 Morphologies and proliferation of cytodex cells(100×).(a)0 h;(b)1 h;(c)18 h;(d)36 h
对照组新鲜分离的肝细胞为透亮圆形细胞,呈单个分散状态(见图5(a))。培养1 h开始出现伸展(见图5(b))。培养18 h部分肝细胞贴壁,贴壁的肝细胞呈典型上皮细胞样的多角形形态,胞体变平变薄,可见细胞伸展连接。培养36 h,细胞继续黏贴伸展,细胞间出现岛状连接,逐渐联成片状聚集(图5(d))。6 d后细胞需要换代培养或冻存,因为此时,细胞瓶内可见老化肝细胞已开始脱壁;继续培养,培养瓶内贴附生长的很多肝细胞会脱落死亡。

图5 不同时间点平面组肝细胞生长情况(100×)。(a)0 h;(b)1 h;(c)18 h;(d)36 hFig.5 Morphologies and proliferation of plane cells(100×).(a)0 h;(b)1 h;(c)18 h;(d)36 h
3 讨论
生物型人工肝一般专指人工培养的肝细胞为基础构件的体外生物反应系统,它不仅具有肝脏的特异性解毒功能,而且具有更高的效能。人工肝核心部分是执行肝功能的肝细胞,如何培养长期存活并具有活性的肝细胞,是目前生物人工肝的一个主要研究热点和发展方向。本研究基于此,就平面贴壁培养和微载体培养这两种目前常用的体外培养方式,对肝细胞活性的影响作一系列比较研究。
Cytodex-3载体在葡聚糖凝胶微球表面包被薄层胶原,不带电荷,每克Cytodex3约含3.0×106个微载体、膨胀系数为15,可提供2 700 cm2的表面积,密度为1.04 g/mL,直径大约141~211 μm,中位直径(d50)175 μ m。比重1.030~1.045,透明,对细胞无毒性,表面包被了一薄层胶原基质,该胶原成分适合肝细胞粘附、伸展和增殖。
本研究在相关文献报道[7-9]和工作条件的基础上,以自行建立的方法,通过抑制性贴壁,定时手工摇动,成功将人肝细胞L-02置于微载体Cytodex3样本上进行实验室小体积三维培养。微载体培养时,有几个影响因素:(1)微载体浓度:微载体浓度高,提供的肝细胞生长的面积就大,可以满足高密度肝细胞培养的要求;但过多的微载体会减少肝细胞的生存空间,因此,肝细胞培养需要有一个适宜的微载体浓度,国内外文献报道采用的微载体浓度一般为3~10 g/L[10-12]。考虑用间断摇动的方法悬浮微载体,微载体悬浮不均匀,浓度宜小,采用微载体浓度为0.5 g/100mL的浓度;(2)接种浓度:文献报道微载体肝细胞培养的接种浓度多在5×105~5×106cells/mL[13-14],接种细胞浓度过多,肝细胞生理活性和密度会逐渐下降、甚至造成细胞死亡;本实验室条件下,根据预试验情况选择了0.5×105cells/mL为肝细胞的接种浓度;(3)搅拌速度,实验中采用手工间断轻微摇动的方式,使肝细胞贴附于微载体之上;(4)实验中玻璃器皿的硅化,即抑制肝细胞贴壁,也抑制微载体贴壁,避免了二者贴壁对培养效果的影响,促进肝细胞与微载体粘附,实现悬浮贴附培养。
实验以0.5×105cells/mL的肝细胞接种浓度,5 g/L的微载体浓度,进行肝细胞的培养,同时以25 cm2培养瓶内进行平面培养为对照组,对培养的人肝细胞L-02进行定时的观察检测和评价,用倒置显微镜观察细胞,发现单层平面贴壁培养的细胞在培养2 h后细胞开始贴壁,随后贴壁生长聚集连接形成岛状,直至长满瓶壁;而微载体培养的细胞也是2 h后开始黏附微载体,随后在微载体上慢慢黏附聚集生长,多个微载体表面的肝细胞连接成团,形成“肝细胞/微载体”的基本结构模式。随培养时间的延长,其包含的微载体及细胞数量增多,体积增大,直至1 mm左右。试验中微载体组培养的细胞存活时间为14 d,平面贴壁组培养的细胞存活时间为10 d。这说明微载体的培养方式更适合体外肝细胞的存活。
正常肝细胞具有分泌白蛋白、合成葡萄糖和尿素的功能,目前这3项功能亦被选作评估肝细胞活性的主要测定指标。测定了10 d内两种培养方式下的肝细胞白蛋白分泌量、葡萄糖消耗和尿素合成量,两组在培养的第4~8 d,肝细胞合成、代谢功能在整个培养过程中均处于较高水平,第6 d达峰值。微载体组与平面贴壁组相比,差异均有统计学意义,同时微载体黏附培养的肝细胞保持较长时间强大的生化功能,说明肝细胞在微载体上贴附生长、聚集,借助微载体能形成一定的三维结构,从而更好的保持肝细胞功能及生长,与文献报道相符[15-17]。
肝细胞微载体粘附悬浮培养,是一种较为理想的肝细胞体外培养的模式。微载体肝细胞粘附培养可望为肝细胞移植、生物人工肝提供足够数量、功能良好的肝细胞,具有较高的实用价值。
4 结论
1)以自行建立相对简化的方法,通过限制性贴壁,定时手工摇动,成功地进行了人工肝细胞的微载体黏附培养。
2)无论是单层平面贴壁培养还是微载体培养,肝细胞在培养第4~8 d合成及代谢功能及细胞状态均处在一个较高的水平。培养10 d内测定微载体组的葡萄糖、尿素合成和白蛋白分泌能力,均明显高于单层平面贴壁组。
3)微载体组培养的肝细胞存活时间为14 d,平面贴壁组培养的细胞存活时间为10 d。
[1]Patzer IJ.Lopez RC,Zhu Y,Wang ZF,et al.Bioartificial liver assist devices in support of patients with liver failure[J].Hepatobiliary Pancreat Int,2002,1(1):18-25.
[2]Fiona G.Court G,Simon A,et al.Bioartificial liver support devices:historical perspectives[J].ANZJ Surg,2003,73(9):739-786.
[3]Chen Z.Ding Y,Xu Q,et al.Bioartificial liver inoculated with porcine hepatocytes periods for treatment of canine cute liver failure model[J].Artif Organs,2003,27(7):613-634.
[4]Chung YJ.Lee HJ,Koh YT,et al.Isolation and culture of pig hepatocyte in large scale for the application of bioartificial liver system[J].Taehan Kan Hakhoe Chi,2002,8(3):249-303.
[5]PATZER II JF.Advances in bioartificial liver assist devices[J].Ann N Y Acad Sci,2001,944:320-352.
[6]Sussman NL,Chong MG,Koussayer T,et al.Reversal of fulminate hepatic failure using an extracorporeal liver assist device[J].Hepatology,1992,16(1):60-64.
[7]陈柯,高毅.正常原代猪肝细胞方瓶微载体静止培养[J].世界华人消化杂志,1999,7(3):22-24.
[8]辛绍杰,邹正升,王敏,等.中国小型猪肝细胞cytodexTM3微载体培养及其功能[J].世界华人消化杂志,2002,10(12):1376-1380.
[9]Figallo E,FlaibaniM,Zavan B,etal.Micropattemed biopolymer 3D scaffold for static and dynamic culture of human fibroblasts[J].Biotechnology Prog,2007,23(1):210-216.
[10]Demetriou AA,Whiting JF,Feldman D,et al.Replacement of liver function in rats by transplantation of microcarrier—attached hepatocytes[J].Science,1985,233(4769):1190-1192.
[11]王英杰,李梦东,王宇明,等.大鼠肝细胞的做载体粘附培养[J].中华实验外科杂志,1997,14(1):61-62.
[12]唐南洪,陈燕凌,王晓茜,等.应用微载体Cytodex-3高密度培养L-02人肝细胞系[J].福建医科大学学报,2000,34(4):331-333.
[13]Lin ML,Mars WM,Zamegar R Michalopoulos GK.Collagens pretreatment and the mitogenic effects of hepatocyte growth factor and transforming growth factor-alpha in adult rat liver[J].Hcpatology,1994,19(6):1521-1527.
[14]王英杰,李梦东.人肝细胞的微载体培养及其意义[J].中华消化杂志.1997,17(4):191-194.
[15]Gion T,Shimada M,Shirabe K.et.al.Evaluation of a hybrid artificial liver using a polyurethane foam packed-bed culture system in dogs[J].J Surg Res,1999,82(2)131-136.
[16]Pahernik SA,Thasler WE,Doser M,et.al.High density culturingofporcine hepatocytes immobilized on nonwoven polyurethane-based biometrics[J].Cells Tissues Organs,2001,168(3):170-176.
[17]Kurosawa H,Yaspmoto K,Kimura T,et.al.Polyurethane membrane as an efficient immobilization carrier for high-density culture of rathepatoeytesin the fixed-bed reactor[J].Biotechnol Bioeng,2000,5:160-170.

