大肠癌细胞的原代培养方法
杨磊磊,戴岳楚,董米连,朱 敏,林雪飞,廖 伟,梅 统
大肠癌是最常见的恶性肿瘤之一[1],为研究大肠癌的发生发展的机制,国外已经建立了大肠癌细胞株,细胞株经过长期培养后,生物学特性会产生变异。而原代培养的细胞离体时间短,则与体内状态更相近,能很好地反映患者的疾病特征。关于大肠癌细胞原代培养方法国内外已有较多的报道,但成功率很低[2]。2010年3月—2010年11月我们对60例大肠癌患者的肿瘤细胞进行原代培养,并对不同的培养方法加以改进。
1 材料与方法
1.1 标本 标本来自手术治疗的60例大肠癌患者(男33例,女27例;年龄20~84岁),术前均未经放射治疗和抗肿瘤化学药物治疗。
1.2 主要试剂 胰蛋白酶、Ⅳ型胶原酶、转铁蛋白(Sigma)、肿瘤细胞分离液、1640培养液、胎牛血清、0.14%台盼蓝染液(Sigma公司)、Giemsa染液、免疫细胞化学相关试剂。细胞原代培养主要试剂的配制见表1。
1.3 标本采集与处理 采用了两种取材方法:(1)黏膜层法。打开肠腔,找到癌灶,冰冷生理盐水冲洗干净,找到癌细胞最丰富的部位。根据肿瘤大小切取1.5~2.5cm3大小的肿瘤组织,修剪并去除坏死组织及脂肪组织。聚维酮碘溶液浸泡2~3min,洗液A反复冲洗。(2)浆膜层法。不打开肠腔,聚维酮碘消毒,打开浆膜层、肌层,找到肿瘤细胞最丰富的部位取材,洗液A反复冲洗。将组织块表面薄层剔除。
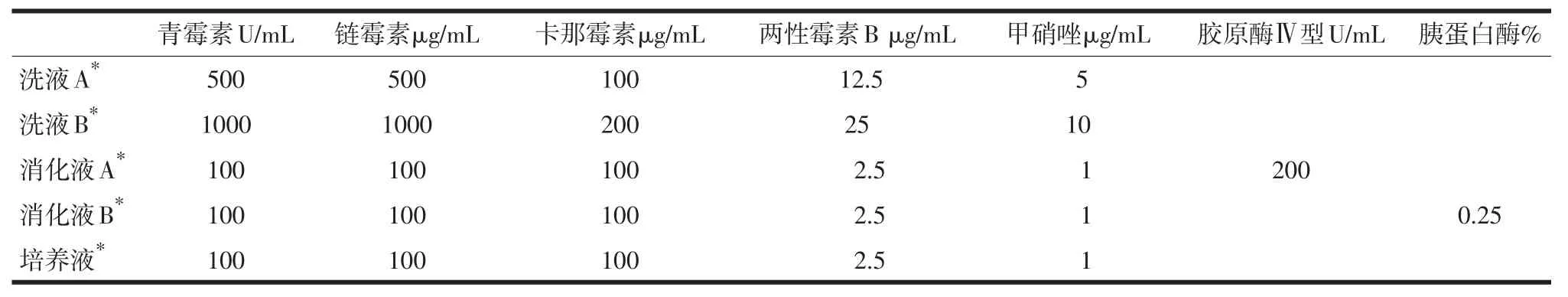
表1 细胞原代培养主要试剂的配制
1.4 大肠癌细胞分离与培养 组织块法:(1)将组织块切碎(0.5~1mm3),洗液B反复吹打,使碎块充分分散。(2)移入15mL无菌离心管中。(3)1000r离心2min,移除上清液。(4)洗液B重悬,重复步骤(3)2次。(5)用吸管将组织碎块移入25cm2预先用L-左旋多聚赖氨酸处理过的培养瓶中,加2mL预先配好的培养液,将培养瓶底朝上放入37℃含5%CO2的培养箱中2~4h,缓慢翻转培养瓶继续培养。(6)绝对静置12~24h,缓慢取出培养瓶补加培养液2mL,继续培养。绝对静置2d。(7)3d后小心取出培养瓶仔细观察并将漂浮的碎块去除,更换培养液继续培养。
机械分离法:(1)同组织块法的(1)~(4)。(2)将组织碎块移入不锈钢滤网中,研磨并收集研磨液于15mL无菌离心管中。(3)加入等体积的肿瘤细胞分离液。可见到分离液逐渐下沉,出现明显的分层,上层是研磨液,下层是肿瘤细胞分离液。(4)2000r离心10min,取出离心管,可见明显分层(3层)。收集中间层于另一个15mL无菌离心管中。(5)加入5~10mL洗液B,1000r离心5min,移除上清液。(6)用洗液B重悬,重复步骤(5)1次。(7)加入5mL培养液重悬。(8)将悬液移入25cm2预先用L-左旋多聚赖氨酸处理过的培养瓶中,将培养瓶放入CO2培养箱中继续培养。(9)绝对静置24~48h,缓慢取出培养瓶观察培养液颜色,判断是否需要补加培养液,继续培养。
胰蛋白酶消化法:(1)同组织块法的(1)~(4)。(2)将组织碎块移入15mL无菌离心管中。加入3~5mL胰蛋白酶消化液,放入37℃恒温振荡箱中,不断振荡,每隔15min观察1次,30min后每隔15min收集消化液。(3)1000r离心2min,移除上清液,收集细胞沉淀,用洗液A冲洗。(4)将收集的细胞沉淀用培养液重悬,置于4℃冰箱中,直至消化过程全部结束(组织碎块充分弥散开为止)。(5)将细胞悬液通过无菌的不锈钢滤网,收集滤液于15mL无菌离心管中。(6)同机械分离法(3)~⑼。
Ⅳ胶原酶消化法∶(1)同组织块法的(1)~(4)。(2)将组织碎块移入15mL无菌离心管中。加入3~5mLⅣ胶原酶消化液,放入37℃恒温振荡箱中,不断振荡,每隔20min观察1次。直至消化过程全部结束(组织碎块充分弥散开为止)。(3)将消化液连同组织碎块一起移入不锈钢滤网,收集滤液于15mL无菌离心管中。(4)同机械分离法(3)~⑼。
1.5 细胞成活率检查 采用台盼蓝染料排斥实验,其原理为活细胞能排斥染料,但细胞膜完整性破坏后,染料可弥散入细胞内。取纯化后的细胞悬液50μL加入等体积0.14%台盼蓝充分混匀。5min内进行细胞计数及活性鉴定,死细胞着蓝色,活细胞不着色。
1.6 传代方法 每天观察细胞的生长情况,每3d更新培养液,待细胞覆盖瓶底70%~90%时可进行传代。(1)去除培养液,PBS洗两次,加入含0.2%EDTA的0.1%的胰蛋白酶2mL。(3)见到部分细胞变圆并开始脱落,每隔2min收集脱落细胞于15mL离心管中,并向离心管中加入等体积培养液终止消化。(4)每次收集细胞后重新向培养瓶补加0.1%的胰蛋白酶1mL继续消化,直至消化过程全部结束。(5)1000r离心5min,移除上清液。(6)加入10mL培养液重悬。吸取5mL分别移入2个25cm2预先用L-左旋多聚赖氨酸处理过的培养瓶中,即为P1代。(7)将培养瓶放入37℃含5%CO2的培养箱中继续培养。
1.7 大肠癌原代细胞的鉴定 细胞形态观察,用瑞吉染色法染色并观察细胞形态。细胞免疫学鉴定,用免疫细胞化学法分别检测细胞角蛋白(cytokeratins,CK)及癌胚抗原CEA。
1.8 统计学方法 应用SPSS 13.0统计软件分析,计数资料结果分析采用卡方检验,以P<0.05为差异有统计学意义。
2 结果
2.1 细胞分离培养方法比较 如表2所示,黏膜层取材组优于浆膜层取材组(P<0.05)。胶原酶消化法优于胰酶消化法(P<0.05),胰酶消化法优于机械分离法(P<0.05),机械分离法与组织块法差异无统计学意义(P>0.05)。其中胶原酶消化法是最优的人类大肠癌细胞原代培养方法,细胞培养成功率达到66.7%。取材方法与分离培养方法对细胞培养成功率都有影响(P<0.05)。

表2 大肠癌细胞分离培养方法的比较(n=60)
2.2 细胞培养结果及鉴定结果 细胞培养结果详见图1~图5。瑞吉染色法,细胞核被染成紫红色,细胞浆被染成蓝色,细胞核大深染,核质比增大(图6)。免疫细胞化学检测细胞角蛋白,细胞的胞浆被染成棕黄色,而阴性及空白对照则仅见胞核为苏木素复染呈蓝色,胞浆阴性(图7)。癌胚抗原CEA检测结果与相应患者组织标本免疫组化鉴定结果一致。

图1 大肠癌原代细胞培养第1代

图2 大肠癌原代细胞培第2代
图3 大肠癌原代细胞培养第3代

图4 大肠癌原代细胞培养第10代

图5 大肠癌原代细胞培养第20代

图6 大肠癌细胞原代培养第10d瑞吉染色
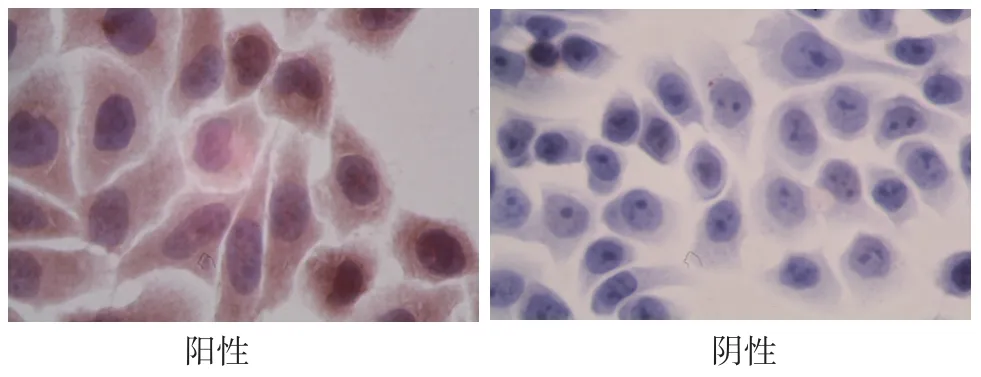
图7 大肠癌细胞原代培养第10d细胞免疫化学检测细胞角蛋白200×
3 讨论
肿瘤细胞原代培养程序复杂,细胞生长受到温度、营养物质、酸碱度等多种因素的显著影响,细胞培养工作的各个环节都有严格的规定和要求。因此,要认真的摸索实验条件,总结经验,这样才能提高细胞培养的成功率。肿瘤细胞体外的成功培养关键在于肿瘤组织的选择、杂细胞的排除、适宜的生存环境等几个方面。由于大肠本身就是一个细菌生存的大容器,所以污染是大肠癌细胞培养中所必须克服的首要问题。因此我们主要从这几个方面来进行讨论。
3.1 大肠癌细胞分离培养方法的比较 胶原酶消化法适用较广,成功率最高;胰酶消化法成功率仅次于胶原酶消化法,会影响细胞贴壁效果,长期培养效果不佳;机械分离法对标本要求较高,机械分离作用易使细胞受损,细胞成活率较低;组织块法操作简单,成本低,细胞成活率较低。
3.2 控制污染措施 在控制污染方面,不但要求所用器材、试剂都保持无菌,严格按照无菌操作的原则进行操作。我们还着重从以下几个方面采取了进一步的控制污染措施:(1)术前清理肠道。(2)取材前清洁取材部位,冰冷生理盐水反复冲洗,聚维酮碘消毒。(3)取材方法的改进。我们用了两种取材方法,黏膜层法及浆膜层法。黏膜层法比浆膜层法直观,在直视下取到的肿瘤细胞更丰富。但是黏膜层法需要打开肠腔增加了污染的可能。浆膜层法可以降低污染的可能,却很难获得足够的肿瘤细胞。(4)取材后立刻用聚维酮碘浸泡2~5min。(5)分离过程中始终保持细胞在有抗生素的环境中进行。通过对抗生素的浓度进行对照研究,配制出了含不同抗生素浓度的洗液A、B以及消化液A、B。取得了良好的效果。(6)培养基中加入适量抗生素也可有效防止污染。通过对照研究配制出含抗生素的培养液。
3.3 肿瘤组织的选择 (1)挑选术前未经过任何放化疗的患者作为实验对象。(2)肿瘤组织足够大(>2cm3),保证能够获得体积>1cm3的组织。(3)在肿瘤细胞丰富的部位取材。(4)避开坏死区及脂肪组织较多的部位。(5)为了保证细胞成活率,还要注意取材要快。最好在肿瘤组织离体30min内开始实验。(6)为了防止肿瘤细胞发生自溶或凋亡,在成功接种肿瘤细胞前要保持肿瘤细胞始终在4℃的环境中。
3.4 杂细胞的排除 (1)取材前避开坏死及脂肪组织,取材后仔细修剪。(2)肿瘤细胞分离过程中加入肿瘤细胞分离液,可以获得较纯的肿瘤细胞。(3)成纤维细胞的清除。我们采用胰酶消化法来清除成纤维细胞,利用了不同细胞对胰酶的敏感性不同,成纤维细胞首先被消化下来,从而获得了较纯的肿瘤细胞。小鼠结肠上皮细胞在5%的血清浓度条件下生长良好,并且可在一定程度上抑制成纤维细胞的生长。在本实验中,发现大肠癌肿瘤细胞在5%的血清浓度条件下生长非常缓慢,而在20%的血清浓度条件下生长良好。(4)杂细胞清除时间的选择。国外许多学者的经验表明,当肿瘤组织块贴壁后,其癌细胞成片的生长,形成集落,常常抑制了杂细胞的生长,但也存在少量的杂细胞。根据这个结论,可以暂不对贴壁的细胞进行消化清除杂细胞,而是在第一次传代时进行。
3.5 培养条件 (1)为了促进细胞生长,我们对培养基进行了优化,在1640培养基中加入了可以促进细胞生长的胰岛素和转铁蛋白。小剂量的胰岛素可刺激细胞的生长,而过大则可能使细胞处于一种“饥饿状态”,反而抑制其生长。我们在培养液中加入了0.5μg/mL的胰岛素,细胞生长良好。(2)原代细胞培养贴壁比较困难,在分离获得分散细胞并接种后要保持培养瓶绝对静置2~3d,以免过早晃动导致细胞脱落。文献报道,有用小鼠胚胎肺成纤维细胞-3T3细胞作为滋养层提高细胞的接种效率,也有用自制鼠尾胶原铺制培养瓶来促进细胞贴壁。需要注意的是,在鼠尾胶原的制备过程中,由于鼠尾胶原为黏度较大的半透明液体,难以滤过除菌,整个制备过程需严格无菌,增加了污染的机会。我们采用了多聚赖氨酸包被培养瓶法及血清包被培养瓶法,收到了良好的效果,而且操作简单。还应注意,在用胰酶消化法分离培养细胞时,要分次消化收集消化下来的细胞,这样可以缩短细胞与胰酶直接接触的时间,减少胰酶对细胞的损伤,使贴壁更容易。同样在第一次传代时,由于原代细胞生长缓慢,第一次传代时往往细胞已经生长了2周左右,消化非常困难,也要注意用分次消化法,以免消化时间过长导致贴壁困难。
3.6 细胞分离培养方法比较 (1)组织块法方法简便、有效、成本低,但是杂细胞较多。组织块法需注意剪碎的组织块大小要适宜,如果过大,组织块边缘贴壁不良细胞溢出减少;如果过小,则因剪切过度而使细胞受损。在加液时一定要小心,以免冲散刚贴壁的组织块,导致重新漂浮,而影响成活。(2)机械分离法操作简单、成本也比较低,但是机械分离需要研磨组织,产生大量的细胞碎片影响正常细胞的生长。我们用了肿瘤细胞分离液去除了细胞碎片,但是研磨还导致大量的细胞受损,收集到的细胞活性很低,因此成功率很低(18.3%)。(3)胰酶消化法,取决于不同的细胞对胰酶消化的敏感性,关键是消化时间不易把握,时间过短获得的肿瘤细胞数量不够,时间过长影响细胞贴壁。成功率相对较高(41.7%)。(4)胶原酶消化法是细胞原代培养比较成功的方法,国外报道成功率在50%~60%[3]。我们在Simon P等[4]人方法的基础上进行了改进,建立了较为合理、高效、稳定的短期大肠癌细胞原代培养模式,即通过黏膜层取材,优化后的胶原酶消化法,使人类大肠癌细胞原代培养成功率提高到66.7%。
[1]Saunders M,Iveson T.Management of advanced colorectal cancer:state of the art[J].Br J Cancer,2006,95(2):131~138.
[2]Dangles-Marie V,Pocard M,Richon S,et al.Establishment of hu⁃man colon cancer cell lines from fresh tumors versus xenografts:comparison of success rate and cell line features[J].Cancer Res,2007,67(1):398~407.
[3]Alessandra Failli1,Rita Consolini1.The challenge of culturing hu⁃man colorectal tumor cells:establishment of a cell culture model by the comparison of different methodological approaches[J].Tu⁃mori,2009,95(3):343-347.
[4]Simon P.Cancer cell culture:methods and protocols[M].New Jer⁃sey Humana Press,2004:79-93.

