有氧运动对心肌细胞增殖/凋亡的影响及其机制探讨
田振军,蔡梦昕,邢维新
有氧运动对心肌细胞增殖/凋亡的影响及其机制探讨
田振军1,蔡梦昕1,邢维新2
目的:探讨有氧运动对大鼠心肌细胞增殖和凋亡的影响及其可能机制。方法:选取3月龄雄性SD大鼠30只,体重180~220g。随机分为正常对照组和有氧运动组,每组15只。正常对照组大鼠常规笼内生活,有氧运动组大鼠进行8wk有氧运动。运动以15m/min的速度开始,运动20min后,以3m/min的递增速度逐渐递增至20m/min,并增加跑台坡度至5°,总运动时间为60min,5d/1wk×8wk。训练结束后,测定HR、LVSP、LVEDP和± dp/dtmax等指标,判定各组大鼠心功能变化;之后开胸摘取心脏,进行组织学制片、Masson染色和心肌细胞分离与激光共聚焦显微镜观察;免疫组织化学法观察分析干细胞表面标记蛋白c-kit及其配体SCF,细胞凋亡相关因子Bax、Bcl-2和p53蛋白表达;Western Blotting法分析细胞周期与细胞增殖相关蛋白CyclinD2、CDK4和PCNA的表达。结果:与正常对照组相比,有氧运动组大鼠心系数均显著增加(P<0.05);HR和LVEDP均显著下降(P<0.05),LVSP和±dp/dtmax均显著升高(P<0.05),双核心肌细胞出现率显著增加(P<0.05),心肌组织中,c-kit和SCF的MOD值均显著升高(P<0.01),Bcl-2的MOD值显著升高(P<0.05),p53的MOD值显著下降(P<0.01),Bax的MOD值显著下降(P<0.05);心肌组织CyclinD2和CDK4蛋白表达有升高趋势,但无显著性差异,PCNA蛋白表达显著升高(P<0.01)。结论:证实了有氧运动可显著提高大鼠心功能;证实了大鼠心肌细胞存在着增殖现象;有氧运动可抑制促凋亡因子的表达,抑制心肌细胞凋亡;发现了有氧运动可促进心肌细胞增殖相关因子的表达,诱导心肌细胞的增殖。有关运动影响心肌细胞增殖与凋亡的分子机制,有待于进一步深入研究。
心肌细胞;细胞凋亡;细胞增殖;有氧运动;鼠;动物实验
组织器官的增生与肥大一般包括细胞体积增大和数量增多。一直以来,人们普遍认为,心肌细胞属于终末分化细胞,出生不久后退出细胞周期,丧失增殖能力。故运动性心脏肥大以心肌细胞体积增大为主,主要体现在耐力训练和力量训练的运动员心脏结构的重塑上,而安静状态下的心功能变化不显著[34]。但近年来研究发现,正常生理和运动状态下心肌细胞存在着凋亡现象[23]。从维持心肌细胞数量的动态平衡,稳定心功能的角度,推测心肌细胞必然存在着增殖现象。目前研究证实,正常心脏存在着固有干(祖)细胞[14,37],心肌细胞确有增殖能力[9,13,35,37]。尽管其增殖能力非常有限[8],且更新率随年龄增长而逐渐降低[9],但在维持心功能稳定和受损心肌恢复方面,具有极其重要的生物学和临床医学意义。
已有研究表明,运动对心肌细胞凋亡产生影响,大强度运动可引起心肌细胞凋亡显著增加[1,3,17],如果心肌细胞不具备增殖能力,那么,运动的风险将难以置信。因此推测,运动对心肌细胞增殖同样具有一定的影响。目前,国内外关于运动对心肌细胞增殖的研究报道极其有限,本研究仅从大鼠心功能、心肌细胞增殖相关因子及干细胞表面标记蛋白和细胞凋亡等相关指标入手,探讨有氧运动对心肌细胞增殖和凋亡的影响及其可能机制,为运动性心肌肥大机制研究和运动防治心血管疾病提供实验依据。
1 材料与方法
1.1 实验动物与分组
实验动物为Sprague Dawley 3月龄雄性大鼠30只,体重180~220g,购于西安交通大学实验动物管理中心(动物质量合格证号:陕医动证字08-004号)。随机分为对照组和有氧运动组,每组15只,分笼饲养,每笼6只。动物室内温度20℃~29℃,相对湿度50%~60%,大鼠均采用国家标准啮齿类动物干燥饲料喂养,自由饮水、进食。
1.2 主要仪器和试剂
主要仪器为PowerLab/8s生理信号采集处理系统,ALC-V8动物呼吸机,LEICA-RM 2126切片机,BM-Ⅱ型病理组织包埋机,生物组织摊烤片机,Leica TCS SP5激光共聚焦扫描显微镜,BX51奥林巴斯光学显微镜,低温高速离心机、酶标仪,Biorad电泳仪和转移槽、凝胶成像仪等。主要试剂除常规试剂无水乙醇、二甲苯等外,Tween 20、SABC试剂盒、DAB显色试剂盒、兔抗小鼠、大鼠、人多克隆抗体SCF、Bcl-2、Bax和p53均购于武汉博士德生物工程有限公司,兔抗大鼠多克隆抗体PCNA购于北京博奥森生物有限公司,兔抗大鼠多克隆抗体CyclinD2、CDK4和c-kit均购于santa cruz公司,STDIn-AM荧光探针由本校化学材料学院合成馈赠。
1.3 动物运动方案
安静对照组正常笼内生活,不运动。有氧运动组大鼠进行为期8wk的小动物跑台运动,初始速度为15m/min,运动20min后,以3m/min的增速逐渐递增至20m/min,并增加跑台坡度至5°,共运动60min,5d/1wk×8wk[2]。
1.4 心系数和血流动力学指标测定
8wk实验后次日上午,大鼠称重麻醉后,经右颈总动脉逆行插管至左心室,以多导生理记录仪测试心率(HR)、左室收缩压(LVSP)、左室舒张末压(LVEDP)、左室压力最大上升速率(+dp/dtmax)和最大下降速率(-dp/dt max)等心功能指标。数据采集完毕后,迅速开胸摘取心脏,生理盐水冲洗淤血,滤纸吸干,称取心脏重量,以心脏重量与体重比值计算心系数。
1.5 心脏样品处理
每组随机选取6只大鼠心脏,置10%中性甲醛溶液固定24h后,经流水冲洗、梯度乙醇脱水、二甲苯透明,石蜡包埋。连续切片(厚5μm),常规制片,Masson染色。另取6只大鼠心脏铝箔纸包裹,液氮冷冻24h后,移至-80℃低温冰箱保存,用于Western Blotting实验。
1.6 心肌细胞分离与观察
离体心脏经主动脉插管进行Ⅰ型-胶原酶灌流,分离心肌细胞,STDIn-AM负载,用于标记心肌细胞胞浆和胞核,激光共聚焦扫描显微镜观察[2],计算心肌细胞双核出现百分率。
1.7 免疫组化实验
切片严格按照SABC免疫组化染色试剂盒说明书操作步骤进行。切片脱蜡至水,PBS液清洗,3%H2O2浸泡10 min,消除内源性过氧化物酶,PBS清洗,正常山羊血清封闭液37℃孵育30min以封闭非特异性结合位点,甩去血清,用一抗(c-kit、SCF、Bax、Bcl-2和P53抗体,均为1∶60)兔抗大鼠多克隆抗体,4℃孵育过夜,PBS冲洗5次,二抗为生物素标记的山羊抗兔抗体(1∶200)37℃孵育30 min,PBS冲洗5次,SABC复合物37℃孵育30min,PBS冲洗5次,DAB显色,蒸馏水洗涤终止反应,苏木精复染,常规脱水、透明,中性树胶封片。每次染色设置空白对照(PBS取代一抗和二抗)及阴性对照(PBS取代一抗)。采用Olympus显微图像分析系统观察,低倍镜选位,400倍镜下拍照。
1.8 CyclinD2、CDK4和PCNA的Western Blotting实验
采用Western Blotting法测定CyclinD2、CDK4和PCNA蛋白表达,其常规程序为:10%~12%Tris-甘氨酸SDS聚丙烯酰胺凝胶电泳分离蛋白。CyclinD2、CDK4和PCNA一抗稀释浓度分别为1∶500、1∶300和1∶800。
1.9 数据采集与统计学处理
组织切片经Olympus光镜观察,Image-Pro Plus5.1软件采集图像。Western Blotting所得胶片采用ImageQuant TL软件进行分析,所得数据用GraphPad Prism 5.0Demo软件转换作图。所有数据均采用SPSS 17.0软件包进行处理,采用独立样本t检验进行显著性差异分析,P<0.05为差异显著,P<0.001为差异极显著,实验结果以平均数±标准差()表示。
2 实验结果
2.1 心系数和心功能参数的变化
与安静对照组大鼠比较,有氧运动组大鼠体重显著下降(P<0.01),心脏重量和心系数均显著升高(P<0.05,表1);HR和LVEDP显著下降(P<0.05),LVSP和±dp/dtmax均显著升高(P<0.05,表2)。

表1 大鼠体重、心重及心系数变化一览表Table 1 The Body Weight,Heart Weight and Heart Coefficient Changes in Rats

表2 大鼠血流动力学参数变化一览表Table 2 The Comparsion of Different Index of Hemodynamic in Rats
2.2 组织学与细胞学观察结果
Masson染色显示,对照组大鼠心肌细胞排列整齐,心肌细胞核呈蓝紫色,胞浆呈紫红色,区分显著,偶见双核心肌细胞;有氧运动组大鼠心肌纤维结构清晰,肌纤维和细胞核大小匀称,排列较对照组更紧密整齐,偶见双核心肌细胞,且出现率多于对照组。激光共聚焦扫描显微镜下可见,心肌细胞胞浆呈浅绿色,胞核呈绿色,两组双核心肌细胞明显,且有氧运动组出现率多于对照组(图1A-C和图2A)。
2.3 c-kit、SCF、Bcl-2、Bax和p53表达的免疫组化观察结果
光镜下可见,c-kit、SCF、Bcl-2、Bax和p53在各组心肌组织中均有表达,阳性颗粒主要表达于心肌细胞膜和细胞浆部位。与对照组比较,有氧运动可使大鼠心肌组织c-kit和SCF及Bcl-2的MOD值显著升高(P<0.01,P<0.05),p53和Bax的MOD值显著下降(P<0.01,P<0.05;表3、图2B~F)。
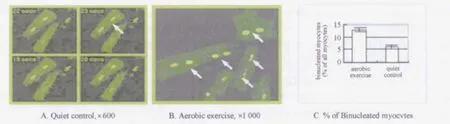
图1 大鼠心肌细胞荧光染色图Figure 1. Fluorescence staining of rat myocardial cells
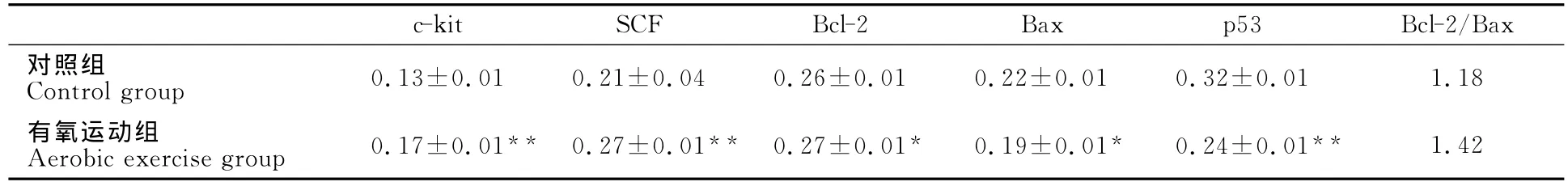
表3 大鼠心肌组织c-kit、SCF、Bcl-2、Bax和p53表达的MOD比较一览表Table 3 The Comparation of MOD Expression of the c-kit、SCF、Bcl-2、Bax and p53in Rat Myocardium
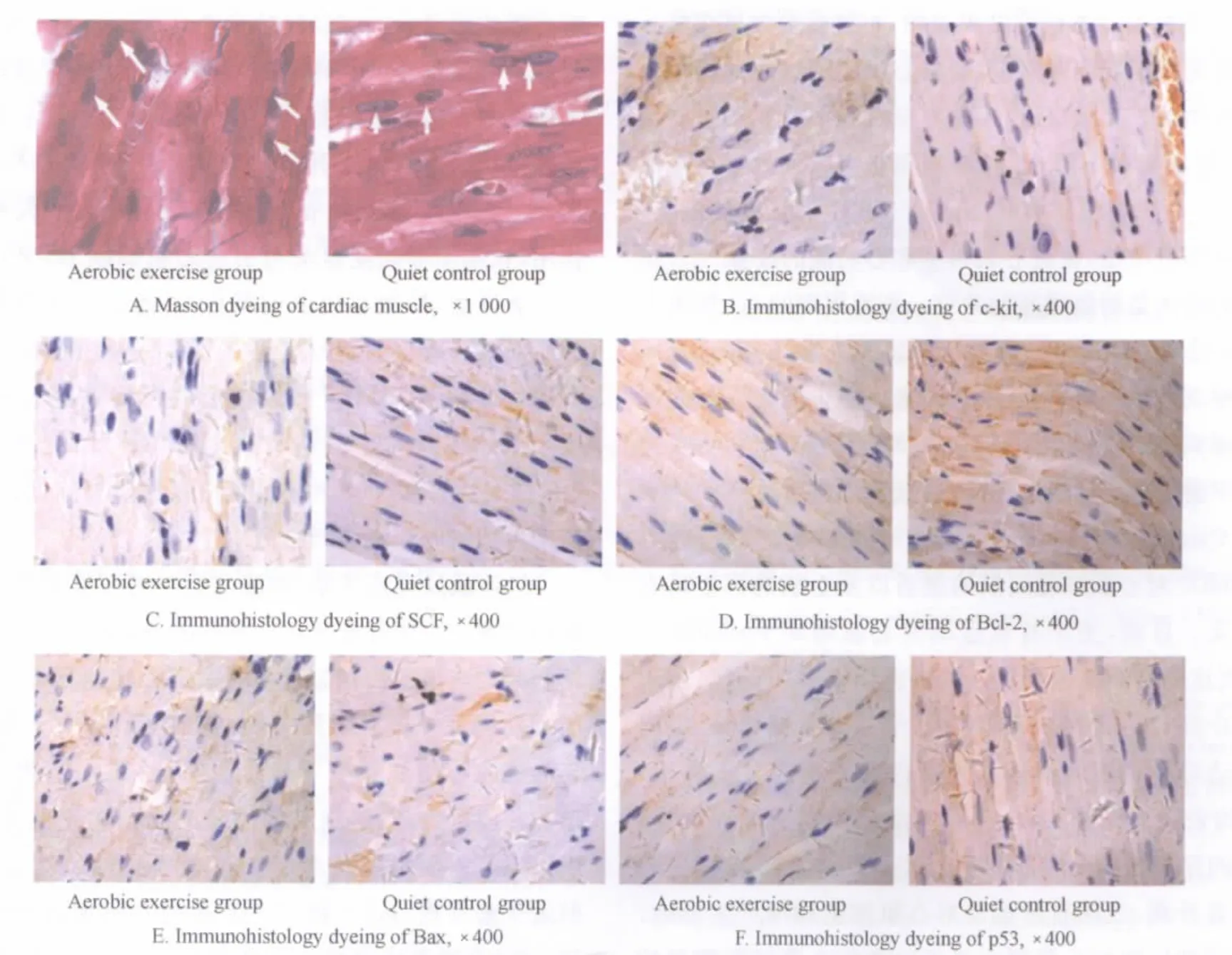
图2 大鼠心肌组织Masson染色,c-kit、SCF、Bcl-2、Bax和p53蛋白表达的免疫组化图Figure 2. Masson dyeing and Immunohistochemical Results of the Expression of c-kit,SCF,Bcl-2,Bax and p53in Rat Myocardium
2.4 CyclinD2、CDK4和PCNA蛋白表达的Western Blotting结果
Western Blotting结果表明,与对照组比较,有氧运动组大鼠心肌CyclinD2和CDK4蛋白表达有升高趋势,但无显著性差异。PCNA蛋白表达显著升高(P<0.01,图3)。
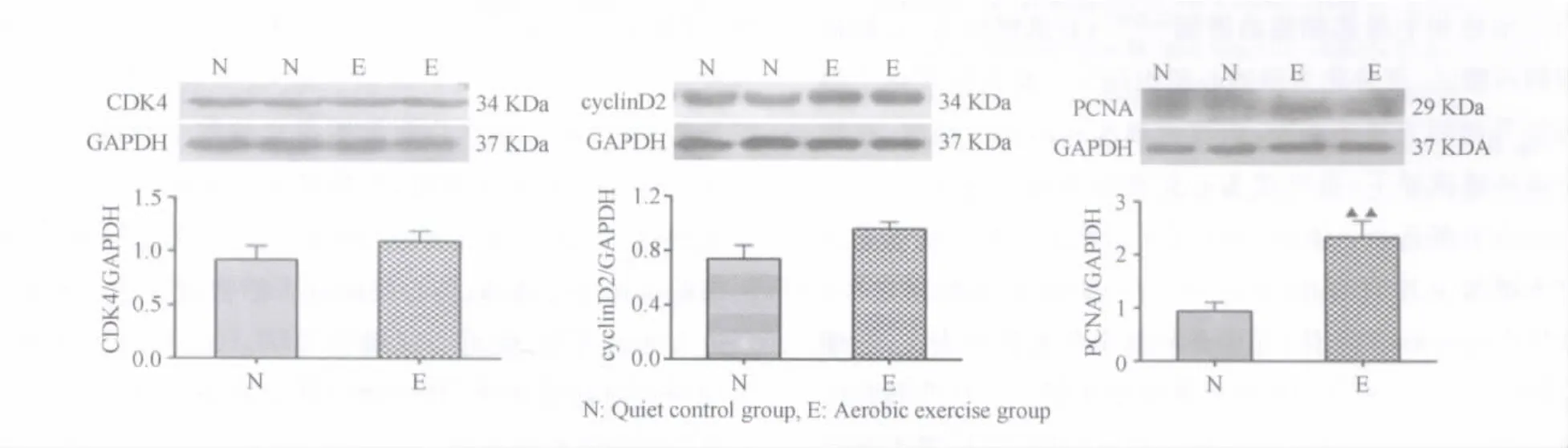
图3 大鼠心肌CyclinD2、CDK4和PCNA蛋白表达图Figure 3. Results of Protein Expression of CyclinD2,CDK4and PCNA in Rat Myocardium
3 分析与讨论
过去研究认为,运动训练对心脏形态结构与功能等会产生良好影响。近年来,关于该方面的讨论重新被关注,内容涉及到运动项目、生活方式、体力活动和营养对心脏形态结构、整体功能和分子机制的研究[6,18,28,41,44]。Pluim BM等通过Meta分析表明,耐力和力量训练运动员心脏结构变化差异显著,而安静状态下的心功能无显著差异[34]。本研究结果证实,8周有氧训练后,大鼠心系数显著增加,HR和LVEDP显著下降,LVSP和±dp/dtmax显著升高,表明有氧训练使心脏发生适应性肥大,提高了左室舒缩功能。
在胚胎及胎儿心肌细胞增殖和终末分化过程中,细胞增殖是心脏增长的主要手段。出生后,心肌细胞的有丝分裂方式由胞质分裂(增殖)转向胞核分裂(终末分化)。Jonker等报道,山羊出生后超过50%的心肌细胞进行着胞核分裂,随着生长发育,单核细胞总数开始下降,双核细胞数量迅速增加[22]。本研究结果表明,有氧运动大鼠双核心肌细胞显著高于安静对照组,表明心肌细胞增殖的胞核分裂显著性增加。文献报道,人的生长过程中心肌细胞会缓慢更新,且随年龄下降;心肌细胞和非心肌细胞存在多次更新[9,24]。心肌细胞能够被NRG1/ErbB4信号诱导激活,发生心肌细胞增殖,促进心肌再生和心功能的改善[10]。细胞周期的激活是细胞增殖的关键。细胞周期的G1期进入与CDKs时相性激活是细胞进行分裂的关键,CyclinD家族是其关键调控蛋白,CyclinD2是细胞由静止期进入细胞周期的重要调控蛋白[12,36,42]。CyclinD2可激活CDK4/6,进而激活下游诱导心肌细胞DNA合成和细胞增殖[15]。小鼠心梗后CyclinD2蛋白过表达,促使心肌再生[33]。由此可见,CyclinD2对心肌细胞周期的激活以及心肌的再生具有重要意义。目前,关于有氧运动对心肌组织CyclinD2及CDK4表达的影响报道少见。本研究结果表明,有氧运动使大鼠心肌CyclinD2和CDK4蛋白表达有升高趋势,说明有氧运动对心肌细胞周期调控蛋白的表达有一定作用。PCNA的表达标志着DNA合成和细胞周期的进程,是细胞增殖的标记蛋白[11,19]。本研究结果显示,PCNA蛋白表达均显著升高,表明有氧运动对心肌细胞周期产生影响。但有氧运动导致的心肌肥大是否包含着心肌细胞数量的增多,即心肌细胞增殖现象,有待实验证实。
随着干细胞技术的发展,研究认为,进入细胞周期的心肌细胞除了心脏本身的功能心肌细胞外,心肌固有干细胞及外周趋化的成体干细胞是其增殖的另一个来源。研究发现,心脏中存在着固有干细胞巢,可表达干细胞表面标记蛋白c-kit、sca-1或MOR-1等,有分化成为心肌细胞、内皮细胞和平滑肌细胞的潜能[5,7,40];心肌损伤后,心肌祖细胞被激活,可分化为新的心肌细胞[4]。而其他成体干细胞如骨髓间充质干细胞、内皮祖细胞和造血干细胞,在特定微环境诱导下,也可成为心肌细胞增殖的来源[21,32,43]。c-kit在骨髓造血干细胞、间充质干细胞和心肌干细胞等多种干细胞上均有表达,是经典的干细胞表面标志之一。SCF作为c-kit的配体,在正常心脏中有基础性表达,在细胞存活、增殖与分化过程中起着重要作用[38]。SCF和其他细胞因子一起,可诱导干细胞或祖细胞的动员、增生和延长其存活期[31]。目前,关于运动促进心肌干细胞的动员、增殖和分化的报道少见。本研究结果表明,有氧运动可使心肌组织c-kit和SCF蛋白表达显著增加。而c-kit+细胞可能是内皮祖细胞或造血干细胞,也可能是心脏固有干细胞,提示有氧运动可提高干细胞的动员能力,促进干细胞数目的增加,为促进细胞增殖与分化提供了细胞来源。
文献报道,运动负荷与心肌细胞凋亡关系密切。过度超负荷与物理牵张和力竭运动刺激均可导致大鼠心肌细胞凋亡显著增加,且随运动负荷的加大细胞凋亡显著上升[1,3,16,17,29],适宜运动负荷可抑制心肌细胞凋亡[25,46]。影响心肌细胞凋亡的因素包括ROS、Ca2+、Cyt C、NO以及神经递质和激素等。研究证实,长期适宜运动可减轻衰老和高血压引起的心肌细胞凋亡[16,26,27];运动通过心肌线粒体途径抵抗缺血再灌注引起的细胞凋亡,对心肌产生保护作用[25,40]。Bax、Bcl-2和p53在心肌细胞凋亡中发挥着重要作用,长期中等强度运动可引起心肌细胞Bcl-2mRNA表达显著增加,抑制心肌细胞凋亡[3];而过度训练参与运动性心肌细胞凋亡的调控过程[1]。p53是缺血缺氧损伤中的关键调控因子,p53蛋白表达上调可促进细胞凋亡的发生[20]。本研究实验证实,有氧运动可使大鼠心肌细胞Bcl-2蛋白表达升高,p53和Bax蛋白表达显著降低,表明有氧运动可抑制心肌细胞凋亡的发生。
机体从发育期开始,细胞凋亡与增殖就是两个紧密相联的过程。心肌细胞凋亡往往代表心功能的适应性改变,细胞凋亡与增殖的动态平衡对稳定心功能具有重要意义。当心功能处于提升阶段时,心肌细胞增殖大于凋亡,当老年心脏的心功能处于下降阶段时,心肌细胞凋亡大于增殖。一般认为,心肌细胞的增殖与凋亡属于共变现象,非因果关系。细胞增殖和凋亡过程通过细胞因子相关联。但近年来发现,Bcl-2和p53表达与心肌细胞增殖关系密切。Bcl-2过表达可引起心肌细胞有丝分裂率显著增加,p53及p53依赖基因下调。推测Bcl-2过表达通过形成Mdm2-p53复合物,下调p53功能,降低心肌细胞CdkI p21水平,促进心肌细胞的增殖[30]。p53磷酸化可诱导调节细胞增殖蛋白的表达,p53释放既引发凋亡也抑制细胞周期G1期进入S期[39]。在有氧运动引起心肌肥大的过程中,存在着细胞凋亡和增殖现象。推测:通过增加抗氧化酶活性,抑制氧自由基诱导的心肌凋亡蛋白的表达,降低心肌线粒体释放活性氧诱导的细胞色素C,抑制心肌细胞凋亡的发生,并增加心肌细胞对细胞凋亡的耐受性;增加循环系统中骨髓干细胞的数量,并提高其迁移能力,促进心肌细胞增殖;促进与心肌细胞增殖相关因子的表达水平,激活细胞增殖信号通路,使心肌固有干细胞或骨髓干细胞重新进入细胞周期,促进心肌细胞增殖。此外,适宜的有氧运动通过对血管再生、侧支循环建立和缺氧状态的改善,包括神经调控和内分泌调节,改善心功能。成体心肌细胞表型虽为终末分化型,但存在着干细胞的瞬息增殖,通过胞浆分裂和胞核分裂等细胞增殖方式实现单核和双核心肌细胞的数量增加和体积增大,瞬时弥补心肌细胞的凋亡导致心肌细胞数量的减少,但如何促进单核心肌细胞数量的增加还需要进一步研究。
截止目前,关于运动性心肌肥大机制研究,主要集中于心肌实质成分与间质成分的形态学、生理学与分子生物学等方面,而对心肌细胞的发育生物学和细胞生物学领域的研究报道尚少;心肌梗死后增加心肌细胞数量是全面改善和治疗该病的根本,目前的干细胞体外诱导分化与移植还存在诸多问题,如不能长期存活,具有排异反应和成瘤性等问题。有文献报道,有氧运动可有效改善心肌梗死心脏心功能[45],但是否通过心肌细胞增殖途径,文献尚少见报道。本研究发现,有氧运动可促进心肌细胞增殖相关因子的表达,诱导心肌细胞的增殖,该结果将为运动性心肌肥大机制研究和运动防治心血管疾病提供实验依据。
4 结论
本研究证实了有氧运动可显著提高大鼠心功能;证实了大鼠心肌细胞存在着增殖现象;有氧运动可抑制促凋亡因子的表达,抑制心肌细胞凋亡;发现有氧运动可促进心肌细胞增殖相关因子的表达,诱导心肌细胞的增殖。有关运动影响心肌细胞增殖与凋亡的分子机制,有待于进一步深入研究。
[1]常芸,袁箭峰,祁永梅,等.运动心脏重塑与微损伤发生中的细胞凋亡现象[J].中国运动医学杂志,2003,22(4):344-349.
[2]田振军,米春娟,张小玲,等.有氧运动对大鼠心肌活细胞核钙转运功能的影响[J].中国应用生理学杂志,2008,24(02):191-195.
[3]张钧,陈晓莺,许豪文.运动对心肌细胞中凋亡调控基因表达影响[J].体育科学,2005,25(8):79-82.
[4]ANGERT D,BERRETTA RM,KUBO H,et al.Repair of the injured adult heart involves new myocytes potentially derived from resident cardiac stem cells[J].Circ Res,2011,108(10):1226-1237.
[5]ANVERSA P,KAJSTURA J,LERI A,et al.Life and Death of Cardiac Stem Cells:A Paradigm Shift in Cardiac Biology[J].Circulation,2006,113(11):1451-1463.
[6]BAGGISH A L,WOOD M J.Athlete's heart and cardiovascular care of the athlete:scientific and clinical update[J].Circulation,2011,123(23):2723-2735.
[7]BELTRAMI A P,BARLUCCH L,TORELLA D,et al.Adult cardiac stem cells are multipotent and support myocardial regeneration[J].Cell,2003,114(6):763-776.
[8]BELTRAMI A P,URBANEK K,KAJSTURA J,et al.Evidence that human cardiac myocytes divide after myocardial infarction[J].N Engl J Med,2001,344(23):1750-1757.
[9]BERGMANN O,BHARDWAJ R D,BERNARD S,et al.Evidence for cardiomyocyte renewal in humans[J].Sci,2009,324(5923):98-102.
[10]BERSELL K,ARAB S,HARING B,et al.Neuregulin1/ErbB4 signaling induces cardiomyocyte proliferation and repair of heart injury[J].Cell,2009,138(2):257-270.
[11]BRAVO R,FRANK R,BLUNDELL P A,et al.Cyclin/PCNA is the auxilliary protein of DNA polymerase-delta[J].Nature,1987,326(6112):515-517.
[12]BRYJA V,PACHERNÍK J,VONDRÁCEK J,et al.Lineage specific composition of cyclin D-CDK4/6-p27complexes reveals distinct functions of CDK4,CDK6and individual D-type cyclins in differentiating cells of embryonic origin[J].Cell Prolif,2008,41(6):875-893.
[13]BUJA L M,VELA D.Cardiomyocyte death and renewal in the normal and diseased heart[J].Cardiovasc Pathol,2008,17(6):349-374.
[14]BU L,JIANG X,MARTIN-PUIG S,et al.Human ISL1heart progenitors generate diverse multipotent cardiovascular cell lineages[J].Nature,2009,460(7251):113-117.
[15]BUSK P K,HINRICHSEN R,BARTKOVA J,et al.CyclinD2 induces proliferation of cardiac myocytes and represses hypertrophy[J].Exp Cell Res,2005,304(1):149-161.
[16]CARRARO U,FRANCESCHI C.Apoptosis of skeletal and cardiac muscles and physical exercise[J].Aging(Milano),1997,9(1-2):19-34.
[17]CHEN T I,SHEN Y J,WANG I C,et al.Short-term exercise provides left ventricular myocardial protection against intermittent hypoxia-induced apoptosis in rats[J].Eur J Appl Physiol,2011,111(8):1939-1950.
[18]GIELEN S,SCHULER G,ADAMS V.Cardiovascular effects of exercise training:molecular mechanisms[J].Circulation,2010,122(12):1221-1238.
[19]GUDE N A,EMMANUEL G,WU W,et al.Activation of Notch-mediated protective signaling in the myocardium[J].Circ Res,2008,102(9):1025-1035.
[20]HAMMOND E M,GIACCIA A J.The role of P53in hypoxiainduced apoptosis[J].Biochem Biophys Res Communi,2005,331(3):718-725.
[21]JACKSON K A,MAJKA S M,WANG H,et al.Regeneration of ischemic cardiac muscle and vascular endothelium by adult stem cells[J].J Clin Invest,2001,107(11):1395-1402.
[22]JONKER S S,ZHANG L,LOUEY S,et al.Myocyte enlargement,differentiation,and proliferation kinetics in the fetal sheep heart[J].J Appl Physiol.2007,102(3):1130-1142.
[23]KAJSTURA J,CHENG W,SARANGARAJAN R,et al.Necrotic and apoptotic myocyte cell death in the aging heart of Fischer 344rats[J].Am J Physiol Heart Circ Physiol,1996,271(3Pt2):H1215-1228.
[24]KAJSTURA J,URBANEK K,PERL S,et al.Cardiomyogenesis in the adult human heart[J].Circ Res,2010,107(2):305-315.
[25]KAVAZIS A N,MCCLUNG J M,HOOD D A,et al.Exercise induces a cardiac mitochon-drial phenotype that resists apoptotic stimuli[J].Am J Physiol Heart Circ Physiol,2008,294(2):H928-H935.
[26]KOLWICZ S C,MACDONNELL S M,RENNA B F,et al.Left ventricular remodeling with exercise in hypertension[J].Am J Physiol Heart Circ Physiol,2009,297(4):H1361-H1368.
[27]KWAK H B,SONG W,LAWLER J M.Exercise training atten-uates age-induced elevation in Bax/Bcl-2ratio,apoptosis,and remodeling in the rat heart[J].FASEB J,2006,20(6):791-793.
[28]LA GERCHE A,PRIOR D L,HEIDBÜCHEL H.Strenuous endurance exercise:is more better for everyone?Our genes won't tell us[J].Br J Sports Med,2011,45(3):162-164.
[29]LERI A,CLAUDIO PP,LI Q,et al.Stretch-mediated release of angiotensin II induces myocyte apoptosis by activating p53that enhances the local renin-angiotensin system and decreases the Bcl-2-to-Bax protein ratio in the cell[J].J Clin Invest,1998,101(7):1326-1342.
[30]LIMANA F,URBANEK K,CHIMENTI S,et al.bcl-2overexpression promotes myocyte proliferation[J].Proc Nat Acad Sci USA,2002,99(9):6257-6262.
[31]MAUCH P,LAMONT C,NEBEN TY,et al.Hematopoitetic stem cells in the blood after stem cell factor and interleukin-11 administration:evidence for different machanisms of mobilization[J].Blood,1995,86(12):4674-4680.
[32]ORLIC D,KAJSTURA J,CHIMENTI S,et al.Mobilized bone marrow cells repair the infarcted heart,improving function and survival[J].Proc Natl Acad Sci USA,2001,98(18):10344-10349.
[33]PASUMARTHI K B,NAKAJIMA H,NAKAJIMA H O,et al.Targeted expression of CyclinD2results in cardiomyocyte DNA synthesis and infarct regression in transgenic mice[J].Circ Res,2005,96(1):110-118.
[34]PLUIM B M,ZWINDERMAN A H,VAN DER LAARSE A,et al.The athlete's heart.A meta-analysis of cardiac structure and function[J].Circulation,2000,101(3):336-344.
[35]PORRELLO E R,MAHMOUD A I,SIMPSON E,et al.Transient regenerative potential of the neonatal mouse heart[J].Sci,2011,331(6020):1078-1080.
[36]SHERR C J.The Pezcoller lecture:cancer cell cycles revisited[J].Cancer Res,2000,60(14):3689-3695.
[37]SMART N,BOLLINI S,DUBÉK N,et al.De novo cardiomyocytes from within the activated adult heart after injury[J].Nature,2011,474(7353):640-644.
[38]SMITH M A,COURT E L,SMITH J G.Stem cell factor:laboratory and clinical aspects[J].Blood Rev,2001,15(4):191-197.
[39]SWYNGHEDAUW B.Are Adult cardiocytes still able to proliferate[J].Arch Mal Coeur,2003,96(12):1225-1230.
[40]URBANEK K,TORELLA D,SHEIKH F,et al.Myocardial regeneration by activation of multipotent cardiac stem cells in ischemic heart failure[J].Proc Natl Acad Sci USA,2005,102(24):8692-8697.
[41]VOLDERS P G.Marathon rat:myocardial remodeling in an animal model of vigorous endurance exercise and implications for humans[J].Circulation,2011,123(1):5-7.
[42]WANG Z,XIE Y,ZHANG L,et al.Migratory localization of CyclinD2-Cdk4complex suggests a spatial regulation of the G1-S transition[J].Cell Struct Funct,2008,33(2):171-183.
[43]WARD M R,STEWART D J,KUTRYK M J.Endothelial progenitor cell therapy for the treatment of coronary disease,acute MI,and pulmonary arterial hypertension:current perspectives[J].Catheter Cardiovasc Interv,2007,70(7):983-998.
[44]WEEKS K L,MCMULLEN J R.The athlete's heart vs.the failing heart:can signaling explain the two distinct outcomes[J].Physiol(Bethesda),2011,26(2):97-105.
[45]XU X,WAN W,POWERS A S,et al.Effects of exercise training on cardiac function and myocardial remodeling in post myocardial infarction rats[J].J Mol Cell Cardiol,2008,44(1):114-122.
[46]ZHANG K R,LIU H T,ZHANG H F,et al.Long-term aerobic exercise protects the heart against ischemia/reperfusion injury via PI3kinase-dependent and Akt-mediated mechanism[J].Apoptosis,2007,12(9):1579-1588.
The Impact of Aerobic Exercise on Cardiomyocyte Proliferation/Apoptosis and Its Mechanism
TIAN Zhen-jun1,CAI Meng-xin1,XING Wei-xin2
Objectives:To discuss the influence of aerobic exercise on cardiomyocyte proliferation/apoptosis and its possible mechanism.Methods:Adult male Sprague-Dawley rats,weight about 180-220g,were assigned to 2groups equally:normal control group and aerobic exercise group.Control group rats had conventional cage life and aerobic exercise group rats made 8-week aerobic exercise.Exercise was initiated at 15m/min,for 20min.The speed and duration were gradually increased to 20m/min and 60min(including the 20min at 15m/min),5°incline for per session.The exercise was performed 5days per week for 8weeks.After 8weeks,to detect the cardiac function,we measured the changes in heart rate,LVSP,LVEDP,±dp/dtmax of the rats;After that,opened the thoracic and picked the heart for histologic section,Masson dyeing;Separated cardiomyocytes and observed by Laser Scanning Confocal Microscope;Stem cell factor(SCF),c-kit,Bax,Bcl-2as well as p53were assessed with immunohistochemistry;CyclinD2,CDK4,PCNA were assessed with Western blot analysis.Results:Compared to normal control group,heart coefficients,LVSP,LV dp/dtmax were all increased(P<0.05)in exercise group rats.HR and LVEDP were all declined(P<0.05).Moreover,aerobic exercise made dual-core cardiomyocytes increase in the rat heart(P<0.05);Furthermore,aerobic exercise made the MOD of c-kit(P<0.01),SCF(P<0.01),Bcl-2(P<0.05)increased significantly and Bax(P<0.05),p53(P<0.01)decreased significantly in the myocardium;With regard to cyclinD2and CDK4,there were no significance(P>0.05).In addition,PCNA(P<0.01)were all increased.Conclusions:This paper confirmed the aerobic exercise could significantly improve cardiac function and the proliferation of myocardial cell;Aerobic exercise can inhibit the apoptosis of cardiomyocyte and found out that aerobic exercise could promote myocardial cell proliferation.The molecular mechanisms of exercise-induced of cardiac cell proliferation and apoptosis need further study.
cardiomyocyte;apoptosis;cellproliferation;aerobicexercise;rat;animalexperiments
G804.2
A
2011-09-02;
2012-02-14
国家自然科学基金项目(31040045,31171141);陕西师范大学“211工程”—运动生物学重点建设学科项目。
田振军(1965-),男,陕西绥德人,教授,博士研究生导师,主要研究方向为运动心血管生物学,Tel:(029)85308092,E-mail:tianzj611@hotmail.com;蔡梦昕(1987-),女,河南商丘人,在读博士研究生,主要研究方向为运动心脏生物学;邢维新(1983-),男,河南周口人,硕士,主要研究方向为运动心脏生物学。
1.陕西师范大学 体育学院 运动与心血管研究室,陕西西安710062;2.丽江师范高等专科学校体育系,云南丽江674100
1.Shaanxi Normal University,Xi’an 710062,China;2.Lijiang Teachers College,Lijiang 674100,China.
1000-677X(2012)03-0060-07
book=61,ebook=82

