端粒酶反义寡聚脱氧核苷酸对子宫内膜癌细胞株的影响
杨蓉娟 许艳蕾 刘雪琴 魏丽莉
·论著·
端粒酶反义寡聚脱氧核苷酸对子宫内膜癌细胞株的影响
杨蓉娟 许艳蕾 刘雪琴 魏丽莉
目的观察端粒酶反义寡聚脱氧核苷酸对癌细子宫内膜癌细胞株的作用。方法用端粒酶反义寡聚脱氧核苷酸与子宫内膜细胞株共同温育一定时间后,观察细胞形态变化,检测细胞Bcl-2蛋白表达情况,测定端粒酶活性。结果端粒酶反义寡聚脱氧核苷酸能诱导子宫内膜癌细胞凋亡,抑制端粒酶活性,在形态学上表现为出现细胞质浓缩,变圆,核染色不均匀,核物质边聚成新月形或块壮;电泳呈凋亡特征性Ladder带;流式细胞仪分析显示,反义寡核苷酸在细胞进入DNA合成期前引起DNA损伤,使细胞停滞在G0~G1期,并诱导细胞凋亡。结论端粒酶反义寡聚脱氧核苷酸能抑制端粒酶活性,诱导子宫内膜癌细胞凋亡,从而抑制子宫内膜癌的增殖。
端粒酶;子宫内膜癌细胞;反义寡聚脱氧核苷酸;凋亡
近年来子宫内膜癌发病率占全世界常见恶性肿瘤的第七位,为女性生殖道恶性肿瘤之一。随着生活方式的改变,发病率在世界范围内呈上升趋势,有研究表明,95%的子宫内膜癌组织的端粒酶阳性[1],端粒酶子宫内膜癌中高表达,而在大多数正常组织中几乎不表达,使其成为治疗肺癌的重要靶点之一。笔者前期的研究证实,端粒酶反义寡核苷酸能够抑制子宫内膜癌细胞生长[2],本文进一步探讨其机制。
1 材料与方法
1.1 HTERT反义寡核苷酸的设计合成 从基因库中查出hTERT反义寡核苷酸的碱基序列,设计出互补于起始密码子区的反义片段,选择起始密码子上游6个碱基及后续的14个碱基,共 20个碱基长度为作用的靶序列的反义寡核苷酸(ASODN)另外合成一段hTERT基因的正义寡核苷酸(SODN)作为对照,每一条链均进行全硫代修饰。由北京赛百盛基因技术有限公司合成,寡核苷酸贮藏于-20℃冰箱中备用,使用时用双蒸水溶解稀释成所需浓度。
1.2 子宫内膜癌细胞株 购于北京医科大学一医院实验室。采用含10%新生牛血清(56℃灭活30 min灭活)、100 U/ml青霉素、100 U/ml链霉素的RPMI-1640培养基,在37℃、5%CO2、95%饱和湿度条件下培养于二氧化碳培养箱,0.25%胰酶消化,每周传代培养2~3次。
1.3 细胞培养与转染 子宫内膜癌细胞株 于10%新生牛血清(56℃灭活30 min灭活)、100 U/ml青霉素、100 U/ml链霉素的RPMI-1640培养基中,在37℃、5%CO2饱和湿度的恒温培养箱中培养。细胞贴壁生长,0.25%胰酶消化,每周传代2~3次,实验所用细胞保持在对数生长,分为反义组,正义组,空白对照组。分别加入含10%新生牛血清RPMI-1640培养液并加入不同浓度的寡核苷酸终浓度分别为5 μmol/L,10 μmol/L,15 μmol/L,每孔设3个复孔。空白对照组加入等量的培养液。24 h更换相应浓度的寡核苷酸1次。
1.4 端粒酶活性 5 μmol/L ASODN-t作用3 d后,胃癌细胞端粒酶活性测定吸光度值A为0.051±0.006,活性明显受到抑制,正义组(0.129±0.018)与空白组(0.142±0.004)活性很高。反义组与正义组、空白组比较,差异有显著统计学意义(P<0.01)。
1.5 Giemsa染色法观察细胞凋亡 取对数生长期细胞消化传代后,活细胞计数调整细胞浓度为0.5×106接种于25 ml培养瓶中,细胞贴壁生长24 h后,弃去上清液,用不含新生小牛血清RPMI-1640培养24 h后,分为反义组,正义组,空白对照组。分别加入含10%新生牛血清RPMI-1640培养液并加入寡核苷酸终浓度5 μmol/L培养48 h。常规胰酶消化细胞,提取细胞,取100 μl于载玻片上自然凉干,滴加磷酸缓冲液稀释的Giemsa染色液,室温放置3~5 min,用自来水冲玻片背面将染料冲净,自然凉干后,树脂封片,再盖以盖玻片。置光学纤维镜下观察摄像。
1.6 DNA ladder测定 取对数生长期细胞消化传代后,调整细胞浓度为0.5×106接种于30 ml培养瓶中常规培养,细胞贴壁生长24 h后,弃其培养液,用不含小牛血清RPMI-1640培养液继续24 h后,弃去培养液,分别加入10%小牛血清RPMI-1640培养液加入5 μmol/L、10 μml/L、15 μml/L不同浓度反义核苷酸和10 μml/L正义苷酸继续培养48 h,并设空白对照组。收集细胞,提取细胞核中的DNA。与1.5%琼脂糖凝胶(内含溴化乙啶)电泳,50V 3 h,置凝胶分析成像系统内观察结果并记录。
1.7 Bcl-2蛋白定量检测 采用间接免疫荧光标记法,去除样品中70%乙醇,用0.01 mmol/L PBS缓冲液洗涤2次,将细胞调整为1×106个/ml,每份样品中加入 鼠抗人单克隆抗体,工作液浓度为1∶100,在37℃度水浴中温浴30 min,然后用PBS缓冲液洗涤2次,弃上清;每份样品中加入二抗即羊抗FITGIG,工作液浓度为1∶100,37℃水浴中温浴30 min,再用PBS缓冲液洗涤2次,弃上清,以去除未结合的多余抗体.上机检测前加入1 ml PBS溶液,经400目筛网过滤,采用FACS-420型流式细胞仪检测Bcl-2蛋白表达情况,每份样品检测1万个细胞,每组共检测3个样本,重复3次。结果分析以荧光指数(fluorescence index,FI)表达相对含量,计算公式为:FI=(样品Bcl-2蛋白表达的平均荧光强度-对照样品平均荧光强度)/对照样品平均荧光强度。
1.8 流式细胞仪分析 取对数生长期细胞消化后,调整细胞浓度为0.5×106接种于25 ml培养瓶,细胞贴壁生长24 h后,弃去培养液用不含新生小牛血清RPMI-1640培养液继续培养24 h后,弃去培养液,分别加入 2.5 μmol/L,5 μmol/L,10 μmol/L不同浓度的寡核苷酸和10%小牛血清RPMI-1640培养液继续培养,每组设3瓶,被检细胞于加寡核苷酸48 h后同时收集反义组,正义组和空白组细胞,用PBS洗涤两遍,70%冷乙醇固定待测。
1.9 凋亡细胞和细胞周期的检测 结果分析:DNA组方图上出现在G0/G1期细胞峰前小于2C DNA含量的小峰,即为凋亡峰。DNA细胞周期则通过BD公司提供的相应的流式细胞分析软件,计算出细胞周期各时相分布百分比,依据细胞时相分布计算出细胞增殖指数,其公式为:PI=[(S+G2M)/(G0+S +G2M)]10。
2 结果
2.1 细胞形态学变化 倒置相差显微镜观察,正义组细胞及不加药组细胞生长良好,贴壁生长,细胞间结构紧密,轮廓清楚,细胞呈梭型,胞浆内颗粒较少,细胞核隐约可见,细胞生长旺盛。而反义组细胞有部分变圆浮起,细胞接触变松,细胞界限模糊,细胞颗粒较多,漂浮细胞数量增加,增殖减慢。经Giemsa染色后显微镜下见正义组与空白组细胞形态饱满,细胞核染色均匀,核仁清晰可见;而反义组细胞中出现细胞质浓缩,变圆,核染色不均匀,核物质边聚成新月形或块壮,未见大量的凋亡小体。说明反义组细胞出现了凋亡的形态学改变。见图1、2。
2.2 DNA Ladder检测 从琼脂糖凝胶电泳可观察到随着hTERT反义寡核苷酸浓度的增加 DNA梯状条带也越来越明显。而正义组与空白组无DNA梯度图形的出现。这是由于细胞凋亡时钙离子内流,激活核酸性内切酶DNA被切割成最小180~200个碱基片段染色质DNA片断绝大部分发生于核小体的连接部位,所形成DNA片断的大小为180~200碱基对的倍数。经电泳形成梯状带。说明hTERT反义寡核苷酸作用的内膜癌细胞引起了凋亡。见图3。
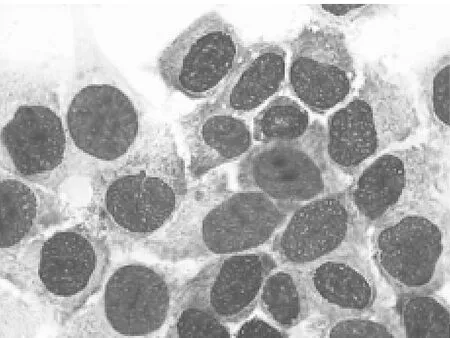
图1 正义寡核苷酸组ishikawa细胞无凋亡细胞存在(Gimusa×400)
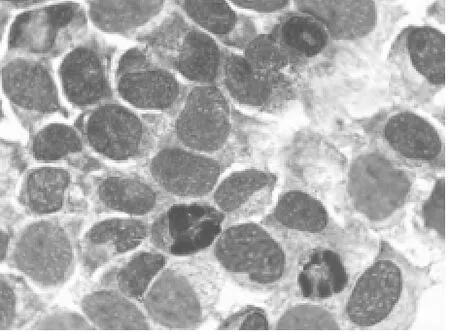
图2 反义核苷酸组ishikawa细胞出现凋亡形态学变化(Gimusa×400)
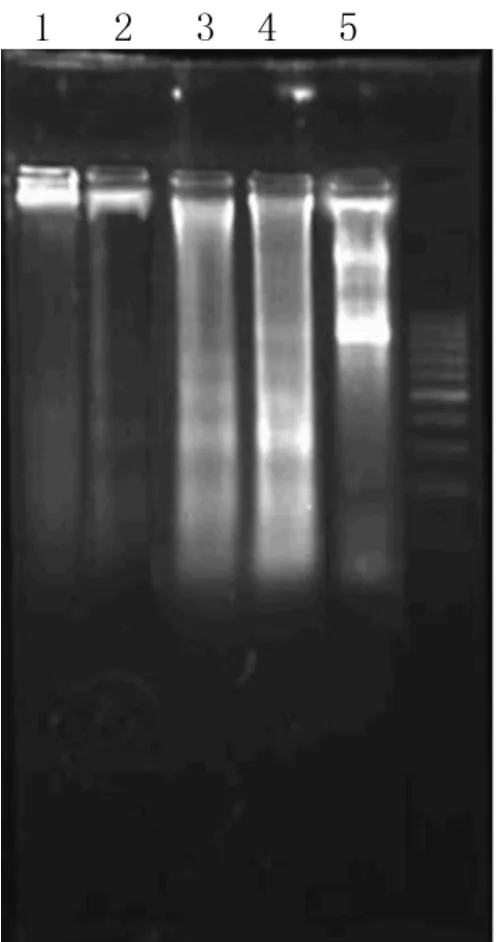
图3 不同浓度反义寡核苷酸与正义组、空白对照组DNA电泳带结果
2.3 流式细胞仪检测细胞Bcl-2蛋白表达情况 在细胞凋亡过程中有多种癌基因和胞内信使参与调节。Bcl-2基因族所起的作用愈来愈受到重视。Bcl-2基因是一种广泛性的抗凋亡基因,可抑制许多因素引起的细胞凋亡,可导致各种癌症的发生。细胞凋亡中DNA的消化需要相关的核酸性内切酶的参与,而bcl-2基因可以阻断Ca2+从内质网释出,使依赖于Ca2+的核酸内切酶活性降低,从而阻断细胞凋亡。
用流式细胞仪检测到不同浓度的反义核苷酸作用于子宫内膜癌细胞48 h后出现了一群亚G1期细胞即凋亡细胞,图中可见到凋亡峰的出现,而正义组与空白组无凋亡改变。随反义核苷酸作用浓度的增加细胞凋亡率越来越高,不同浓度之间差异有统计学意义(P<0.01)。而正义组与空白组差异无统计学意义(P>0.05),进一步用流式细胞仪分析细胞周期发现hTERT反义核苷酸对细胞周期有明显影响,与正义组和空白组相比,反义组细胞G0~G1期细胞增多,S期细胞和G2-M期细胞减少(P<0.01)并呈浓度依赖性,增殖指数在同一作用浓度,反义组与正义组和空白组相比,差异有统计学意义,不同作用浓度,反义组之间比较差异有统计学意义(P<0.01),而正义组与空白组比较差异无统计学意义(P>0.05),说明hTERT反义核苷酸明显抑制子宫内膜癌细胞ishikawa增殖。见图4。
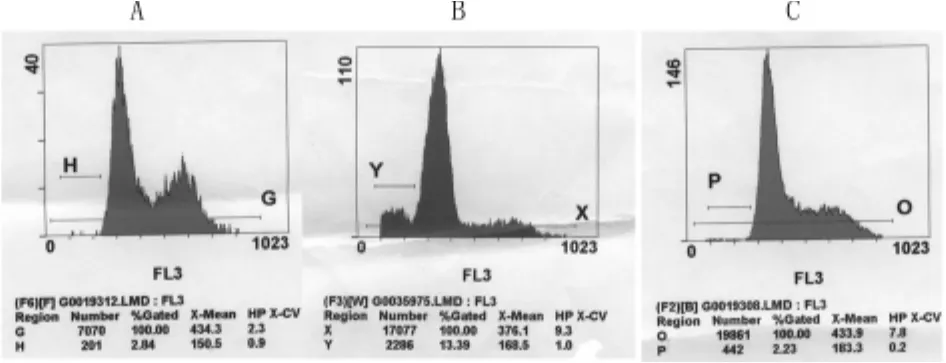
图4 流式细胞仪检测不同浓度反义核苷酸
3 讨论
端粒酶(Telomerase)是一种以自身RNA为模板,将端粒DNA合成至染色体末端的核糖核蛋白复合物 (ribonucleoprotein,RNP)。端粒酶的主要组分为:(1)端粒酶催化亚单位(TERT)。(2)RNA分子或端粒酶RNA(TR),它包含了添加端粒酶重复结构的模板区。人类hTR已被克隆。(3)大量的端粒酶相关蛋白。蛋白质组分鉴定进展缓慢。Sharma等[3]用维甲酸(RA),VitD3,丁酸钠等细胞分化诱导剂诱导细胞分化表明:随着细胞分化程度的增加,端粒酶活性随之降低。人端粒酶催化亚单位(hTERT)是一个最近才被克隆出来的单拷贝基因,其基因组含有逆转录酶催化区域高度保守的特异序列。现已证明hTERTmRNA只在恶性肿瘤组织或肿瘤细胞株以及某些有高度再生潜力的自我更新组织(如子宫内膜)中表达,与端粒酶活性表达一致,对癌病变特异,其上游调节对端粒酶活性表达起重要作用,被认为是端粒酶活性的限速决定因素。反义寡核苷酸的作用机制,目前还未完全明确。ASONs的作用机制与其骨架结构有关:(1)带有负电荷的ODNs与互补mRNA结合后可以激活非特异性核糖核酸酶— RNaseH后者切割RNA DNA杂化双链中mRNA链,抑制其表达。(2)其他不带负电荷的ASONsA通过空间位阻效应发挥作用。应用ASONs抑制特定基因表达时首先要解决寡核苷酸的稳定性问题。因为寡核苷酸在生物学介质中很容易被广泛存在的核酸酶降解。为解决这一问题,许多化学修饰的核苷酸被引入到AS-ONS中,包括磷酸骨架的改变,戊糖的修饰(主要在核糖的2,羟基)等等。例如硫代寡核苷酸(PSODNs)等大大提高了寡核苷酸抗核酸酶降解的能力。PSODN具有良好的水溶性、稳定性及易于大量合成,基本能满足临床治疗的需要。与天然 ODN相比,PSODN通过细胞内吞作用进入细胞内平衡所需时间更长,最终细胞内浓度也更高;其t1/2一般都大于24 h,极大地提高了对核酸酶的耐受能力。本实验就采用了对寡核苷酸的全硫代修饰。
从琼脂糖凝胶电泳可观察到随着hTERT反义寡核苷酸浓度的增加DNA梯状条带也越来越明显。而正义组与空白组无DNA梯度图形的出现。这是由于细胞凋亡时钙离子内流,激活核酸性内切酶DNA被切割成最小180~200个碱基片段染色质DNA片断绝大部分发生于核小体的连接部位,所形成DNA片断的大小为180~200碱基对的倍数。经电泳形成梯状带。说明hTERT反义寡核苷酸作用的内膜癌细胞引起了凋亡。目前,研究凋亡最敏感的方法是流式细胞仪检测。用FCM检测细胞凋亡率与细胞周期发现反义核苷酸作用于内膜癌细胞48 h后可测到凋亡峰,随浓度的增加凋亡率增加最大凋亡率 。细胞凋亡时形成的DNA碱基片段于G1期前形成的亚峰,即凋亡峰。而正义组与空白组未见明显的凋亡峰。细胞周期是细胞生长、分裂时,依次经过G1、S、G2、M期,一分为二,周而复始的过程,称之为细胞分裂周期(cell divide cycle)。根据细胞内DNA含量的变化可将增值周期分为4期。FCM结果表明反义组细胞G0-G1期细胞增多,S期和G2-M期细胞减少,增殖指数也随之减少,并呈浓度依赖性。与正义组和空白组比较差异有统计学意义(P<0.01)。正义组和空白组比较差异无统计学意义(P>0.05)。Zhao等[4]发现,肿瘤细胞被阻滞于S期时其端粒酶活性最高,实验证明hTERT反义寡核苷酸在细胞进入DNA合成期前引起DNA损伤,使细胞停滞在G0~G1期,并诱导细胞凋亡。
在细胞凋亡过程中有多种癌基因和胞内信使参与调节,Bcl-2基因族所起的作用愈来愈受到重视。Bcl-2基因是一种广泛性的抗凋亡基因,可抑制许多因素引起的细胞凋亡,可导致各种癌症的发生。细胞凋亡中DNA的消化需要相关的核酸性内切酶的参与,而Bcl-2基因可以阻断Ca2+从内质网释出,使依赖于Ca2+的核酸内切酶活性降低,从而阻断细胞凋亡。Bermudez[5]的研究显示,端粒酶的激活能够抑制 caspase-3、caspase-8、caspase-9的活性,下调促凋亡蛋白t-BID、BAD、BAX的表达,上调抗凋亡线粒体蛋白bcl-2的表达,从而抑制caspase介导的细胞凋亡。端粒酶活性与细胞增殖有关,因此,端粒酶抑制剂抑制了细胞端粒酶活性,自然也使其增殖受到抑制。本实验结果也证实,端粒酶反义寡聚脱氧核苷酸抑制端粒酶活性,同时也抑制了细胞增殖。
Shammas等[6]的研究显示,针对端粒酶RNA的反义寡核苷酸GRN163L能够抑制骨髓细胞的端粒酶活性,并引起细胞凋亡。另有研究结果表明,端粒酶活性与细胞增殖有关,因此,端粒酶抑制剂抑制了细胞端粒酶活性,自然也使其增殖受到抑制[7]。本实验结果也证实,端粒酶反义寡聚脱氧核苷酸抑制端粒酶活性,同时也抑制了细胞增殖。本实验表明反义寡核苷酸能诱导子宫内膜癌细胞凋亡,抑制端粒酶活性,抑制端粒酶合成端粒,从而抑制胃癌细胞的生长,说明端粒酶反义寡聚脱氧核苷酸能有效地抑制肿瘤细胞的生长,为抗端粒酶的肿瘤基因治疗提供了实验基础。绝大多数正常体细胞缺乏端粒酶活性,应用此药物,可避免治疗的不良反应,增强治疗的特异性。今后应进一步探索抗端粒酶药物的作用机制,使高效抑制剂早日用于临床。
1 王红军,于洪涛,陈琼.端粒酶RNA的反义寡核苷酸抑制裸鼠移植瘤生长的研究.中国肺癌杂志,2008,11:198-201.
2 曾益新主编.肿瘤学.第1版.北京:人民卫生出版社,2001.242.
3 Walton SP,Stephanopoulos GN,Yarmush ML,et al.Thermodynamic and kinetic-characterization of oligodexynucleotide binding to a structured mRNA.J Biophys,2002,82:366-377.
4 Zhao YM,Li JY,Lan JP,et al.Cell cycle dependent te-lomere regulation by telomerase in human bone marrow mesenchymal stem cells.Biochem Biophys Res Commun,2008,369:1114-1119.
5 Bermudez Y,Grasso D,John NC,et al.Telomerase con-fers resistance to caspase-mediated apoptosis.Clin Inter Aging,2006,1:155-167.
6 Shammas MA,Koley H,Bertheau RC,et al.Telomerase inhibitor GRN163L inhibits myeloma cell growth in vitro and invivo.Leukemia,2008,22:1410-1418.
7 Chen Z,Koeneman KS,Corey DR.Consequences of telomerase in-hibition and combination treatments for the proliferation of cancer cells.Cancer Res,2005,63:5917-5925.
Effect of telomerase antisense oligodeoxynucleotide on endometrial carcinoma cell strain
YANG Rongjuan,XU Yanlei,LIU Xueqin,et al.The Fourth Hospital of Shijiazhuang City,Shijiazhuang050011,China
ObjectiveTo observe the effect of telomerase antisense oligodeoxynucleotide on endometrial carcinoma cell strain.MethodsAfter endometrial carcinoma cell strain was incubated with telomerase antisense oligodeoxynucleotide for a certain time,the changes of cell morphous were observed,and the expression levels of bcl-2 protein and telomerase's activity were detected.ResultsTelomerase antisense oligodeoxynucleotide could induce the apoptosis of endometrial carcinoma cells and could inhibit telomerase activity.The observation for cell morphous showed that cells became round shape,cytoplasm was condensed,without uniform nuclear staining,with crescent or lump form nuclear matter as well as the apoptosis characteristic Ladder bands showed by electrophoresis.Flow cytometry analysis revealed that antisense oligodeoxynucleotide could cause DNA damage before the cells were differentiated into DNA synthesis period,as a result,which resulted in the stagnation of cells at G0-G1 phase,and induced cell apoptosis.ConclusionTelomerase antisense oligodeoxynucleotide can inhibit telomerase's activity and can induce the apoptosis of endometrial carcinoma cell,as a result,which can inhibit the proliferation of endometrial carcinoma cell.
telomerase;endometrial carcinoma cells;antisense oligodeoxynucleotide;apoptosis
R 711.7
A
1002-7386(2012)17-2576-04
10.3969/j.issn.1002-7386.2012.17.006
050011 河北省石家庄市第四医院
2012-02-01)

