一种简易稳定的乳小鼠脑微血管内皮细胞原代培养方法
熊永洁, 尹 波, 甘 莉, 王 倩, 张苏明
华中科技大学同济医学院附属同济医院神经内科,武汉 430030
脑微血管内皮细胞(cerebral microvascular endothelial cells,CMECs)是血脑屏障的重要组成部分,在血管神经单元(neurovascular unit,NVU)的各成分中,是实现血脑屏障功能的执行者,并参与了功能的调节[1]。在对血脑屏障功能的研究中,尤其是在对血管神经单元的其他成分与CMECs相互作用从而发挥对血脑屏障功能调节作用[2]的研究中,CMECs是必不可少的研究材料。目前用于研究的微血管内皮细胞主要分为细胞系和原代培养两种,但对于CMECs的研究而言,来源于原代培养者更接近体内性质,因而更具有研究价值。然而,其在培养方法上一直存在操作复杂、易受杂细胞污染等许多问题[3],高纯度、高产量地从小型动物中分离培养获得CMECs仍面临许多困难。
本实验采用两次酶消化法及梯度离心法从C57乳小鼠脑皮质分离获得CMECs,得到了较高纯度和产量的CMECs,为CMECs原代培养技术的改进及进一步研究CMECs的功能作用等提供了参考与方法。
1 材料与方法
1.1 实验动物
每次实验使用8~10只1~3d的C57乳小鼠,由本实验室所饲养的C57小鼠合笼后获得。C57小鼠购自华中科技大学同济医学院实验动物学部,在SPF级动物房中饲养。
1.2 试剂
DMEM 培养液(Hyclone公司)、Ⅱ型胶原酶(Sigma公司)、胶原酶/分散酶(Roche 公司)、牛血清白蛋白(BSA,Sigma 公司)、DNA 酶Ⅰ(DNaseⅠ,Sigma公司)、胎牛血清(FBS,Hyclone公司)、内皮细胞生长因子添加物(ECGS,Sciencell公司)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT,Amersco公司)、兔抗人Ⅷ因子抗体(Santa公司)、兔抗小鼠GFAP抗体(Santa公司)、FITC-羊抗兔IgG(北京博奥森生物技术有限公司)、4%多聚甲醛(武汉博士德生物工程有限公司)、4,6-二脒基-2-苯基吲哚(DAPI,Clabiochem 公司)、青-链霉素(北京索莱宝生物科技有限公司)。
1.3 CMECs的原代培养
将C57乳小鼠置于75%乙醇消毒5min,取出小鼠,置于盛有冷PBS的培养皿中,用眼科镊和眼科剪无菌操作取出全脑,置于另一盛有冷PBS的培养皿中,去除嗅球、小脑、间脑(包括海马)后,将大脑反置于无菌滤纸上,去除脑白质,然后将剩余灰质在滤纸上轻轻滚动,仔细去除软脑膜及大血管。将经上述处理过的组织移至装有DMEM 培养液的EP管中,剪成1mm3大小,吹匀,转至15mL 离心管,离心(1 000r/min,5min)后弃上清。加入0.1%Ⅱ型胶原酶(用DMEM 培养液配置,内加30 U/mL的DNaseⅠ),37℃振荡消化1.5h,离心(1 000r/min,8min)后弃上清。加入20%BSA(PBS 配置)悬浮混匀,4℃离心(4 000r/min,20min),弃上层漂浮的组织及液体。底部沉淀加入0.1%胶原酶/分散酶37℃振荡消化30 min,离心(1 000r/min,5 min)弃上清,底部在红细胞层上方的黄白色沉淀即为纯化的微血管段。用PBS漂洗2遍后(1 000r/min,5min)用CMECs完全培养液重悬(DMEM 基础培养液、20%FBS、100 U/mL 青-链霉素、1%ECGS),接种于培养瓶,置37℃,5%CO2培养箱内。24h后换液,以后2~3d换1次液,完全融合后即可按一般方法传代。
1.4 倒置相差显微镜观察细胞
于接种后每天在倒置相差显微镜下观察细胞的贴壁、形态及生长状况,并拍照记录。
1.5 MTT检测细胞增殖
取传至3代的CMECs接种于24孔板,细胞密度调整至103/mL,每孔培养液定量至500μL,每隔24h选3 孔细胞加入50μL MTT(5 mg/mL),置37℃,5%CO2培养箱内继续孵育4h后终止培养。取出小心吸弃孔内培养上清液,加入375μL DMSO,振荡10 min 后取200μL 液体至96 孔板,测490nm 处吸光度值。7d后将获得的全部数据以时间为横坐标,吸光度值为纵坐标绘制生长曲线图。
1.6 特异性免疫荧光化学鉴定
取传至3代的CMECs接种于6孔板中,贴壁24h后取出,0.1%PBS小心清洗后用4%多聚甲醛固定10 min,0.1%PBS冲洗5 min×3,1%Triton 100破膜10min,0.1%PBS冲洗5min×3,山羊血清封闭20min,加入兔抗人Ⅷ因子抗体或兔抗小鼠GFAP抗体(1∶50),4℃湿盒孵育过夜,0.1%PBS冲洗3遍后加入FITC-羊抗兔IgG(1∶200),室温避光孵育1h,0.1%PBS冲洗5min×3,DAPI(1∶1 000)染核明确活细胞后荧光显微镜下观察。
1.7 透射电镜观察细胞
取传至3代的CMECs接种于载玻片上,培养形成单层细胞后吸去培养液,PBS 小心清洗后用4%多聚甲醛固定1h,然后PBS漂洗,再用1%四氧化锇固定15~30 min,系列乙醇逐级脱水后EPON812包埋剂包埋,经超薄切片机切片并铀染色后在透射电镜下观察。
2 结果
2.1 光镜下细胞形态
原代接种培养24h后,光镜下可观察到零散分布的少量贴壁细胞,细胞呈多角形或短梭形,并岛屿样聚集。此外还可见一些漂浮的细胞碎片及杂细胞,随后的换液及传代培养可去除细胞碎片及杂细胞(图1A)。培养3~5d后,可见之前岛屿样聚集的细胞集落增大,集落内细胞排列呈“漩涡状”,并有相互融合的趋势(图1B)。培养6~8d后,各细胞集落之间也开始融合,并形成单层,原集落中心的细胞相互紧密连接,形成“铺路石”样排列(图1C)。
2.2 细胞生长曲线
取对数生长期的CMECs,采用MTT 法检测细胞增殖,并绘制生长曲线。生长曲线如图2,曲线呈现对数生长期细胞应有的“S”形,其形态符合CMECs的生长规律。
2.3 细胞Ⅷ因子相关抗原检测鉴定
使用免疫荧光组织化学法检测所获得细胞上CMECs特异性的Ⅷ因子相关抗原及GFAP相关抗原,Ⅷ因子相关抗原检测呈阳性(图3),GFAP相关抗原检测呈阴性(结果未展示),表明所获得细胞上具有CMECs的Ⅷ因子特异性标记物。取3次独立的原代培养所获得的系列细胞进行上述荧光检验,每次检验取10个独立视野进行阳性细胞计数,最后计算获得所培养的CMECsⅧ因子相关抗原阳性率达95.5%,而GFAP阳性率则低于1%。
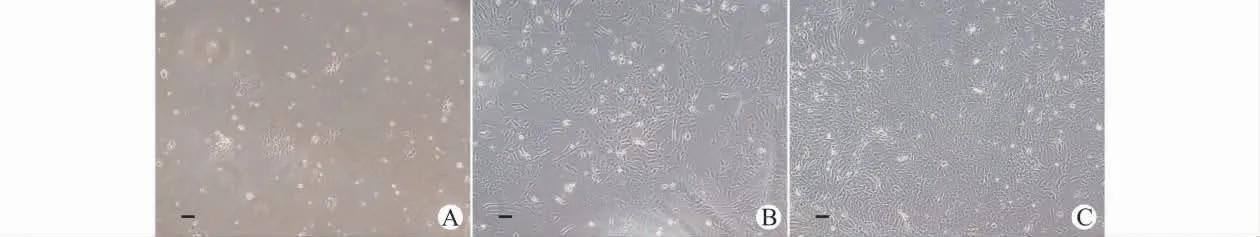
图1 倒置相差显微镜下观察细胞形态Fig.1 The cell morphology under the inverted phase contrast microscopy
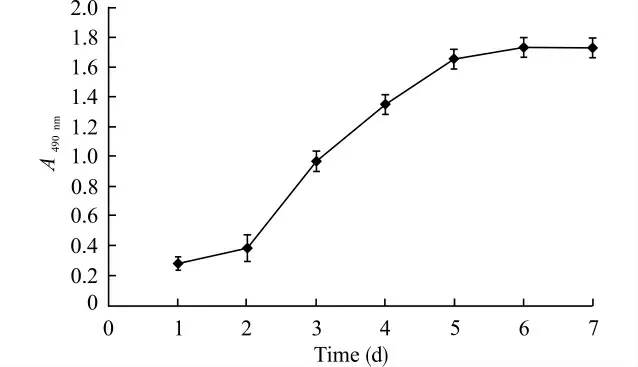
图2 MTT 法测定脑微血管内皮细胞的生长曲线Fig.2 Growth curve of cerebral microvascular endothelial cells determined by MTT assay

图3 脑微血管内皮细胞的Ⅷ因子相关抗原免疫荧光染色Fig.3 Immunofluorescence of cerebral microvascular endothelial cells by anti-factorⅧ
2.4 电镜下细胞形态
取融合成单层的CMECs进行电镜观察,可观察到相邻细胞间存在紧密连接(图4)。
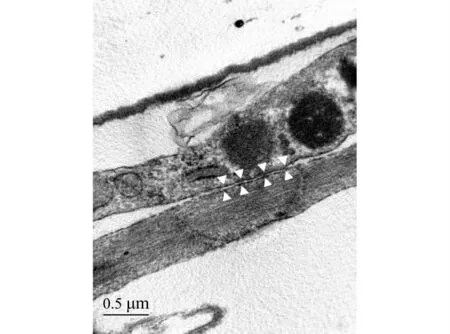
图4 脑微血管内皮细胞的透射电镜图Fig.4 TEM diagram of the cerebral microvascular endothelial cells
3 讨论
目前,微血管内皮细胞以其有别于其他内皮细胞的性质正成为研究热点,而获得细胞的方法则主要分为细胞系和原代培养两种。细胞系是通过对微血管内皮细胞转导一些永生化的基因而获得的,在使用中具有操作简单、增殖快的优点,但是与体内的微血管内皮细胞相比,由于其分化程度较低,故而缺少屏障特性[4],此外由于导入了外源基因,也表现出复杂的核型改变[5],从而限制了其在研究中的使用范围。而与外周微血管内皮细胞相比,CMECs更具有以下特殊的性质:①更紧密的细胞间连接,是周围毛细血管内皮细胞之间连接紧密程度的50~100倍,形成这一特殊性质的亚细胞结构主要是CMECs间的紧密连接(tight junction,TJ),其对旁细胞通路严格限制,从而阻止了亲水性物质的渗透[6]。②带有负电荷的内皮表面,阻止了负电荷物质通过血脑屏障。③低胞饮作用。CMECs具有统一的胞质厚度,胞质内少见囊泡,且无内皮窗孔,基膜连续,从而大大减少了跨细胞运输[7]。④含有更多的线粒体,为血脑屏障通透性的高度选择性提供了能量保障[8]。这些特殊性质正是血脑屏障维持中枢神经系统稳态的基础,因而使用细胞系培养方法所获得的微血管内皮细胞并不能完全代表CMECs的真实性质,用其来研究血脑屏障的功能显然是不全面的,故而原代培养的CMECs是必不可少的研究材料[9]。
本实验通过探索各种不同的分离和培养方法[3,10-12],最终获得了一种步骤较为简易,且费用较为经济的CMECs原代培养方法。与以往的原代培养多使用SD 大鼠的方法不同,本实验中使用了C57小鼠。SD 大鼠属于远交群,其个体之间在遗传基因方面差异性较大,而C57 小鼠属于近交系,具有更均一的遗传基因,因而所获得的CMECs均一性更好,利于减少应用其进行后续实验的混杂因素。小鼠与大鼠相比,由于大脑较小会带来操作困难,混杂细胞增多等问题,这也是以往培养多采用大鼠的原因,然而近交系大鼠价格较高,会带来实验经费增多的问题。我们在实验中发现,在所有原代操作步骤中最需要注意的步骤为脑膜的剥离,脑膜剥离越彻底,最后获得细胞纯度越高,但也需注意控制整个操作的时间,因操作时间越久,组织活性越低。经过多次实践练习的熟练操作者一般在2h内可完成组织分离及脑膜剥离的操作,最终获得较高纯度的CMECs并具有很高的重复性。在实验方法上,使用20%牛血清白蛋白替代Percoll试剂来分离微血管段[13],不仅便于试剂的准备,也更为经济。我们实验室所获得的CMECs平均阳性率达95.5%,不低于甚至高于以往文献报道的阳性率[10-12]。
CMECs主要应用于双细胞、乃至三细胞共培养体系构建血脑屏障的研究中,随着对血脑屏障认识的加深,尤其是血管神经单元概念的强化,对于所使用的CMECs细胞材料的要求也越高,因而需要不断寻求更接近体内性质CMECs的获得方法。此外,目前许多研究也发现,CMECs参与了许多中枢神经系统疾病的进程,如:阿尔茨海默病、帕金森病等,而并非以往认识的是这些疾病损伤的后期事件;而对体内神经干细胞微环境的研究也证实CMECs是其重要组成部分,CMECs具有维持神经干细胞增殖并调节其分化方向的性质。这些新的认识拓展了CMECs的实验应用范围,也给CMECs原代培养方法的进一步改进提供了新的契机和挑战。
[1] Choi Y K,Kim K W.Blood-neural barrier:its diversity and coordinated cell-to-cell communication[J].BMB Rep,2008,41(5):345-352.
[2] Kaur C,Ling E A.Blood brain barrier in hypoxic-ischemic conditions[J].Curr Neurovasc Res,2008,5(1):71-81.
[3] Calabria A R,Weidenfeller C,Jones A R,et al.Puromycin-purified rat brain microvascular endothelial cell cultures exhibit improved barrier properties in response to glucocorticoid induction[J].J Neurochem,2006,97(4):922-933.
[4] Cardoso F L,Brites D,Brito M A.Looking at the blood-brain barrier:molecular anatomy and possible investigation approaches[J].Brain Res Rev,2010,64(2):328-363.
[5] Mkrtchyan H,Scheler S,Klein I,et al.Molecular cytogenetic characterization of the human cerebral microvessel endothelial cell line hCMEC/D3[J].Cytogenet Genome Res,2009,126(4):313-317.
[6] Abbott N J,Rnnbck L,Hansson E.Astrocyte-endothelial interactions at the blood-brain barrier[J].Nat Rev Neurosci,2006,7(1):41-53.
[7] de Boer A G,Gaillard P J.Blood-brain barrier dysfunction and recovery[J].J Neural Transm,2006,113(4):455-462.
[8] Persidsky Y,Ramirez S H,Haorah J,et al.Blood-brain barrier:structural components and function under physiologic and pathologic conditions[J].J Neuroimmune Pharmacol,2006,1(3):223-236.
[9] 冯新民,何世银,樊红,等.聚花过路黄对原代大鼠脑微血管内皮细胞糖-氧剥夺诱导下NF-κB p65 蛋白及下游靶基因ICAM-1表达的影响[J].华中科技大学学报:医学版,2010,39(1):73-77.
[10] 王义宝,刘云会,刘丽波,等.大鼠脑微血管内皮细胞的原代培养及其生物学行为初步探讨[J].神经解剖学杂志,2006,22(2):224-228.
[11] 刘恺鸣,迟路湘,鲁向辉,等.大鼠脑微血管内皮细胞的原代培养[J].第三军医大学学报,2007,29(20):2011-2013.
[12] 梁朝峰,郭英,石德金,等.大鼠脑皮质微血管内皮细胞的分离和培养[J].中国病理生理杂志,2008,24(5):1038-1040.
[13] 朱玉珍,武文,田野苹,等.小鼠脑微血管内皮细胞的原代培养与纯化[J].解剖学杂志,2007,30(5):530-533.

