右美托咪啶对神经病理性疼痛大鼠脊髓p38丝裂原活化蛋白激酶和脑源性神经营养因子表达的影响
李 娟 , 冷玉芳, 韩雪娜, 王一涵
兰州大学第一医院麻醉科,兰州 730000
神经损伤可激活脊髓背角小胶质细胞,通过p38丝裂原活化蛋白激酶(p38MAPK)途径,合成和释放脑源性神经营养因子(BDNF),BDNF 可增加神经病理性疼痛的痛觉过敏,促进疼痛的发展[1-2]。右美托咪啶是高选择性的α2肾上腺素受体激动剂,具有镇静、镇痛、抑制交感活性等作用,右美托咪啶作用机制十分复杂,存在多条镇痛作用途径,脊髓是其主要镇痛部位[3]。本实验旨在观察右美托咪啶对神经病理性疼痛大鼠的镇痛作用是否通过抑制p38MAPK 信号通路下调BDNF的表达而产生。
1 材料与方法
1.1 试剂与仪器
右美托咪啶(批号:10122234,江苏恒瑞医药股份有限公司);水合氯醛(国药集团试剂有限公司);PL-200热刺痛仪(成都泰盟科技有限公司);Trizol试剂盒(北京中杉金桥生物技术有限公司);DK-S26型电热恒温水浴锅(上海三发科学仪器有限公司);TGL-16M 型低温高速离心机(长沙平凡仪器仪表有限公司);DTC-3Gplus型PCR 仪(西安天隆科技有限公司);DYY-8C 型电泳仪(北京六一仪器厂);LG2000型凝胶成像分析系统(杭州朗基科学仪器有限公司)。
1.2 动物选择及分组
雄性成年SD 大鼠72 只,体重180~220g,由兰州大学基础医学院实验动物中心提供,随机分为假手术组(S组)、CCI组(C 组)和右美托咪啶组(D组),每组24只。S组大鼠仅分离坐骨神经不结扎,C组和D 组结扎坐骨神经建立CCI模型。D 组于术后即刻开始至取材时点每天腹腔注射右美托咪啶50μg/kg,S组和C 组注射相同体积的生理盐水。动物饲养环境安静,通风良好,室温维持20~25℃,12h/12h光/暗循环,自由摄食和饮水。
1.3 CCI模型的建立
参照Bennett等[4]的方法制备大鼠CCI模型,10%水合氯醛350 mg/kg腹腔注射麻醉大鼠并固定,剪毛消毒后切开大鼠右下肢股骨中段皮肤,钝性分离肌肉,暴露坐骨神经,用4-0丝线松扎4道,间隔约l mm,结扎强度以引起小腿肌肉轻度颤动为宜,伤口局部敷适量青霉素粉,逐层缝合切口,术毕常规笼养。
1.4 行为学观察
术后2周内,每日观察1次大鼠的体位步态和术侧后肢的姿势、肌张力、持重情况,及是否出现舔咬肢体的现象。
1.5 测定大鼠机械痛阈和热痛阈
每组大鼠分别于术前l d,术后第1、3、7、14d测定大鼠机械痛阈和热痛阈。
1.5.1 机械痛阈检测 参照文献[5]的方法测定。von Frey 纤维丝的压力值为0.41、0.52、0.87、1.16、2.05、3.61、5.50、8.28、10.33和16.73g,每次至少间隔30s。初始刺激强度2.05g,每只大鼠测定3次,间隔5min,取其平均值。
1.5.2 热痛阈检测 参照文献[6]的方法采用PL-200热刺痛仪检测。将大鼠置于3mm 厚的玻璃板上,热辐射光源照右后肢足底中部,记录从照射到出现缩足反应的时间,以此反映热痛阈。连续测定3次,间隔5min,单次照射时间不超过20s,取其平均值。
1.6 p38MAPK 和BDNF mRNA检测
于术后第1、3、7、14d测定痛阈后每组随机取6只大鼠断头处死,取脊髓L4-6节段,取出的样品立即放入液氮里保存,随后采用RT-PCR 法检测p38MAPK 和BDNF mRNA 的表达水平。引物合成:p38MAPK、BDNF和GAPDH 基因引物序列均由Primer premier 5.0软件自行设计,由华大基因公司合成。p38MAPK:上游序列5′-TCCAAGGGCTACACCAAATC-3′,下游序列5′-TGTTCCAGGTAAGGGTGAGC-3′,扩增产物长度341bp;BDNF:上游序列5′-GGTCACAGCGGCAGATAAAAAG-3′,下游序列5′-TTCGGCATTGCGAGTTCCAG-3′,扩增产物长度188bp;GAPDH:上游序列5′-ACCACCATGGAGAAGGCTGG-3′,下游序列5′-GGTTTCTTACTCCTTGGAGG-3′,扩增产物长度698bp。将冻存的脊髓标本取出,加入RNA保护液碾磨后抽提总RNA,取10μL 总RNA 作为模板,配成20μL逆转录体系合成cDNA,再取cDNA 1μL、dNTP 1μL、Taq DNA 聚合酶1μL、引物1μL、10×Buffer 5μL 和无菌去离子水配成50μL PCR 反应体系,分别PCR 扩增各组大鼠脊髓p38MAPK、BDNF和GAPDH DNA。PCR 反应条件为:94℃预变性5 min,94℃变性30s,55℃退火30s,72℃延伸60s,循环36次。以1%琼脂糖凝胶电泳检测PCR 扩增产物,用凝胶成像分析系统,对RT-PCR 产物电泳条带进行吸光度(A)值分析,分别以p38MAPK/GADPH、BDNF/GADPH 的比值半定量反映p38MAPK 和BDNF mRNA 在脊髓的表达水平。
1.7 统计学方法
2 结果
2.1 动物模型行为表现
实验期间,所有大鼠均无明显伤口感染现象。S组大鼠活动如常,C 组和D 组大鼠术后均出现跛行、舔爪,结扎侧足轻度外翻,且有时出现悬空等后肢保护现象。与C 组比较,D 组术后第3天起上述症状逐渐减轻,第14 天时D 组大鼠后肢活动基本恢复正常。D 组大鼠在腹腔注射右美托咪啶后存在轻微的嗜睡现象,同时自主活动减少,但仍可被轻易唤醒,唤醒后可站立。
2.2 机械痛阈和热痛阈
各组大鼠术前和S组大鼠痛阈差异无统计学意义。与术前及S组比较,C 组大鼠机械痛阈和热痛阈于术后1、3、7、14d明显下降,D 组大鼠于术后3、7、14d明显下降(P<0.05);与C组比较,D 组大鼠机械痛阈和热痛阈于术后3、7、14d明显升高(P<0.05);与术后1d比较,C 组、D 组大鼠机械痛阈和热痛阈于术后3、7、14d显著降低,于术后第7天降至最低(P<0.05)。见表1。
表1 3组大鼠不同时间点机械痛阈和热痛阈的比较(n=6,±s)Table 1 Comparison of mechanical and thermal pain threshold of rats at different time points in each group(n=6,±s)
aP<0.05 vs.group S;b P<0.05 vs.group C.Comparison in the same group before and after operation:c P<0.05 vs.preoperation;d P<0.05 vs.1dafter operation;e P<0.05 vs.3dafter operation;f P<0.05 vs.7dafter operation
Category Groups PreoperationPostop eration 1d3d7d14d Mechanical pain Group S 14.17±1.34 13.92±1.32 13.77±1.30 13.60±1.50 14.13±1.42 threshold(g)Group C 14.12±1.14 11.83±1.68ac 8.73±1.74acd 4.65±1.81acde 6.90±1.58acdef Group D 13.95±1.03 12.30±1.47c 10.65±1.47abcd 6.73±1.61abcde 8.92±1.50abcdef Thermal pain Group S 17.19±0.76 17.00±1.03 16.92±0.94 16.85±1.22 17.10±1.02 threshold(s)Group C 17.11±0.85 15.52±1.15ac 10.82±0.98acd 6.10±1.41acde 8.95±1.11acdef Group D 17.23±1.01 16.32±1.12c 12.66±1.04abcd 8.22±1.07abcde 10.58±1.09 abcdef
2.3 p38MAPK 和BDNF mRNA表达
RT-PCR 产物电泳条带显示了p38MAPK 和BDNF mRNA 在脊髓的表达(图1、2)。与S组比较,C组大鼠p38MAPK 和BDNF mRNA 于术后1、3、7、14d显著升高,D 组大鼠于术后3、7、14d明显升高(P<0.05);与C组比较,D组大鼠p38MAPK 和BDNF mRNA于术后3、7、14d显著降低(P<0.05);与术后1d比较,C 组、D 组大鼠p38MAPK 和BDNF mRNA 于术后3、7、14d显著升高,于术后第7天升到最高(P<0.05)。见表2。对p38MAPK 和BDNF mRNA 的表达进行相关性分析,Pearson相关系数为0.901,P<0.05,表明p38MAPK mRNA 和BDNF mRNA 表达呈正相关,即BDNF mRNA 表达随p38MAPK mRNA表达的增加而增加。

图1 RT-PCR法检测脊髓p38MAPK mRNA 的表达Fig.1 The p38MAPK mRNA expression in the spinal cord detected by RT-PCR

图2 RT-PCR法检测脊髓BDNF mRNA 的表达Fig.2 The BDNF mRNA expression in the spinal cord detected by RT-PCR
表2 3组大鼠不同时间点脊髓p38MAPK 和BDNF mRNA 表达的比较(n=6,±s)Table 2 Comparison of p38MAPK and BDNF mRNA of rats at different time points in each group(n=6,±s)
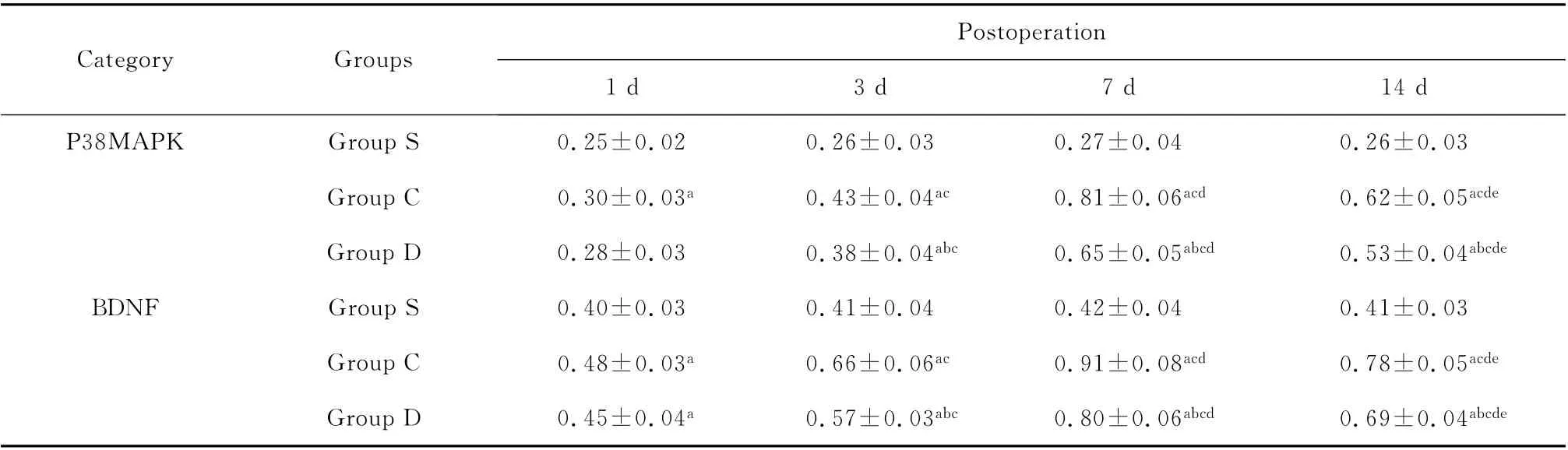
表2 3组大鼠不同时间点脊髓p38MAPK 和BDNF mRNA 表达的比较(n=6,±s)Table 2 Comparison of p38MAPK and BDNF mRNA of rats at different time points in each group(n=6,±s)
aP<0.05 vs.group S;b P<0.05 vs.group C.Comparison in the same groups:c P<0.05 vs.1dafter operation;d P<0.05 vs.3dafter operation;e P<0.05 vs.7dafter operation
Postop eration Category Groups 1d3d7d14d P38MAPK Group S 0.25±0.02 0.26±0.03 0.27±0.04 0.26±0.03 Group C 0.30±0.03a0.43±0.04ac 0.81±0.06acd 0.62±0.05acde Group D 0.28±0.03 0.38±0.04abc 0.65±0.05abcd 0.53±0.04abcde BDNF Group S 0.40±0.03 0.41±0.04 0.42±0.04 0.41±0.03 Group C 0.48±0.03a0.66±0.06ac 0.91±0.08acd 0.78±0.05acde Group D 0.45±0.04a0.57±0.03abc 0.80±0.06abcd 0.69±0.04 abcde
3 讨论
实验中C组和D 组大鼠CCI术后均出现跛行、舔爪、足轻度外翻等痛行为学表现,机械痛阈和热痛阈从术后1d至术后14d均明显降低,说明大鼠神经病理性疼痛模型制备成功。参照文献[7]及预实验,本实验选择右美托咪啶注射剂量为50μg/kg,D组大鼠在腹腔注射右美托咪啶50μg/kg后1h内有轻微嗜睡现象,但可轻易唤醒,唤醒后仍可站立。
本实验结果显示,与S 组比较,C 组大鼠p38MAPK 和BDNF mRNA 的表达明显升高,并且p38MAPK 和BDNF mRNA 表达的变化与机械痛阈和热痛阈的变化在时间上相一致,表明p38MAPK 和BDNF mRNA 参与了神经病理性疼痛的发生和发展。近年来的研究发现小胶质细胞在神经病理性疼痛发生过程中发挥着重要的作用,激活的小胶质细胞可释放多种疼痛递质造成脊髓背角神经元敏感化,从而使疼痛产生和扩大[8]。BDNF是小胶质细胞-神经元信号传递中的重要因子。外周神经损伤可引起脊髓神经元释放大量ATP,产生的ATP 激活脊髓背角小胶质细胞P2X4R,引起Ca2+内流,细胞内Ca2+升高后,Ca2+可迅速与胞内的钙调蛋白结合引起钙调蛋白依赖的蛋白激酶磷酸化,促使细胞内的BDNF 释放,并且细胞内Ca2+升高可激活p38MAPK 信号通路,活化的p38MAPK不仅能促使细胞内的BDNF 释放,并且可通过激活下游特定的转录因子,如转录活化因子(1ATF-1)、cAMP反应序列结合蛋白(CREB),从而使BDNF在小胶质细胞中的合成增加[1,9]。CCI模型大鼠保留了完整的传递痛觉信息的无髓鞘C 纤维,神经损伤使背根神经节(DRG)中神经生长因子(NGF)表达增加,NGF 通过激活C 纤维上的p38MAPK,使DRG 中的BDNF表达升高,BDNF再逆行运输到脊髓背角而发挥作用[10]。p38MAPK 是BDNF 合成和释放过程中的关键因子,本研究相关性分析结果也表明p38MAPK 和BDNF mRNA 的表达呈正相关,说明BDNF mRNA 表达会随着p38MAPK mRNA 表达的增加而增加。BDNF 表达增加后其高亲和力受体酪氨酸蛋白激酶受体B(TrkB)的表达也随BDNF的增加而上调,脊髓背角的BDNF与突触后神经元上的TrkB 受体结合,通过激活PKC 途径,从而引起痛觉过敏[11]。BDNF 与TrkB 结合还能激活信号级联反应,如MAPK 通路,增加谷氨酸能突触传递,促进NMDA 受体亚单位磷酸化,诱发和维持长时程增强,从而诱导中枢敏化的形成[12],中枢敏化是疼痛长期持续的主要原因。
本研究结果显示,D 组大鼠在腹腔注射右美托咪啶后机械痛阈和热痛阈与C 组比较均明显升高,p38MAPK 和BDNF mRNA 的表达明显降低,表明右美托咪啶对神经病理性疼痛有镇痛作用且其机制与下调p38MAPK 和BDNF mRNA 的表达有关。本实验采用从CCI术后即刻至取材时点连续每天腹腔给药的方式,从术后3d开始,C组与D 组之间同一指标的差异逐渐增大(P<0.05),在术后7d时差异达到最大,7d后神经损伤开始恢复,至14d时差异比7d减小,但与术后3d比较此时右美托咪啶仍发挥着较强的镇痛作用。在术后1d时C 组、D组差异无统计学意义,说明与单次给药相比连续应用右美托咪啶能产生更强的镇痛作用,并且其镇痛作用在7~14d时达到高峰。
长期的疼痛刺激,可使脊髓背角α2肾上腺素受体(α2-AR)数目增加[13]。右美托咪啶作为一种高选择性的α2肾上腺素受体激动剂,主要作用于脊髓背角的α2-AR 产生镇痛作用。通过作用于小胶质细胞膜上的α2-AR,可激活钾离子通道,抑制钙离子通道[14]。钙离子通道受抑制后,Ca2+内流减少使神经末梢的兴奋-释放偶联机制受到抑制,减少了神经递质和BDNF的释放,同时p38MAPK 的活化也因胞内Ca2+减少而受到抑制,从而BDNF的合成也相应减少。另一方面钾离子通道激活后,K+外流增加,细胞处于超极化状态,减弱了BDNF与TrkB受体结合引起的细胞去极化作用,从而减轻疼痛的发展。最近的研究[15]表明右美托咪啶还能抑制胶质细胞的活性和ERK 信号通路,ERK 和p38MAPK同属MAPK 家族,右美托咪啶是否通过ERK 信号通路对p38MAPK 和BDNF 的表达产生影响仍需进一步研究。
综上所述,右美托咪啶能通过抑制p38MAPK信号通路,下调BDNF的表达,从而产生镇痛作用。
[1] Trang T,Beggs S,Wan X,et al.P2X4-receptor-mediated synthesis and release of brain-derived neurotrophic factor in microglia is dependent on calcium and p38-mitogen-activated protein kinase activation[J].J Neurosci,2009,29(11):3518-3528.
[2] 郭小强.脑源性神经营养因子信号转导在神经病理性疼痛中的作用[J].中国神经精神疾病杂志,2007,33(7):445-446.
[3] Scholz J,Tonner P H.Alpha2-adrenoceptor agonists in anaesthesia:a new paradigm[J].Curr Opin Anaesthesiol,2000,13(4):437-442.
[4] Bennett G J,Xie Y K.A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man[J].Pain,1988,33(1):87-107.
[5] Chaplan S R,Bach B F,Pogrel J W,et al.Quantitative assessment of tactile allodynia in the rat paw[J].J Neurosci Methods,1994,53(1):55-63.
[6] Hargreaves K,Dubner R,Brown F,et al.A new and sensitive method for measuring thermal nociception in cutaneous hyperalgesia[J].Pain,1988,32(1):77-88.
[7] 崔松勤,吴晓丽,姚维娜,等.大鼠切口痛模型中右美托咪啶对瑞芬太尼诱发的痛觉过敏的影响[J].中华行为医学与脑科学杂志,2010,19(3):231-233.
[8] Ji R R,Strichartz G.Cell signaling and the genesis of neuropathic pain[J].Sci STKE,2004,252:reE14.
[9] Inoue K,Tsuda M,Koizumi S.ATP-and adenosine-mediated signaling in the central nervous system:chronic pain and microglia:involvement of the ATP receptor P2X4[J].J Pharmacol Sci,2004,94(2):112-114.
[10] Vanelderen P,Rouwette T,Kozicz T,et al.The role of brainderived neurotrophic factor in different animal models of neuropathic pain[J].Eur J Pain,2010,14(5):473e1-9.
[11] Coull J A,Boudreau D,Bachand K,et al.Trans-synaptic shift in anion gradient in spinal lamina I neurons as a mechanism of neuropathic pain[J].Nature,2003,424(6591):938-942.
[12] Garraway S M,Petruska J C,Mendell L M.BDNF sensitizes the response of lamina II neurons to high threshold primary afferent inputs[J].Eur J Neurosci,2003,18(9):2467-2476.
[13] 舒洛娃,张炳熙,姚尚龙.脊髓阿片受体、a2肾上腺素受体与痛觉调制[J].国外医学:麻醉学与复苏分册,2003,24(2):95-98.
[14] Khan Z P,Ferguson C N,Jones R M.alpha-2and imidazoline receptor agonists.Their pharmacology and therapeutic role[J].Anaesthesia,1999,54(2):146-165.
[15] Liu L,Ji F,Liang J,et al.Inhibition by dexmedetomidine of the activation of spinal dorsal horn glias and the intracellular ERK signaling pathway induced by nerve injury[J].Brain Res,2012,1427:1-9.

