阿魏酸对慢性心力衰竭小鼠心室胶原重构的影响
蔡珊珊, 邓淑珍, 王瑞耕, 刘 玲, 孙东明
武汉市妇女儿童医疗保健中心心血管内科,武汉 430016
慢性心力衰竭(简称心衰,chronic heart failure,CHF)是大多数器质性心脏病发展的晚期阶段,表现为心肌收缩和/或舒张功能的障碍。心衰的发生机制复杂,发生过程中重要标志之一就是心脏纤维化,胞外基质重构[1-4]。阿魏酸是从当归、川芎、升麻和酸枣仁等中药材中提取的一种芳香酸,它在植物中广泛分布,主要具有抗血小板聚集,抑制血小板5-羟色胺释放,抑制血小板血栓素a2(txa2)的生成,增强前列腺素活性,镇痛,缓解血管痉挛等作用[2]。研究发现,阿魏酸对肝脏和肾脏的纤维化有保护作用[5-6],但有关其对慢性心衰中心脏纤维化发生发展过程影响的报道并不多见,本实验通过建立压力超负荷心力衰竭模型,观察阿魏酸对慢性心衰小鼠细胞外基质重构的影响。
1 材料与方法
1.1 实验动物
8~10周龄C57BL/6(C57)品系的健康小鼠40只,体重25g左右,雄性,由武汉生物制品研究所实验动物中心提供[生产许可证号:SCXK(鄂)2008-0003,使用许可证号:SYXK(鄂)2008-0012]。每5只小鼠放入1个独立送回风系统(IVC)笼具内,保持室温在22~24℃之间,湿度在50%~60%之间,明暗交替为12h,自由进食、饮水。
1.2 动物分组及模型制备
将40只小鼠分为假手术组(sham)、假手术阿魏酸组(SFA)、心衰组(TAC)、心衰阿魏酸组(TFA),每组10只。参照文献[7-8],采用主动脉缩窄的方法制作压力超负荷心衰模型。3%戊巴比妥钠(70mg/kg,Sigma)腹腔注射麻醉小鼠,备皮,用小动物气管插管针直视下插管后取下小鼠,固定在手术台上,连接呼吸机(VFA-23-BV,Kent Scientific),潮气量约每次0.4~0.5mL,呼吸频率90~100次/min,吸气∶呼气=1∶3,定容模式,以观察胸廓抬举良好作为辅助呼吸成功的标志。沿第2~3肋间切开皮肤,依次分离肌肉及软组织,打开胸腔后,游离胸主动脉,将7-0手术缝线穿过胸主动脉,将去尖的27G 针头连同主动脉一起结扎,然后立即拔出针头,造成胸主动脉狭窄,逐层缝合切口。假手术组在游离出主动脉后仅穿手术缝线,不结扎,其余步骤同手术组。待小鼠夹趾反应强烈即将苏醒时,拔出气管插管,将实验小鼠放入更换新鲜垫料、饲料和饮用水的饲养笼里,于饲养室饲养,术后观察小鼠情况。
假手术组与心衰组给予正常饮食,假手术阿魏酸组与心衰阿魏酸组给予阿魏酸饲料喂养,连续8周。阿魏酸饲料配制:将阿魏酸添加到维持饲料中,在小鼠维持饲料中占0.05%,小鼠摄入量约100 mg/(kg·d)。8 周后,心衰组实验动物死亡1 只,其余组无动物死亡。
1.3 超声心动图检测心功能
术后8周,采用超声诊断系统,小动物专用探头,中心频率10MHz,深度4cm,视窗75%,帧频50Hz,在短轴切面测量左室舒张末期内径(left ventricular end-diastolic dimension,LVEDD)、左室收缩末期内径(left ventricular end-systolic dimension,LVESD)、室间隔厚度(interventricular septal dimension,IVSD)、后壁厚度(left ventriculus posterior wall dimension,LVPWD)、射血分数(left ventriculus ejection fraction,LVEF)及左室短轴缩短率(left ventriculus fractional shortening,LVFS)。
1.4 心肌天狼猩红染色检测胶原面积
颈椎脱臼法处死小鼠,取出心脏放入10% KCl溶液中使其停跳在舒张期(n=5),将心脏和肺脏用滤纸吸干后分别称重,计算心脏重量与体重的比值(heart weight/body weight,HW/BW)、肺脏重量与体重的比值(lung weight/body weight,LW/BW)。4%多聚甲醛固定18~24h,石蜡包埋,垂直于心肌外膜作5μm 切片,行心肌天狼猩红(PSR,北京海德创业公司)染色,每张切片在400倍下随机选取无血管的5 个视野,HPIAS 2000图像分析软件系统定量测定胶原面积百分比(CVF),取其平均值。
1.5 RT-PCR检测基质金属蛋白酶9(MMP9)mRNA 表达变化
颈椎脱臼法处死小鼠,取出心脏,去除左右心耳和右心室,将左室与室间隔迅速放入-80℃冰箱备用(n=4或5),心肺处理同上。取约100mg左室心肌组织加1 mL Trizol(Invirogen公司)研磨后,三氯甲烷抽提RNA,加入异丙醇使RNA 沉淀后用75%乙醇漂洗,溶解提取RNA 后用分光光度计测量RNA 质量及浓度,用电泳方法检测RNA 是否降解。将抽提合格的RNA 反转录后加入SYBR Green、上下游引物(表1)等混匀点样在96孔板中,放入RT-PCR 仪(Light Cycler480,Roche)中检测mRNA 变化。
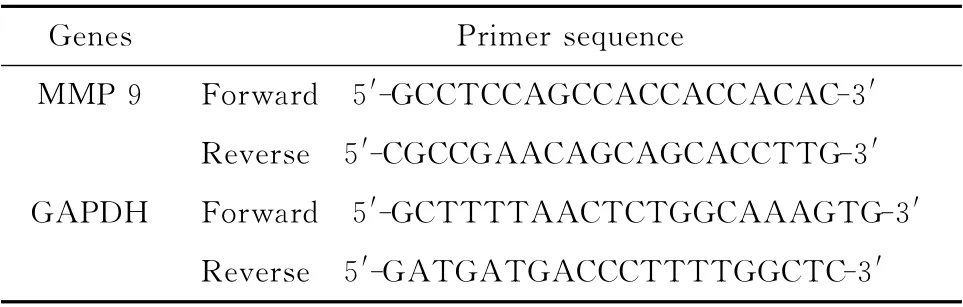
表1 目的基因与内参照基因的引物序列Table 1 Primer sequence of target gene and reference gene
1.6 免疫组化染色检测MMP9蛋白表达变化
心肌固定、包埋、切片步骤同上,免疫组化染色步骤参照SP检测试剂盒说明。每张切片在400倍下随机选取5 个视野,HPIAS 2000图像分析软件系统定量测定MMP9蛋白的表达,用灰度值的大小来表示蛋白表达的强弱,取其平均值。
1.7 统计学处理
2 结果
2.1 心脏结构和功能
超声检查结果显示,正常饮食C57小鼠主动脉缩窄术后8周时,与C57 假手术组小鼠相比,表现出显著的心肌肥厚和心功能减弱。与假手术组相比,心衰和心衰阿魏酸组左室收缩末期、舒张末期内径显著扩大,左室射血分数、短轴缩短率明显降低(均P<0.05),心衰模型制作成功。心衰阿魏酸组较心衰组射血分数提高,左室收缩末期、舒张末期内径显著缩小(均P<0.05)(表2)。
如表2所示,假手术组中正常饮食C57小鼠和阿魏酸饮食小鼠HW/BW、LW/BW 之间的差异均无统计学意义,说明阿魏酸饮食并不影响小鼠的基础状态。C57 小鼠主动脉缩窄术后8 周时心衰组HW/BW、LW/BW 明显高于假手术组小鼠,差异有统计学意义(均P<0.05),再次表明心衰小鼠模型制作成功。在主动脉缩窄术后8周,心衰阿魏酸组LW/BW与假手术阿魏酸组比较差异无统计学意义(P>0.05),心衰阿魏酸组小鼠HW/BW、LW/BW 明显较心衰组小鼠降低,差异均有统计学意义(均P<0.05),说明阿魏酸饮食缓解了心力衰竭的发生发展过程。
2.2 心肌胶原面积
在PSR染色时,胶原纤维呈红色,肌纤维呈黄色(图1)。心衰组、心衰阿魏酸组胶原面积百分比(CVF)均比假手术组明显增大(均P<0.05);心衰阿魏酸组较心衰组CVF明显减小(P<0.05)(表2)。
2.3 MMP9表达变化
RT-PCR检测结果显示,MMP9在心衰组表达明显增加,但是在心衰阿魏酸组表达的增加程度明显降低(P<0.05)(表2)。
免疫组化检测结果显示,MMP9的阳性反应为细胞核蓝染,胞核周围及胞质内棕褐色染色为阳性染色区域(图2)。灰度值与蛋白表达量呈反比关系,灰度值越大,蛋白表达量越低。心衰组、心衰阿魏酸组MMP9表达均比假手术组明显增加(均P<0.05);心衰阿魏酸组较心衰组MMP9表达明显减少(P<0.05)(表2)。
表2 术后8周4组小鼠各指标结果比较(±s)Table 2 The comparision of parameters in 4groups at 8th week after operation(±s)
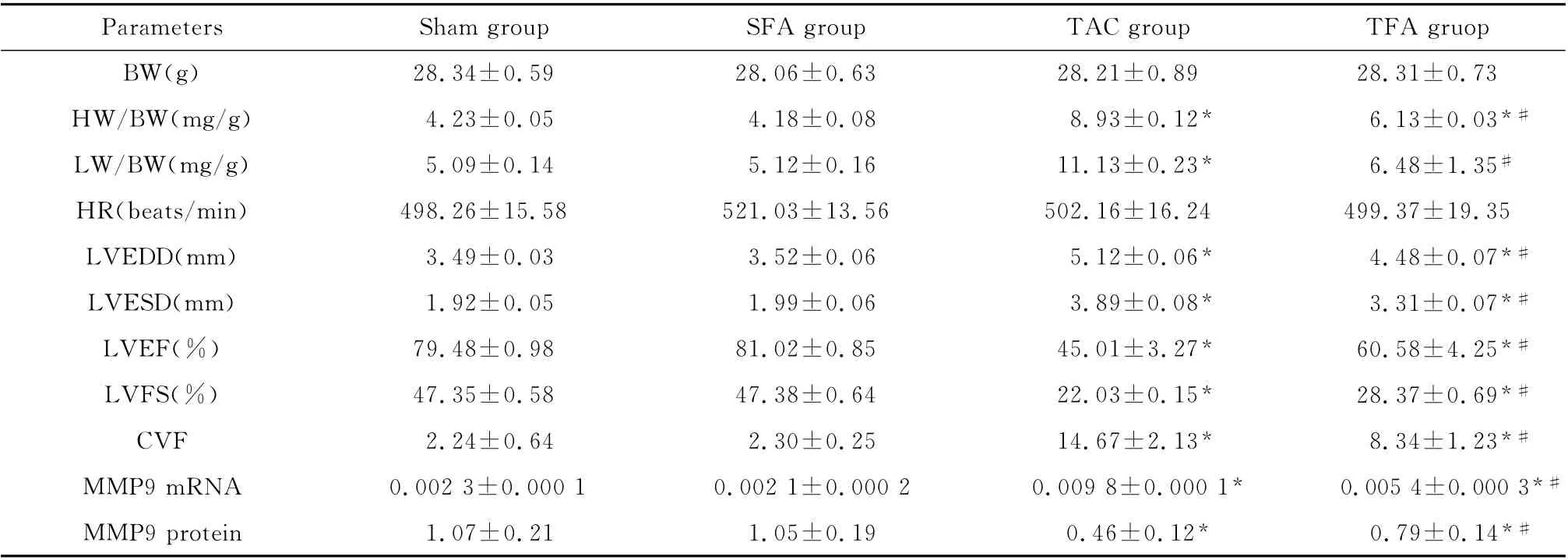
表2 术后8周4组小鼠各指标结果比较(±s)Table 2 The comparision of parameters in 4groups at 8th week after operation(±s)
*P<0.05 vs.Sham group;#P<0.05 vs.TAC group
Parameters Sham group SFA group TAC group TFA gruo p BW(g)28.34±0.59 28.06±0.63 28.21±0.89 28.31±0.73 HW/BW(mg/g)4.23±0.05 4.18±0.08 8.93±0.12*6.13±0.03*#LW/BW(mg/g)5.09±0.14 5.12±0.16 11.13±0.23*6.48±1.35#HR(beats/min)498.26±15.58 521.03±13.56 502.16±16.24 499.37±19.35 LVEDD(mm)3.49±0.03 3.52±0.06 5.12±0.06*4.48±0.07*#LVESD(mm)1.92±0.05 1.99±0.06 3.89±0.08*3.31±0.07*#LVEF(%)79.48±0.98 81.02±0.85 45.01±3.27*60.58±4.25*#LVFS(%)47.35±0.58 47.38±0.64 22.03±0.15*28.37±0.69*#CVF 2.24±0.64 2.30±0.25 14.67±2.13*8.34±1.23*#MMP9mRNA 0.002 3±0.000 1 0.002 1±0.000 2 0.009 8±0.000 1* 0.005 4±0.000 3*#MMP9protein 1.07±0.21 1.05±0.19 0.46±0.12* 0.79±0.14*#
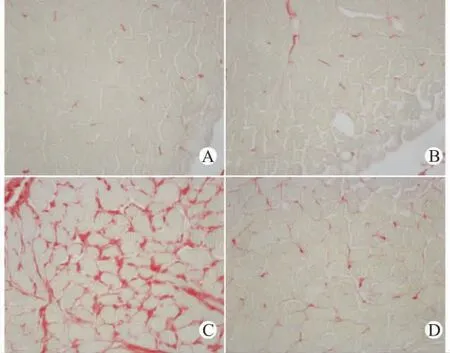
图1 各组小鼠心肌胶原的天狼猩红染色图(×400)Fig.1 PSR staining of the ventricular collagen in mice of 4groups(×400)

图2 各组小鼠心肌MMP9的免疫组化染色图(×400)Fig.2 Immunohistochemisty staining of MMP9in myocardia of 4 groups(×400)
3 讨论
心室重构是心衰发展过程中的重要环节,心室重构包括室壁细胞结构和细胞外基质的改变,后者是心室重构的主要原因。细胞外基质是存在于细胞之间的动态网络结构,由胶原、蛋白聚糖、弹力纤维等物质组成,胶原是其中最丰富的结构成分,对维持心肌细胞的排列、协调心肌收缩和舒张及维持心室几何形状起着重要作用。心肌细胞外基质重构包括成纤维细胞增生、纤维化、血管结构改变,以及细胞外基质胶原网的量和组成的变化[2-3,9]。本研究结果显示,主动脉缩窄术后8周,心脏胶原增加,心肌胶原面积增大,同时心功能下降明显,心脏重构显著。心衰阿魏酸组小鼠心脏较心衰组重构显著减轻,胶原减少,MMP9在mRNA 水平和蛋白水平的表达均减少。
MMP9是一种锌离子依赖性的中性蛋白酶家族成员,又称为明胶酶B,分子量约为92kD,其主要功能是降解重构细胞外基质,维持基质的动态平衡,其作用广泛,在众多细胞中均有表达,MMP9可通过调节基质的沉积和降解而导致心肌重构[10-11]。
阿魏酸(ferulic acid)的化学名称为4羟基3甲氧基肉桂酸,是桂皮酸(又称肉桂酸,3苯基2丙烯酸)的衍生物之一。阿魏酸具有抗血小板聚集,抑制血小板5-羟色胺释放,抑制血小板血栓素a2(txa2)的生成,增强前列腺素活性,镇痛,缓解血管痉挛等作用[12]。近期的研究表明阿魏酸除了传统的这些功效外,还能调节组织的纤维化:Guo等[5]发现在用乙醛刺激精密肝切片中的星状细胞时,阿魏酸能通过增加MMP1的表达抑制胶原生长;Meng的研究小组[6]在孤立肾输尿管梗阻的实验中发现阿魏酸能抑制IL-1β诱导的JNK 磷酸化而减轻肾小管间质性纤维化。
目前,阿魏酸改善心室胶原重构的具体机制尚未完全明确,我们的实验结果表明,给予阿魏酸8周后,心衰阿魏酸组小鼠较心衰组心室肌MMP9的表达水平减弱,胶原面积百分比减小,左室内径减小,左室射血分数提高,说明阿魏酸能够在一定程度上改善心室胶原重构,提高心脏功能,其机制可能是通过抑制心室肌MMP9的表达而干预心室胶原重构。
[1] Bui A L,Horwich T B,Fonarow G C.Epidemiology and risk profile of heart failure[J].Nat Rev Cardiol,2011,8(1):30-41.
[2] Ho C Y,López B,Coelho-Filho O R,et al.Myocardial fibrosis as an early manifestation of hypertrophic cardiomyopathy[J].N Engl J Med,2010,363(6):552-563.
[3] Jellis C,Martin J,Narula J,et al.Assessment of nonischemic myocardial fibrosis[J].J Am Coll Cardiol,2010,56(2):89-97.
[4] 刘余宏,刘启云,曾秋棠.氟伐他汀对心肌梗死后心衰大鼠内皮素-1表达的影响[J].华中科技大学学报:医学版,2008,37(6):749-752.
[5] Guo Y,Wu X Q,Zhang C,et al.Protective effect of sodium ferulate on acetaldehyde-treated precision-cut rat liver slices[J].J Med Food,2012,15(6):557-562.
[6] Meng L Q,Tang J W,Wang Y,et al.Astragaloside IV synergizes with ferulic acid to inhibit renal tubulointerstitial fibrosis in rats with obstructive nephropathy[J].Br J Pharmacol,2011,162(8):1805-1818.
[7] Piquereau J,Caffin F,Novotova M,et al.Downregulation of OPA1alters mouse mitochondrial morphology,PTP function,and cardiac adaptation to pressure overload[J].Cardiovasc Res,2012,94(3):408-417.
[8] Wei H,Bedja D,Koitabashi N,et al.Endothelial expression of hypoxia-inducible factor 1protects the murine heart and aorta from pressure overload by suppression of TGF-βsignaling[J].Proc Natl Acad Sci U S A,2012,109(14):E841-E850.
[9] 邓次妮,沈潞华.螺内酯对自发性高血压大鼠血管重构的作用[J].华中科技大学学报:医学版,2010,39(4):510-514,527.
[10] Nothnick W B.Regulation of uterine matrix metalloproteinase-9and the role of microRNAs[J].Semin Reprod Med,2008,26(6):494-499.
[11] Tanner R M,Lynch A I,Brophy V H,et al.Pharmacogenetic associations of MMP9and MMP12variants with cardiovascular disease in patients with hypertension[J].PLoS One,2011,6(8):e23609.
[12] Barone E,Calabrese V,Mancuso C.Ferulic acid and its therapeutic potential as a hormetin for age-related diseases[J].Biogerontology,2009,10(2):97-108.

