Notch1表达与乳腺癌细胞迁移及侵袭能力的相关性*
逯 翀, 刘春萍, 赵向旺, 彭功玲
华中科技大学同济医学院附属协和医院乳腺甲状腺外科,武汉 430022
乳腺癌是女性最常见的恶性肿瘤之一,乳腺癌细胞侵袭与迁移的特性是导致乳腺癌复发、转移的主要原因。如何抑制乳腺癌细胞的生长,阻断癌细胞的侵袭与迁移,是目前乳腺癌治疗研究的热点之一。近年研究[1-3]表明,Notch信号通路是决定细胞命运的重要通路,Notch1可调控乳腺癌细胞的增殖和凋亡,从而参与乳腺癌发生、发展。但Notch1是否可以调控乳腺癌的侵袭、迁移能力,尚不是很清楚。我们应用RT-qPCR 和Western blot技术以及Transwell小室侵袭、迁移实验,检测乳腺癌细胞系Notch1的表达及侵袭、迁移能力,初步探讨Notch1信号转导通路在乳腺癌细胞侵袭迁移中的调控作用。
1 材料与方法
1.1 材料
乳腺癌细胞系MCF-7及MCF-7/ADR(均由华中科技大学同济医学院附属协和医院外科实验室提供),兔抗人Notch1单克隆抗体(购自美国Epitom-ics公司),DMEM/F12(1∶1)培养液、10%胎牛血清(FBS)(均购自美国Hyclone公司),青-链霉素溶液(购自吉诺生物医药技术有限公司),表皮生长因子(EGF,购自美国Peperotech公司),胰岛素(Insulin,购自美国Sigma公司),盐酸表柔比星(法玛新,购自Pfizer),ECM 胶(购自美国Sigma公司),Transwell小室(购自美国Corning公司),结晶紫(购自武汉华顺生物技术公司)。
1.2 方法
1.2.1 细胞培养 复苏细胞株,在含10%胎牛血清的DMEM/F12培养液中培养MCF-7及MCF-7/ADR 细胞株,用200ng/mL 的盐酸表柔比星维持MCF-7/ADR 的耐药性,细胞均呈贴壁生长,待细胞长满瓶壁的80%,传代。
1.2.2 RT-qPCR 检测MCF-7及MCF-7/ADR 细胞株内Notch1mRNA 的表达 分别取处于对数生长期的MCF-7 及MCF-7/ADR 细胞,用Trizol法提取总RNA 然后逆转录成cDNA,并进行实时定量PCR 反应。Notch1及内参GAPDH cDNA 片段扩增的引物序列如表1;PCR 反应扩增条件:94℃预变性3min,94℃60s,55℃60s,共40个循环。各组设2个平行孔,电脑自动分析,导出相应的阈值循环数,采用2-ΔΔCt方法,以GADPH 的表达为内参,计算MCF-7 及MCF-7/ADR 细胞中Notch1 的相对表达量。
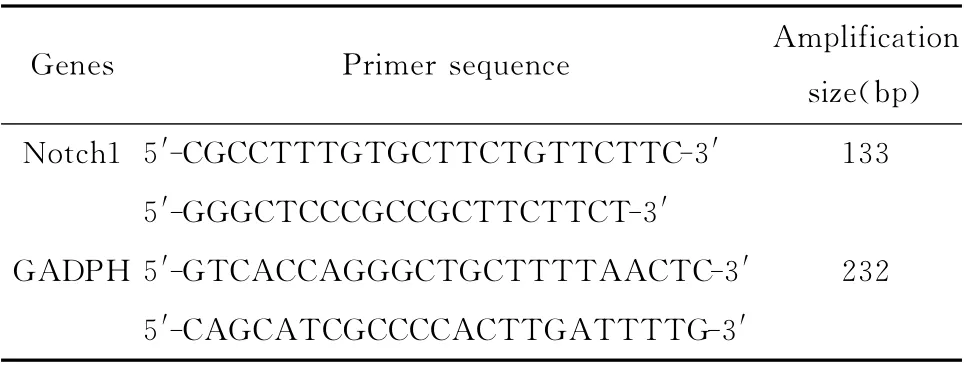
表1 Notch1及GADPH 基因的引物序列及片段长度(bp)Table 1 The primer sequence and amplification size of Notch1and GADPH
1.2.3 Western blot检测MCF-7及MCF-7/ADR细胞株内Notch1蛋白的表达 分别取处于对数生长期的MCF-7 及MCF-7/ADR 细胞,用裂解液抽提细胞总蛋白,蛋白样品浓度采用BCA 法测定,经SDS-PAGE(12%分离胶)电泳,电转移到硝酸纤维素膜上。5%的脱脂奶粉封闭2h,一抗4℃孵育过夜,加入HRP 标记的二抗室温孵育2h,TBST 洗膜后加入ECL 发光液,显色,曝光显影及定影。βactin表达作为内参照。
1.2.4 迁移实验 采用Transwell小室。取对数生长期的2株细胞,胰酶消化后用DMEM/F12培养液悬浮,调整细胞密度至2.5×105/mL。加200 μL细胞悬液至Transwell上室,下室加入30%胎牛血清的DMEM/F12培养液600μL,每株细胞设3个复孔。22h后0.1%结晶紫染色观察穿过Transwell小室的细胞数量,作为评价迁移能力的指标。高倍镜下(×400)随机计数5个视野的穿膜细胞数,取均值,实验重复3次。
1.2.5 侵袭实验 在Transwell小室上室铺以ECM 胶(1mg/mL)放入24孔板,37℃静置5h,吸出残留液体。取对数生长期的2株细胞,胰酶消化后用DMEM/F12培养液悬浮,调整细胞密度至2.5×105/mL,加200μL 细胞悬液至上室,下室加入30%胎牛血清的DMEM/F12培养液600μL,每株细胞设3个复孔。22h后0.1%结晶紫染色后观察穿过Transwell小室的细胞数量,作为评价侵袭能力的指标。高倍镜下(×400)随机计数5个视野的穿膜细胞数,取均值,实验重复3次。
1.3 统计学处理
数据分析采用SPSS 12.0软件,实验数据用均数±标准差表示,数据采用t检验及Spearman秩相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 乳腺癌细胞株Notch1mRNA的表达
细胞株MCF-7的Notch1 mRNA 表达水平为(0.046 1±0.002 2),MCF-7/ADR 的Notch1mRNA 表达水平为(0.074 8±0.004 3);细胞株MCF-7/ADR 的Notch1基因表达水平明显高于MCF-7,两组差异有统计学意义(P<0.05)。
2.2 乳腺癌细胞株Notch1蛋白的表达
细胞株MCF-7的Notch1表达水平为(0.622 0±0.028 6),MCF-7/ADR 的Notch1 表达水平为(1.636 0±0.042 2);细胞株MCF-7/ADR 的Notch1蛋白表达水平明显高于MCF-7,两组间差异有统计学意义(P<0.05)。见图1。
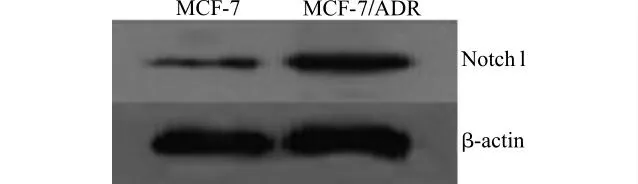
图1 Western blot检测Notch1蛋白在乳腺癌细胞株MCF-7及MCF-7/ADR 中的表达Fig.1 The expression of Notch1protein in MCF-7and MCF-7/ADR cells detected by Western blot
2.3 MCF-7和MCF-7/ADR 细胞株侵袭能力的差异
细胞株MCF-7/ADR 的穿膜细胞数为(13.62±2.25),MCF-7的穿膜细胞数为(9.62±1.30);细胞株MCF-7/ADR 的侵袭能力明显高于MCF-7,两组间差异有统计学意义(P<0.05)。见图2。
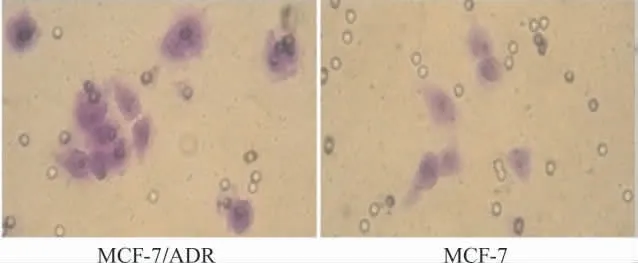
图2 Transwell小室检测乳腺癌细胞株MCF-7/ADR 及MCF-7侵袭能力(×400)Fig.2 The invasion ability of MCF-7and MAF-7/ADR cells detected by Transwell chambers(×400)
2.4 MCF-7和MCF-7/ADR 细胞株迁移能力的差异
细胞株MCF-7/ADR 的穿膜细胞数为(60.16±5.27),MCF-7的穿膜细胞数为(13.88±3.16);细胞株MCF-7/ADR 的迁移能力明显高于MCF-7,两组间差异有统计学意义(P<0.05)。见图3。
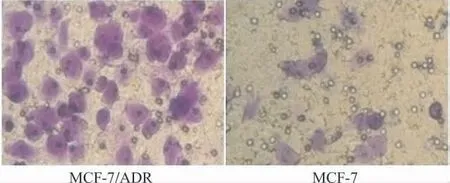
图3 Transwell小室检测乳腺癌细胞株MCF-7/ADR 及MCF-7迁移能力(×400)Fig.3 The migration ability of MCF-7and MCF-7/ADR cells detected by Transwell chambers(×400)
2.5 Notch1与乳腺癌细胞株侵袭能力的相关性
Notch1mRNA 水平表达与乳腺癌细胞侵袭能力呈正相关,相关系数rs=0.85(P<0.05);Notch1蛋白表达水平与乳腺癌细胞侵袭能力呈正相关,相关系数rs=0.90(P<0.05)。
2.6 Notch1与乳腺癌细胞株迁移能力的相关性
Notch1mRNA 表达水平与乳腺癌细胞迁移能力呈正相关,相关系数rs=0.92(P<0.05);Notch1蛋白表达水平与乳腺癌细胞迁移能力呈正相关,相关系数rs=0.88(P<0.05)。
3 讨论
近年来,乳腺癌的发病率逐年上升,现已跃居女性恶性肿瘤的首位。目前虽通过早发现、早诊断及早治疗等原则使乳腺癌患者的生存率有所提高,但结果仍不尽如人意,重要脏器的转移是造成乳腺癌患者死亡的最主要的原因[4-5]。乳腺癌细胞的迁移和侵袭能力是导致乳腺癌转移的重要因素,因此探讨与乳腺癌侵袭和迁移相关的生物学标志物是目前乳腺癌研究的热点[6-7]。
Notch信号通路可调控细胞的增殖、分化与凋亡,是多种组织和器官早期发育所必需的细胞间调节信号,它通过邻近细胞间相互作用精确调控各谱系细胞的发育、增殖、分化[8]。研究发现[9-10]Notch1在乳腺癌组织中表达高于周围正常组织,和ER、HER-2等分子分型的表达关系密切,是乳腺癌发生发展的重要因素。近来有文献报道[11-12],Notch1信号通路的活化可以增加结肠癌、肾透明细胞癌等多种恶性肿瘤的转移风险,但是Notch1 在乳腺癌转移中的作用并不确切。本研究以乳腺癌细胞株为研究对象,利用RT-qPCR 和Western blot技术检测了乳腺癌细胞株MCF-7与MCF-7/ADR 中Notch1表达的差异,用Transwell小室检测乳腺癌细胞株侵袭、迁移能力的差异。研究结果显示,2株细胞中Notch1 的表达存在差异,MCF-7/ADR 细胞中Notch1 表达水平明显高于 MCF-7 细胞,同时MCF-7/ADR 细胞的侵袭、迁移能力明显高于MCF-7细胞,差异均有统计学意义。进一步探讨Notch1与乳腺癌细胞侵袭、迁移的相关性,发现Notch1的表达水平与乳腺癌细胞的侵袭、迁移能力高度正相关。
Notch1信号通路参与调控乳腺癌细胞的侵袭与迁移能力,阻断该通路活化将可能抑制乳腺癌细胞的侵袭、迁移,从而开辟乳腺癌治疗的新途径。
[1] Sharma A,Paranjape A N,Rangarajan A,et al.A monoclonal antibody against human Notch1ligand-binding domain depletes subpopulation of putative breast cancer stem-like cells[J].Mol Cancer Ther,2012,11(1):77-86.
[2] Yong T,Sun A,Henry M D,et al.Down regulation of CSL activity inhibits cell proliferation in prostate and breast cancer cells[J].J Cell Biochem,2011,112(9):2340-2351.
[3] 王中显,陶涛,周志刚,等.Notch3在卵巢上皮性癌中的表达及临床意义[J].华中科技大学学报:医学版,2011,40(3):264-267.
[4] Anders C K,Deal A M,Miller C R,et al.The prognostic contribution of clinical breast cancer subtype,age,and race among patients with breast cancer brain metastases[J].Cancer,2011,117(8):1602-1611.
[5] Jung S Y,Rosenzweig M,Sereika S M,et al.Factors associated with mortality after breast cancer metastasis[J].Cancer Causes Control,2012,23(1):103-112.
[6] 刘科,张波,王国斌,等.抑癌基因ING4 转染对乳腺癌细胞MDA-MB-435S生物学行为的影响[J].华中科技大学学报:医学版,2010,39(4):442-445.
[7] 饶玉梅,方勇,韩志强,等.BRMS1对卵巢癌细胞c13*转移侵袭的影响及机制[J].华中科技大学学报:医学版,2011,40(2):131-136.
[8] Androutsellis-Theotokis A,Leker R R,Soldner F,et al.Notch signaling regulates stem cell numbers in vitro and in vivo[J].Nature,2006,442(7104):823-826.
[9] Magnifico A,Albano L,Campaner S,et al.Tumor-initiating cells of HER2-positive carcinoma cell lines express the highest oncoprotein levels and are sensitive to trastuzumab[J].Clin Cancer Res,2009,15(6):2010-2021.
[10] Hao L,Rizzo P,Osipo C,et al.Notch-1activates estrogen receptor-alpha-dependent transcription via IKKalpha in breast cancer cells[J].Oncogene,2010,29(2):201-213.
[11] Ai Q,Ma X,Huang Q,et al.High-level expression of Notch1 increased the risk of metastasis in T1stage clear cell renal cell carcinoma[J].PloS One,2012,7(4):e35022.
[12] Sonoshita M,Aoki M,Fuwa H,et al.Suppression of colon cancer metastasis by Aes through inhibition of Notch signaling[J].Cancer Cell,2011,19(1):125-137.

