ERK1/2通路与舌鳞癌细胞Cal-27生物学行为的相关性
李 伟, 邵乐南, 张小燕, 廖琳迪, 肖玉霞
华中科技大学同济医学院附属同济医院口腔颌面外科,武汉 430030
口腔癌是一种与环境因素密切相关的疾病,烟草和酒精是已知的重要的致病因素。在口腔恶性肿瘤中,90%以上都是鳞状细胞癌,占所有恶性肿瘤2%~3%[1]。舌鳞状细胞癌(squamous cell carcinoma of the tongue,TSCC)是最常见的口腔鳞状细胞癌,它生长快、浸润性强,早期即可发生颈淋巴结转移,且转移率很高,是导致患者死亡的重要原因。
丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)能够通过一系列的细胞表面受体将细胞外信号传递至细胞核,从而发挥各种调节功能,包括细胞的分裂、增殖、生长、分化、运动和细胞死亡。MAPK 家族主要包括ERKs、p38-MAPK和JNK/SAPK,还有一些其它的MAPK 成员如ERK5和ERK7等[2]。大量研究发现Ras-Raf-MEKERK信号通路在许多人类恶性肿瘤中异常激活,参与了肿瘤的发生发展。Ras是ERKs通路的上游蛋白,包括4个亚型Ha-Ras、N-Ras、Ki-Ras 4A 和Ki-Ras 4B,在人类大约20%的肿瘤中可以发现Ras的基因突变[3]。Raf是癌基因表达产物,包括A-Raf,B-Raf和Raf-1,其中B-Raf突变最为常见,在人类7%的癌变中可以检测到B-Raf基因突变,特别是在恶性黑色素瘤,甲状腺癌及结肠癌中尤为突出[4]。Ras及Raf功能突变都可以导致ERKs通路的异常激活,从而促使癌症的发生。因此这条通路作为癌症治疗的靶点被广泛研究。本实验以人舌鳞癌细胞Cal-27为研究对象,通过应用不同浓度的特异性ERK1/2信号通路抑制剂U0126进行干预后,观察肿瘤细胞一系列生物学行为的变化,分析Ras-Raf-MEK-ERK 通路在舌鳞状细胞癌发生发展以及侵袭和转移中的可能作用机制,探讨MAPK 信号通路抑制剂在肿瘤治疗中的作用。
1 材料与方法
1.1 主要试剂
U0126(美国Cell Signaling 公司);胎牛血清(HyClone公司);胰蛋白酶(杭州四季青有限公司);Annexin Ⅴ-FITC 试剂盒(上海贝博生物试剂公司);二甲基亚砜(武汉科瑞科技有限公司);MTT试剂盒(武汉鼎国生物技术有限公司)。
1.2 细胞培养
人舌鳞癌细胞系Cal-27(同济医院妇产科实验室提供)常规培养于含10%FBS 的DMEM 完全培养液中,含青霉素、链霉素(各1 U/mL),放置在37℃、5%CO2、相对湿度90%的培养箱中培养,细胞贴壁生长。0.25% 的胰蛋白酶消化处于对数生长期的细胞,传代培养用于后续试验。
1.3 MTT法检测细胞增殖
取对数生长期Cal-27细胞,常规消化成2.5×104/mL的单细胞悬液,接种于96 孔细胞培养板,每孔200μL(边缘孔用无菌PBS填充)。37℃、5%CO2培养箱培养,待其融合到60%~70%后加药。实验分为空白调零组(即不加细胞悬液只含培养液)、阴性对照组(即加入细胞悬液和培养液)和实验组(即加入细胞悬液、培养液和U0126),其中实验组U0126药物设4 个浓度梯度(5、10、20、40μmol/L),每组设3 个重复孔。置于培养箱中共同培养12、24、36、48h 后,倒置显微镜下观察。每孔加入20μL MTT(5mg/mL),4h后弃上清,加入150μL DMSO 振荡10min,使结晶物充分溶解,用酶联免疫测定仪检测490nm 波长处的吸光度(A)值。以时间为横坐标,A 值为纵坐标使用统计软件绘制细胞生长曲线。
1.4 细胞划痕实验
先用记号笔在6孔板背后,均匀地画横线,间隔大约0.5~1.0cm 一条,横穿过孔。在每孔中加入5×105个细胞,置于培养箱中培养。待细胞融合至90%以上时,丝裂霉素预处理1h,抑制细胞分裂。用无菌枪头垂直于背后的横线划痕,枪头要垂直,不能偏斜。无血清DMEM 洗细胞3 次,去除划下的细胞,加入含不同浓度U0126(5、10、20、40μmol/L)的低血清培养液。放入37℃、5%CO2培养箱培养,分别于培养0、12、24、36、48h取样拍照。
1.5 Transwell迁移试验
0.25% 的胰蛋白酶消化处于对数生长期的细胞,终止消化后离心弃培养液,用PBS 洗1~2 遍,无血清培养液重悬,调整细胞密度至2×105/mL。小室下层加入500μL 含2.5%FBS的培养液,上层加入200μL含不同浓度U0126(5、10、20、40μmol/L)细胞悬液,对照组不加U0126。置于37℃、5%CO2培养箱培养24h,弃去孔中培养液,甲醛室温固定30min,0.5%结晶紫常温染色10 min。清水漂洗干净,用棉签轻轻擦掉上层未迁移细胞。倒置显微镜下观察迁移细胞的数量,计算趋化指数(chemotactic index,CI)CI=实验组平均迁移细胞数/空白对照组平均迁移细胞数×100% 。
1.6 Transwell侵袭试验
用50mg/L Matrigel 1∶8 稀释液包被Transwell小室底部膜的上室面,4℃风干。吸出培养板中残余液体,每孔加入50μL 含10g/L BSA 的无血清培养液,37℃、30 min。重复1.5的实验步骤。以膜下的细胞多少来表示细胞的侵袭能力。计算侵袭指数(invasion index,II)II=实验组平均迁移细胞数/空白对照组平均迁移细胞数×100%。
1.7 流式细胞仪检测细胞凋亡
离心收集经0、5、10、20、40μmol/L U0126 分别作用12、24、36、48h后的Cal-27细胞,冷PBS洗涤细胞2次。400μL Annexin Ⅴ结合液悬浮细胞,细胞密度大约为1×106/mL。细胞悬浮液中加入5 μL Annexin Ⅴ-FITC 染色液,轻轻混匀后于2~8℃避光条件下孵育15min。加入10μL 碘化丙啶(PI)染色液轻轻混匀,于2~8℃避光条件下孵育5 min。1h内上机检测。
1.8 流式细胞仪检测细胞周期
收集经0、5、10、20、40μmol/L U0126作用48 h后的Cal-27细胞,PBS洗2次,加入-4℃预冷的75%乙醇,4℃固定过夜,弃乙醇,PBS洗1次,加入Rnase 100μg/mL,加PI染色剂,避光染色20min,用流式细胞仪检测细胞周期变化。
1.9 统计学方法
应用SPSS 12.0统计软件处理数据,计量数据以均数±标准差(±s)表示,均数比较采用单因素方差分析及SNK-q检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 不同浓度U0126对Cal-27细胞生长的影响
结果表明5、10、20、40μmol/L U0126 均能抑制Cal-27细胞的增殖,并且随着药物剂量的增大,作用时间的延长,抑制效果呈上升趋势,即在一定范围内呈时间-剂量依赖性。不同浓度组与阴性对照组间差异有统计学意义(均P<0.05),各浓度组间差异也有统计学意义(P<0.05)。见图1。
2.2 不同浓度U0126对Cal-27细胞运动能力的影响
光镜下观察,与对照组相比,U0126 对Cal-27细胞的运动有一定的抑制作用,浓度越高,抑制作用越强,表现出一定的剂量依赖性。结果如图2。
2.3 不同浓度U0126对Cal-27细胞迁移能力的影响
经过5、10、20、40μmol/L U0126处理后24h后,细胞迁移通过Transwell小室膜下的数量与对照组相比明显减少,即细胞迁移能力随药物浓度升高呈下降趋势。结果如图3。
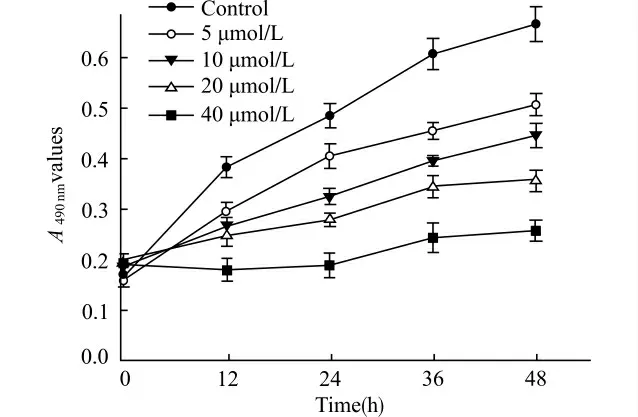
图1 U0126对Cal-27细胞增殖生长曲线的影响Fig.1 Effect of U0126on growth curve of Cal-27cells

图2 U0126对Cal-27细胞划痕愈合的影响Fig.2 Effect of U0126on scratch healing of Cal-27cells
2.4 不同浓度U0126 对Cal-27细胞侵袭能力的影响
经过5、10、20、40μmol/L U0126处理后24h后,细胞通过Matrigel胶迁移到Transwell小室膜下的数量与对照组相比明显减少,即细胞侵袭能力随药物浓度升高呈下降趋势。结果如图4。
2.5 不同浓度U0126对Cal-27细胞凋亡的影响
U0126能促进Cal-27细胞凋亡,但在48h后各实验组细胞才出现明显凋亡现象,并且随着U0126浓度的增加和作用时间的延长,细胞凋亡率逐渐增加。不同浓度组与阴性对照组间差异有统计学意义(均P<0.05),各浓度组间差异也有统计学意义(P<0.05)。如图5,表1。
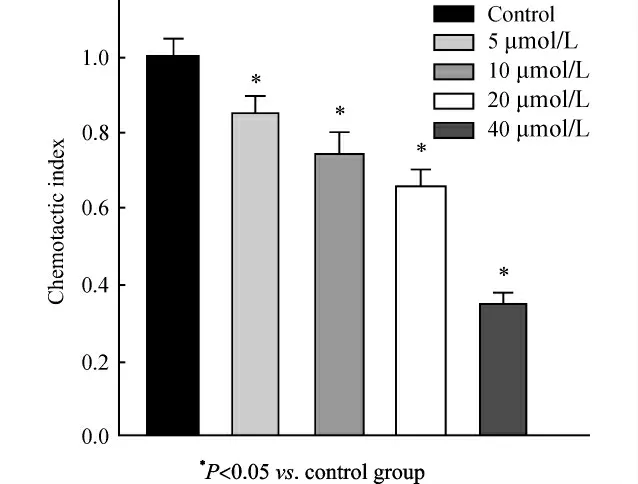
图3 U0126作用24h对Cal-27迁移能力的影响Fig.3 Influence of U0126on migration ability of Cal-27cells
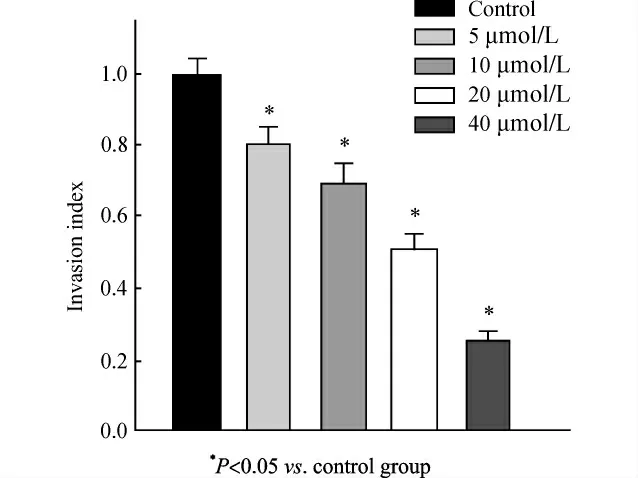
图4 U0126作用24h对Cal-27侵袭能力的影响Fig.4 Influence of U0126on invasion ability of Cal-27cells

图5 流式细胞术检测U0126作用48h对Cal-27细胞凋亡的影响Fig.5 Apoptosis of Cal-27cells treated with U0126for 48h
表1 U0126对Cal-27细胞凋亡的影响(%,±s,n=3)Table 1 Effect of U0126on apoptosis of Cal-27cells(%,±s,n=3)
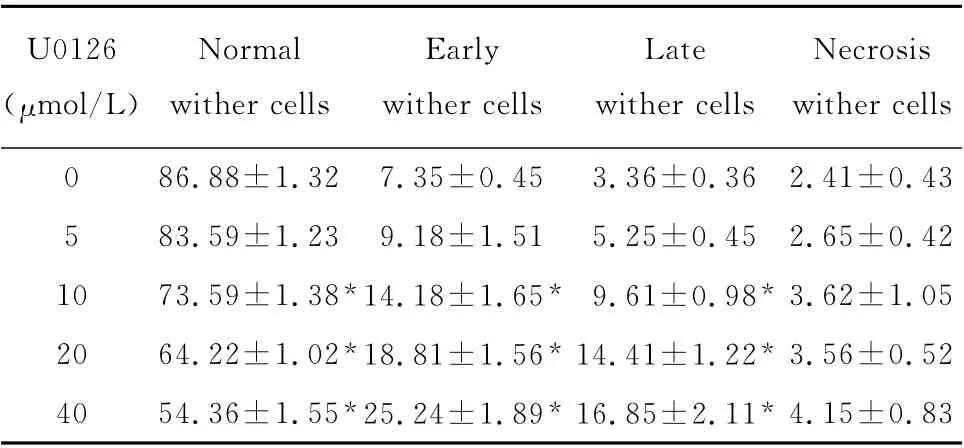
表1 U0126对Cal-27细胞凋亡的影响(%,±s,n=3)Table 1 Effect of U0126on apoptosis of Cal-27cells(%,±s,n=3)
*P<0.05 vs.control group(0μmol/L U0126)
U0126(μmol/L)Normal wither cells Early wither cells Late wither cells Necrosis wither cells 0 86.88±1.32 7.35±0.45 3.36±0.36 2.41±0.43 5 83.59±1.23 9.18±1.51 5.25±0.45 2.65±0.42 10 73.59±1.38*14.18±1.65* 9.61±0.98*3.62±1.05 20 64.22±1.02*18.81±1.56*14.41±1.22*3.56±0.52 40 54.36±1.55*25.24±1.89*16.85±2.11*4.15±0.83
2.6 不同浓度U0126对Cal-27细胞周期的影响
与对照组相比,不同浓度U0126可以使肿瘤细胞周期各个时相细胞数所占比例发生变化。药物作用后S期和G2/M 期肿瘤细胞比例减少,G0/G1期肿瘤细胞比例增加,且随药物浓度的增加而增多。如表2。
表2 U0126对Cal-27细胞增殖周期的影响(%,±s,n=3)Table 2 Influence of U0126on cycle of Cal-27cells(%,±s,n=3)
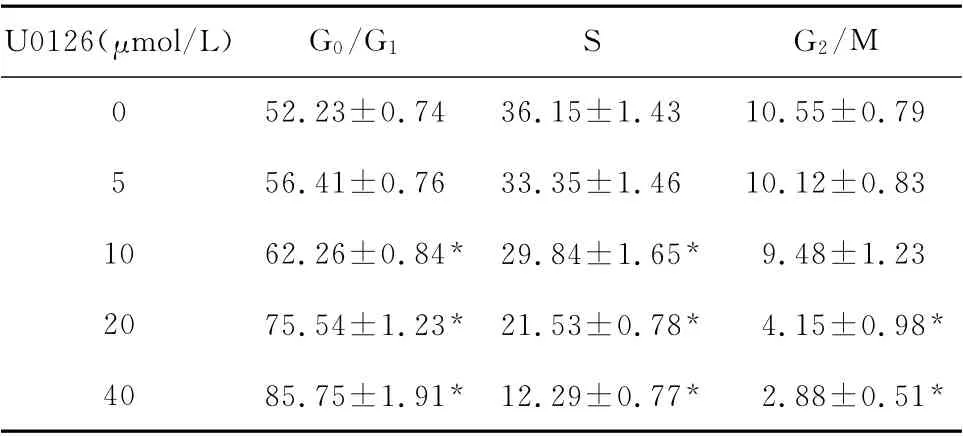
表2 U0126对Cal-27细胞增殖周期的影响(%,±s,n=3)Table 2 Influence of U0126on cycle of Cal-27cells(%,±s,n=3)
*P<0.05 vs.control group(0μmol/L U0126)
U0126(μmol/L)G0/G1S G2/M 0 52.23±0.74 36.15±1.43 10.55±0.79 5 56.41±0.76 33.35±1.46 10.12±0.83 10 62.26±0.84* 29.84±1.65*9.48±1.23 20 75.54±1.23* 21.53±0.78*4.15±0.98*40 85.75±1.91* 12.29±0.77*2.88±0.51*
3 讨论
细胞周期的紊乱,细胞的过度增殖以及凋亡减少是口腔癌形成的重要原因。细胞信号传导系统控制着细胞的生命活动,许多癌基因和抑癌基因位于细胞信号传导通路的上游和下游,它们的功能异常与细胞的癌变也有着密切的联系。
口腔癌是世界范围内第6大常见癌症[5]。大多数低分化口腔癌死亡率很高,并且常伴有局部侵袭和区域性的转移。因此探讨其侵袭、转移的机制具有重要意义。
MAPK 家族可以被多种细胞外信号激活,在细胞的增殖、分化和凋亡中起着重要作用。MAPK 可以将细胞外信号传递至细胞核,并通过转录因子控制基因的表达。哺乳类动物的MAPK 包括3个主要的亚型ERKs、JNK/SAPK 和p38-MAPK[6-7]。每一个MAPK 都有其特别的结构和功能,调节着细胞重要的生理功能[8-10]。正常情况下,MAPK 严格地维持着细胞的生理平衡。在癌细胞中,这种平衡常常由于基因的不稳定性而被打破,造成了细胞增殖和凋亡的改变,丧失其正常的生理功能。
ERK1/2信号通路是MAPK 家族中被研究得最广泛的成员,可以被各种生长因子短暂而迅速地激活,包括EGF、NGF、PDGF。这些生长因子可以与特异的细胞表面受体比如G 蛋白偶联受体和酪氨酸激酶受体[11-12]相结合。ERK1/2信号通路涉及许多与人类癌症发生相关的原癌基因以及各种因子。研究发现EGF-R 基因在恶性胶质瘤、食管癌、肺癌等恶性肿瘤中表达增强[13-15]。在口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)中,30%以上都发现Ras原癌基因的过表达和突变。同时有研究表明在OSCC中,ERK1/2的基因mRNA 与肿瘤的TNM 分期及有无淋巴结转移有关[16]。出现淋巴结转移表明肿瘤细胞迁移和侵袭能力较强,本实验结果表明加入U0126后,肿瘤细胞穿过小室的数目减少,即迁移及侵袭能力减弱,并且与药物浓度呈负相关。说明舌鳞癌细胞的迁移和运动能力与ERK1/2通路有关,并且这一能力可以被U0126减弱,但不能被完全抑制。
Ras是小分子GTP连接蛋白,是许多信号通路的上游蛋白,这些通路包括Raf/MEK/ERK,PI3K/Akt和RalEGF/Ral[17]。现已证明Ras有4 种亚型:Ha-Ras,N-Ras,Ki-Ras 4A 和Ki-Ras 4B。它们表现出高度的序列同源性以及相同的激活和失活模式。活化性Ras突变在30%人类癌症中可以被检出。Ras的过度活化可使下游通路持续激活,使细胞无限增殖,表现出恶性特征。本实验用U0126暂时阻断ERK1/2通路后,观察到细胞增殖速度明显减慢,而且我们还观察到细胞形态从多角性逐渐趋于圆形,而且贴壁能力减弱,在较高药物浓度持续作用下,大量细胞脱落,提示肿瘤细胞的增殖失控可能与ERK1/2通路的异常激活有关。
Raf丝/苏氨酸家族包括3个亚型A-Raf,B-Raf和Raf-1。研究表明B-Raf比A-Raf和Raf-1显示出更高的基础激酶活性[18-19],是下游激酶MEK 的主要激活剂,如果B-Raf缺失,则发现ERK 磷酸化水平降低[20]。提示来自B-Raf的异常信号可直接传递至MEK,进而激活整个ERK1/2通路,促使肿瘤发生。U0126为MEK 非ATP竞争性抑制剂,可在MEK 水平直接阻断来自B-Raf的异常信号,由此可以推测U0126可能对治疗由B-Raf突变引起的疾病有帮助。
目前化疗仍然是治疗许多恶性肿瘤的重要手段,很多化疗药物都是作用于肿瘤细胞分裂周期的各个阶段,干扰其分裂,从而抑制细胞的增殖。本实验结果表明U0126可使Cal-27细胞S 期和G2/M期肿瘤细胞比例减少,G0/G1期肿瘤细胞比例增加,从而抑制其有丝分裂。
细胞凋亡即细胞程序化死亡,是由遗传物质控制的细胞正常的生命活动,而抗凋亡则是肿瘤细胞的主要特征之一。本实验结果表明用U0126 阻断ERK 1/2通路可以诱导肿瘤细胞凋亡,提示ERK1/2通路参与了肿瘤的发生。
近年来信号通路被认为是恶性肿瘤治疗的潜在药物靶点,大量小分子抑制剂被研发并用于临床试验,取得了良好的进展。索拉非尼是第一个也是唯一一个被认可并应用于临床的Raf激酶抑制剂,它对其它激酶如VEGFR-2,VEGFR-3 和PDGFR-b也有靶向抑制作用[21]。U0126及PD98059两者均为ERK1/2通路抑制剂,都为非ATP竞争性MEK抑制剂,体外研究发现,U0126和PD98059均可抑制人黑色素瘤细胞系A375的侵袭性,并同时发现MMP-9含量降低[22]。
本实验结果也表明U0126 可以抑制舌鳞癌细胞增殖,诱导细胞凋亡,并能够抑制癌细胞的迁移和侵袭能力,提示U0126可能对肿瘤治疗有帮助。但是实验结果也显示U0126不能完全抑制肿瘤细胞的恶性生物学行为,说明可能有多条信号通路支配肿瘤细胞的生命活动,提示须将多条信号通路抑制剂联合使用,才能达到治疗的目的。应该注意的是,信号通路也调节着正常细胞的生命活动,若被完全阻断,势必会对正常细胞造成不利影响,可能会引起毒性反应,如何避免这一后果,还需要进一步研究。此外有动物实验证明,MAPK 通路参与了由肺损伤引起的炎症应答反应,应用U0126进行干预,可以降低IL-2 和TNF-α的释放,可以保护由脂多糖诱导的急性肺损伤[23]。这也提示MAPK 抑制剂在治疗炎性及其它疾病的应用潜力。
[1] Kademani D.Oral cancer[J].Mayo Clin Proc,2007,82(7):878-887.
[2] Kato Y,Tapping R I,Huang S,et al.Bmk1/Erk5is required for cell proliferation induced by epidermal growth factor[J].Nature,1998,395(6703):713-716.
[3] Malumbres M,Barbacid M.RAS oncogenes:the first 30years[J].Nat Rev Cancer,2003,3(6):459-465.
[4] Davies H,Bignell G R,Cox C,et al.Mutations of the BRAF gene in human cancer[J].Nature,2002,417(6892):949-954.
[5] Jemal A,Siegel R,Ward E,et al.Cancer statistics,2006[J].CA Cancer J Clin,2006,56(2):106-130.
[6] Han J,Lee J D,Bibbs L,et al.A MAP kinase targeted by endotoxin and hyperosmolarity in mammalian cells[J].Science,1994,265(5173):808-811.
[7] Boulton T G,Nye S H,Robbins D J,et al.ERKs:a family of protein-serine/threonine kinases that are activated and tyrosine phosphorylated in response to insulin and NGF[J].Cell,1991,65(4):663-675.
[8] Davis R J.The mitogen-activated protein kinase signal transduction pathway[J].J Biol Chem,1993,268(20):14553-14556.
[9] Eastman A.Survival factors,intracellular signal transduction,and the activation of endonucleases in apoptosis[J].Semin Cancer Biol,1995,6(1):45-52.
[10] Treisman R.Regulation of transcription by MAP kinase cascades[J].Curr Opin Cell Biol,1996,8(2):205-215.
[11] van Biesen T,Luttrell L M,Hawes B E,et al.Mitogenic signaling via G protein-coupled receptors[J].Endocr Rev,1996,17(6):698-714.
[12] Hill C S,Treisman R.Transcriptional regulation by extracellular signals:mechanisms and specificity[J].Cell,1995,80(2):199-211.
[13] Yung W K,Zhang X,Steck P A,et al.Differential ampli-fication of the TGF-alpha gene in human gliomas[J].Cancer Commun,1990,2(6):201-205.
[14] D’Amico T A,Harpole D H Jr.Molecular biology of esophageal cancer[J].Chest Surg Clin N Am,2000,10(3):451-469.
[15] Imaizumi M,Nishimura M,Takeuchi S,et al.Role of tyrosine specific phosphorylation of cellular pro-teins,especially EGF receptor and p125FAK in human lung cancer cells[J].Lung Cancer,1997,17(1):69-84.
[16] 肖玉霞,邵乐南,黄梅靖,等.PTPIP51、p-Raf-1及ERK1/2在口腔鳞状细胞癌中的表达[J].华中科技大学学报:医学版,2011,40(4):417-422.
[17] Peyssonnaux C,Provot S,Felder-Schmittbuhl M P,et al.Induction of postmitotic neuroretina cell proliferation by distinct Ras downstream signaling pathways[J].Mol Cell Biol,2000,20(19):7068-7079.
[18] Mason C S,Springer C J,Cooper R G,et al.Serine and tyrosine phosphorylations cooperate in Raf-1,but not B-Raf activation[J].Embo J,1999,18(8):2137-2148.
[19] Li N,Batt D,Warmuth M.B-Raf kinase inhibitors for cancer treatment[J].Curr Opin Investig Drugs,2007,8(6):452-456.
[20] Karasarides M,Chiloeches A,Hayward R,et al.B-RAF is a therapeutic target in melanoma[J].Oncogene,2004,23(37):6292-6298.
[21] Lyons J F,Wilhelm S,Hibner B,et al.Discovery of a novel Raf kinase inhibitor[J].Endocr Relat Cancer,2001,8(3):219-225.
[22] Ge X,Fu Y M,Meadows G G.U0126,a mitogen-activated protein kinase kinase inhibitor,inhibits the invasion of human A375melanoma cells[J].Cancer Lett,2002,179(2):133-140.
[23] Schuh K,Pahl A.Inhibition of the MAP kinase ERK protects from lipopolysaccharide-induced lung injury[J].Biochem Pharmacol,2009,77(12):1827-1834.

