腺苷对原代培养的大鼠海马神经元大电导钙激活钾通道的作用*
李 巷, 康慧聪, 刘晓艳, 胡 琦, 许 峰, 刘志广, 朱遂强
华中科技大学同济医学院附属同济医院神经内科,武汉 430030
近年来,腺苷(adenosine)作为内源性神经调节剂受到关注。研究表明,腺苷不仅有广泛的脑保护作用[1],且对正常中枢神经元和痫样放电的神经细胞都有抑制作用[2-3]。腺苷的抑制作用主要表现在影响癫痫发作后不应期,使放电阈值增高;Acsar等[4]报道其主要是作用于突触后膜,增大K+电导引起膜超极化。中枢神经系统神经元细胞膜上有多种钾通道,大电导钙激活性钾通道(BKCa)在神经元胞体、突触、终末端广泛表达。BKCa主要参与动作电位复极化和快速超极化,形成fastAHP(FAHP)。AHP电流参与神经元峰电位频率适应过程,影响神经元位相型放电和连续放电,从而调节神经元兴奋性[5]。BKCa开放时引起K+外流,使神经元内阳离子降低,促进动作电位复极化和超极化的形成,从而使神经元的兴奋性降低。因此,BKCa通道的开放可能在癫痫发病机制中起到保护作用。基于以上资料,我们试图进一步研究作为内源性抗癫痫物质的腺苷,其作用靶点是否在BKCa通道,以及如何影响BKCa通道变化。
1 材料与方法
1.1 材料
乳鼠(SD 大鼠新生24h之内),由华中科技大学同济医学院实验动物学部提供。DMEM 培养液、F12培养液、胎牛血清(FBS)、胰酶干粉、Neurobasal培养液、B27添加剂,均为Gibco公司产品,4-氨基吡啶(4-AP)、腺苷干粉为Sigma公司产品,其余试剂均为国产分析纯。玻璃电极购于南京泉水教学实验器材厂,用两步法拉制。细胞外液成分(mmol/L):NaCl 144,KCl 6,CaCl2×2H2O 2,MgCl2×6H2O 1.2,HEPES 10,D-Glucose 10,4-AP 5,pH 7.4。电极内液成分(mmol/L):K-Glutamine 110,KCl 20,Na2ATP 3,EGTA 0.1,MgCl2×6H2O 3,HEPES 10,D-Glucose 10,pH 7.35。
1.2 海马神经元细胞分离与培养
SD 大鼠为24h内的新生乳鼠,取海马后在4℃PBS平衡液中清除血管。用眼科剪将组织剪碎后在0.125%胰酶37℃消化15min,然后用含有10%FBS的DMEM 培养液终止消化5 min。用尖端抛光的巴氏管吹打20下,200目筛网过滤后,滤液800 r/min离心4min,弃去上清。用DMEM-F12培养液混匀细胞沉淀成细胞悬液,种植于包被过的35 mm 培养皿中。24h 后用Neurobasal-B27 培养液全换液,以后每3d半换液,培养6~8d的细胞用于实验。用MAPⅡ鉴别神经元表面标志。
1.3 膜片钳记录
在倒置显微镜下选择形态典型的神经元用于实验。玻璃微电极拉制后尖端直径为1~2μm,充灌电极内液后电阻2~4 MΩ。实验用EPC10膜片钳放大器,调节三维显微操纵器,使玻璃电极尖端与细胞表面接触,稍加负压形成高阻抗封接后,再加负压形成全细胞记录模式。记录前进行快慢电容补偿和串联电阻补偿(达80%)。数据采集和分析用Pulse软件(HEKA,德国)。用细胞外液灌流,封接,破膜,全细胞记录模式形成后,待电流稳定5min后开始记录。实验均在24℃下进行。
1.4 药品配制
腺苷是水溶性,直接溶于细胞外液中配成母液,-20℃冰箱冻存。记录电流前用细胞外液配成相应的浓度(1、10、100μmol/L),以细胞旁方式给药。
1.5 统计学分析
为消除细胞大小对电流大小的影响,所有数据都采用电流密度(Id),即单位细胞面积上的电流(电流/细胞电容,pA/pF),以均数±标准差表示。加药前后的Id采用配对t检验进行统计学分析;用Boltzmann方程对电流的激活曲线进行拟合。所有图表都由Excel 2003和Sigmaplot10.0制成。
2 结果
2.1 海马神经元培养及鉴定
培养6~8d的细胞在高倍镜下可见:海马神经元胞体呈梭形、椭圆形、三角形和多角形不等;突起很明显,特别是树突粗大可有分支;状态较好的神经元胞体较厚,立体感强,周围可见光晕,看不到明显的胞核。背景细胞中可见神经胶质细胞和成纤维细胞等。MAPⅡ免疫荧光染色后,荧光显微镜下可见神经元胞体和突起均呈红色,背景下可见少许非特异性染色,未见其他背景细胞着色(图1)。

图1 海马神经元培养与鉴定Fig.1 Culture and identification of hippocampal neurons
2.2 海马神经元BKCa通道的电流特点
保持钳制电压为-80mV,给予从-40mV 到+60mV 的脉冲刺激,阶跃电压为10 mV,可以引出一串幅值较大(nA)快速激活、几乎不失活的外向电流。随着测试电压的增大,BKCa电流幅值不断增大,并表现出外向整流的特性。给予选择性BKCa通道阻断剂CdCl2100μmol/L,可使BKCa电流显著减小,给药前后Id分别为(0.44±0.06)pA/pF 和(0.25±0.08)pA/pF,抑制率为(43.18±1.56)%(P<0.05,n=6),见图2、3。
2.3 不同浓度腺苷对海马神经元BKCa通道的影响
以细胞旁给药方式分别加入1、10、100μmol/L的腺苷后可以看到电流幅值较加药前增大,加药后的电流(Id)较加药前的增长幅度分别为(3.35±1.72)%(n=6,P<0.05),(8.87±2.91)%(n=7,P<0.05),(20.53±5.40)%(n=6,P<0.05),浓度越高,增长幅度越大。
2.4 100μmol/L腺苷对BKCa通道Ⅰ-Ⅴ曲线的影响
100μmol/L 腺苷可使BKCa通道Ⅰ-Ⅴ曲线上移,从图4可以看出,随着命令电压的增大,电流增长的幅度也加大,说明腺苷对BKCa电流的作用具有电压依赖性。但加药前后电流达到峰值的电位和电流持续时间没有明显改变(n=6,P<0.05)。
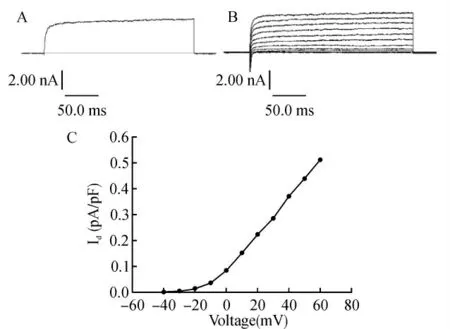
图2 海马神经元BKCa通道的电生理特性Fig.2 Electrophysiological properties of BKCachannels in hippocampal neurons

图3 CdCl2(100μmol/L)可显著降低BKCa通道电流Fig.3 Decreased current of BKCachannels by CdCl2(100μmol/L)

图4 腺苷(100μmol/L)对海马神经元BKCa通道的影响Fig.4 Effect of adenosine(100μmol/L)on BKCachannels in hippocampal neurons
2.5 100μmol/L腺苷对BKCa通道激活曲线的影响
以相应电压下电导与最大电导的比值对应阶跃刺激作图,以Boltzmann方程:G/Gmax=1/(1+Exp(-(V-V1/2)/K))拟合曲线,V1/2为50%最大激活时的膜电位(mV),K 为激活曲线的斜率,G 为各个膜电位下测定的电流值,V 为各膜电位。从拟合图形(图5)分析数据得出:腺苷使激活曲线负向漂移[对照组V1/2(16.50±2.33),K(1.11±0.98);腺苷组V1/2(9.83±1.20),K(1.04±0.60);n=6,P<0.05]。
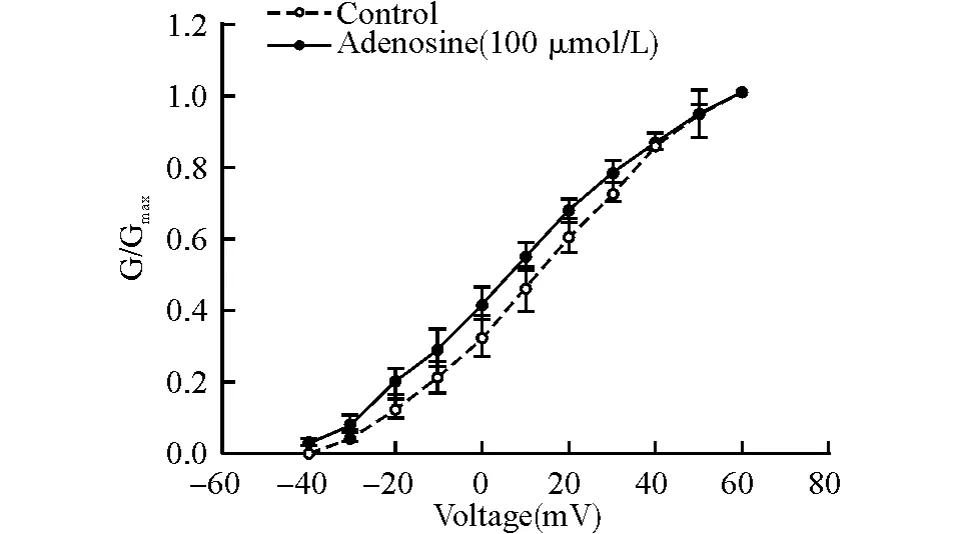
图5 腺苷(100μmol/L)使海马神经元BKCa通道激活曲线负向漂移Fig.5 Effect of adenosine at 100μmol/L on the activated curve of BKCain hippocampal neurons
3 讨论
实验证实在原代培养的SD 大鼠海马神经元上可以记录到BKCa通道电流,选择性BKCa通道阻断剂CdCl2可以显著抑制BKCa通道电流。腺苷(1、10、100μmol/L)可以增大BKCa电流,且具有浓度依赖性。腺苷(100μmol/L)可以电压依赖性增大BKCa电流,使BKCa电流的激活曲线负向漂移,即使通道激活加快。
BKCa与癫痫的联系非常密切,Du 等[6]观察到BKCaα亚基的突变可以导致全身性癫痫的发作。Brenner等[7]证实BKCaβ4亚基可以降低齿状回的兴奋性,防止颞叶癫痫发作。Huang等[8]用单通道和全通道记录方法证实唑尼沙胺的抗癫痫作用部分上是通过激活BKCa通道引起的。Shanley等[9]发现来普汀(一种体重调节药)可以通过磷酸肌醇激酶3激活BKCa通道来介导神经抑制作用。BKCa作为中枢神经系统的抑制性通道的认识越来越深入。原位杂交和放射配体技术表明BKCa通道mRNA 在脑中下列区域表达明显增高:大脑皮层、松果体、海马结构的颗粒和锥体细胞层。BKCa通道在脑中的分布可能与其在神经保护和神经递质传递中发挥作用有重要关系[10-11]。BKCa通道在调节神经元兴奋性中主要起以下几方面的作用:①参与神经元动作电位的复极化和超极化,影响动作电位的时程;②形成快后超极化电位(fAHP),影响神经元放电频率;③降低细胞缺氧和其他损伤情况下过多钙内流,避免钙超载;④减少兴奋性神经递质(谷氨酸)释放,降低神经细胞损伤[12-13]。BKCa通道开放时形成的钾离子内流以及对钙离子内流的负反馈作用,不仅降低了神经元的兴奋性放电,同时也可以起到神经保护作用。
Dunwiddie等[3]利用耐药性癫痫模型研究证实腺苷水平降低是促进痫样放电向癫痫持续状态演变的关键因素,本课题组之前的大量研究也发现慢性癫痫点燃模型腺苷受体表达明显降低,腺苷抑制系统作用的丧失导致癫痫发作持久存在。因此,研究腺苷的作用靶点对癫痫的治疗有很大的意义。研究证实,腺苷可以通过增加钾通道电导来降低突触前和突触后兴奋性信号传递,从而调节神经元兴奋和突触效能,这可能是其发挥抗癫痫作用的机制[14-16]。而BKCa通道作为形成静息膜电位和动作电位的重要通道可能参与了腺苷的调节机制,在大鼠主动脉内膜上已经证实腺苷作用于BKCa通道引起血管舒张[17]。
本实验首先在培养的第6~8天大鼠海马神经元上记录BKCa电流,其具有电压依赖性和钙激活特性,可被特异性钾通道阻断剂阻断,与文献报道相符[13]。在此基础上,选取腺苷3 个可能的有效浓度,证实腺苷可以增大BKCa电流,且在所选范围内有浓度依赖性。同时腺苷可使BKCa通道I-V 曲线上移,但不同的电压下电流增大的幅度不同,电压越大,电流增加的幅度越大,说明腺苷对BKCa电流的增大作用具有电压依赖性,但是腺苷的这种作用没有改变通道的激活电位及电流持续时间,推测腺苷可能是通过增加BKCa通道开放的数量来增加钾电导的。实验还证实,腺苷可以使激活曲线负向漂移,即激活加快,差异有显著性。上述结果说明BKCa可能是腺苷发挥抑制性作用的一个作用位点。腺苷系统有A1,A2,A3三种受体,放射自显影技术显示存在于神经系统海马部位的主要是A1受体,该受体与腺苷有高亲和力;动物实验也证实A1受体是腺苷发挥突触抑制,介导神经保护的主要受体[18-19];在大鼠主动脉内膜上,腺苷可作用于A1 受体通过cAMP依赖的PKA 使通道磷酸化,从而使BKCa通道构象改变,引发通道开放[17]。因此,我们推测腺苷可通过作用于海马神经元A1受体(cAMP-PKA途径)使BKCa通道开放引发一系列的保护效应。
[1] Schmidt D,Loscher W.Drug resistance in epilepsy:putative neurobiologic and clinical mechanisms[J].Epilepsia,200,46(6):858-877.
[2] Boison D.Adenosine as a modulator of brain activity[J].Drug News Perspect,2007,20(10):607-611.
[3] Dunwiddie T V.The physiological role of adenosine in the central nervous system[J].Int Rev Neurobiol,1985,27:63-139.
[4] Acsar E,Empson R M.Adenosine acting via Al receptors,controls the transition to status epilepticus-like behavior in an in vitro model of epilepsy[J].Neuropharmacology,2004,47(3):427-437.
[5] Shan H Q,Cheng J S.Effect of adenosine on adenosine triphosphate-sensitive potassium channel during hypoxia in rat hippocampal neurons[J].Neurosci Lett,2000,286(1):45-48.
[6] Du W,Bautista J F,Yang H,et al.Calcium-sensitive potassium channelopathy in human epilepsy and paroxysmal movement disorder[J].Nat Genet,2005,37(7):733-738.
[7] Brenner R,Chen Q H,Vilaythong A,et al.BK channelβ4 subunit reduces dentate gyrus excitability and protects against temporal lobe seizures[J].Nat Neurosci,2005,8(12):1752-1759.
[8] Huang C W,Huang C C,Wu S N.Activation by zonisamide,a newer antiepileptic drug,of large-conductance calcium-activated potassium channel in differentiated hippocampal neuronderived H19-7cells[J].J Pharmacol Exp Ther,2007,321(1):98-106.
[9] Shanley L J,O’Malley D,Irving A J,et al.Leptin inhibits epileptiform-like activity in rat hippocampal neurons via PI 3-Kinase-driven activity of BK channels[J].J Physiol,2002,545(Pt3):933-934.
[10] Kaczorowski G J,Knaus H G,Leonard R J,et al.High-conductance calcium-activated potassium channels,structure,pharmacology,and function[J].J Bioenerg Biomembr,1996,28(3):255-267.
[11] Knaus H G,Schwarzer C,Koch R O,et al.Distribution of high-conductance Ca2+-activated K+channels in rat brain:targeting to axons and nerve terminals[J].J Neurosci,1996,16(3):955-963.
[12] 赵鸿,杨文华,白祥军.大电导钾通道对脊髓神经元细胞内游离钙和兴奋性的影响[J].华中科技大学学报:医学版,2008,37(3):320-323.
[13] Ghatta S,Nimmagadda D,Xu X,et al.Large-conductance,calcium-activated potassium channels:structural and functional implications[J].Pharmacol Ther,2006,110(1):103-116.
[14] Haas H L,Greene R W.Adenosine enhances afterhyperpolarization and e accommodation in hippocampal pyramidal cells[J].Pflugers Arch,1984,402(3):244-247.
[15] Khazipov R,Congar P,Ben-Ari Y.Hippocampal CA1lacu-nosum-moleculare interneurons:comparison of effects of anoxia on excitatory and inhibitory postsynaptic currents[J].J Neurophysiol,1995,74(5):2138-2149.
[16] Katchman A N,Hershkowitz N.Adenosine A1antagonism increases specific form of glutamate release during anoxia,revealing a unique source of excitation[J].Hippocampal,1996,6(3):213-224.
[17] Ray C J,Marshall J M.The cellular mechanisms by which adenosine evokes release of nitric oxide from rat aortic endothelium[J].J Physiol,2006,570(Pt 1):85-96.
[18] Boison D.Adenosine and epilepsy:from therapeutic rationale to new therapeutic strategies[J].Neuroscientist,2005,11(1):25-36.
[19] Boison D.Adenosine kinase,epilepsy and stroke:mechanisms and therapies[J].Trends Pharmacol Sci,2006,27(12):652-658.

