TCAB1慢病毒表达载体的构建及其在人子宫内膜间质细胞中的表达
顾 林 史颖莉⋆ 倪 婕 陈 捷 李 瑛
1.南京医科大学附属南京妇幼保健院,江苏南京 210004;2.江苏省计划生育研究所,江苏南京 210029
TCAB1是人肿瘤细胞中近期发现的端粒酶蛋白组分,其表达缺失可使端粒酶复合物无法运送至染色体末端的端粒合成目的地,虽不影响端粒酶逆转录酶(hTERT)对自身携带RNA组分(hTR)的催化,但最终仍导致端粒形成受限。由于:①端粒机制与恶性肿瘤等细胞的增殖、迁移、侵袭属性密切相关[1-2];②内异症虽为良性疾病,其远处种植和生长特性却与恶性肿瘤类似[3]。笔者前期研究中通过基因芯片实验发现,TCAB1异常表达于内异症异位内膜组织,提示TCAB1可能通过端粒机制参与了内异症异位内膜的生长、侵袭等病理机制,并介导了在内异症形成中的作用。为进一步研究TCAB1功能及作用机制,笔者拟构建TCAB1的慢病毒表达载体。
1 材料与方法
1.1 实验材料
总RNA抽提试剂盒购自天根生化科技(北京)有限公司;PCR Taq酶购自TaKaRa公司;限制 性内切酶(EcoRI和NotI)购自NEB公司;感受态细胞TOP10实验室自备;Agarose Gel DNA Purification Kit Ver2.0、TA克隆试剂盒购自TaKaRa;逆转录试剂盒(SuperScriptRⅢFirst-Strand Synthesis System)购自invitrogen公司;测序委托上海英俊生物公司进行;慢病毒过表达载体(pLVX-IRES-ZsGreen)购自Clonetech公司;子宫内膜间质细胞株(St-T1b)购自ATCC。
1.2 TCAB1(WRAP53)全长基因TA克隆
1.2.1 引物设计 根据Genebank中报道的基因序列,应用软件设计TCAB1全长基因扩增引物(Invitrogen公司):primer-F:CGGAATTCCGGCCATGAAGA CTTTGGAGACTCAAC;primer-R:ATTTGCGGCCGCACC TTATATCAGCTCA CC ACACCT;上下游引物分别含有EcoRI和NotI酶切位点;PCR终产物大小为1 675 bp。
1.2.2 RT-PCR TRIzol法抽提人子宫内膜间质细胞总RNA,Nanodrop检测RNA浓度,1%变性琼脂糖凝胶电泳检测RNA完整性,如见清晰的18 S和28 S两条带,说明总RNA完整性较好。取1μg总RNA进行逆转录反应,PCR循环参数为:5℃冷却10 mim、50℃孵育50 min、85℃5 min终止反应。
1.2.3 目的基因片段扩增PCR 以巢式PCR技术将目的基因片段扩增,第一次PCR循环参数:95℃预变性5 min、94℃变性30 s、60℃退火30 s、72℃延伸90 s、72℃延伸10 min,共25个循环;第二次PCR循环参数同第一次PCR,共30个循环。凝胶扫描成像系统记录电泳结果。
1.2.4 PCR产物TA克隆 将PCR产物使用Agarose Gel DNA Purification Kit Ver 2.0回收,进行TA克隆,转化感受态细胞TOP10,使用含100 mg/mL氨苄抗生素的LB琼脂平板筛选转化子。挑取单个菌落,在含100 mg/mL氨苄抗生素的LB培养液中扩大培养,提取质粒并分别用EcoRI-HF和NotI-HF进行酶切鉴定,酶切成功送英俊公司测序。
1.3 TCAB1(WRAP53)慢病毒表达载体构建
将真核表达载体pLVX-IRES-ZsGreen1与测序成功的TCAB1-TA克隆用EcoRI和NotI双酶切,胶回收线性化载体和PCR目的产物,用T4DNA连接酶连接线性化载体和PCR纯化产物16°C过夜,转化感受态细胞top10,含100 mg/mL氨苄抗生素的LB琼脂平板筛选转化子。挑取单个菌落,在含100 mg/mL氨苄抗生素的LB培养液中扩大培养,提取质粒并分别用EcoRI和NotI进行酶切鉴定。
1.4 慢病毒包被
将HEK293T细胞(病毒包被细胞)均匀接种于培养皿中,待细胞融合度至70%左右时,转染慢病毒表达质粒与包被质粒,转染试剂与质粒比例(μg)为2.5∶1.0,慢病毒表达质粒与Pcgvp、Rev、Vsvg比例为1.5∶1.5∶1.0∶0.5,转染48、72 h后收取病毒上清,2 000 g离心10 min弃细胞碎片,上清经0.45μm滤器过滤后分装,-80℃冻存备用。
1.5 慢病毒感染子宫内膜间质细胞
传代培养人子宫内膜间质细胞株(St-T1b),将其接种于6孔板中(105/mL),待细胞融合度达60%左右时,加入病毒上清,同时加入终浓度5μg/mL的poly brene,培养72 h在荧光显微镜观察荧光表达情况以判断感染效率。
1.6 实时定量PCR检测过表达效果
收集感染过表达慢病毒的人子宫内膜间质细胞株,以空载慢病毒做对照。按照TRIzol试剂说明书提取细胞中总RNA,并进行逆转录反应,获得cDNA产物。以此cDNA为模板,在ABI 7500型实时定量PCR仪上进行实时定量PCR反应。引物序列为Sense:5′-cagccagacacctcctacg-3′,Anti-sense:5′-tgaatgcgtcccagatat-3′,Roche LNA probe:#66(CAGCAGCC);18s sense:5′-gcaattattccccatgaacg-3′,Anti-sense:5′-gggacttaatcaacgcaagc-3′,Roche LNA probe:#48(TTCCCAGT)。实时定量PCR反应体系为:Master Mix 10μL,cDNA 1μL,引物探针共1μL,双蒸水8μL,共20μL。扩增条件:预变性95℃2min后,95℃10s,60℃30s,70℃45s,重复40个循环。用△△CT法计算TCAB1的相对表达量。
2 结果
2.1 基因扩增结果
以基因组为模板进行PCR扩增,得到大小为1 675 bp的片段(图1),DNA测序证明扩增片段的核苷酸序列与Genbank中的TCAB1序列完全一致。
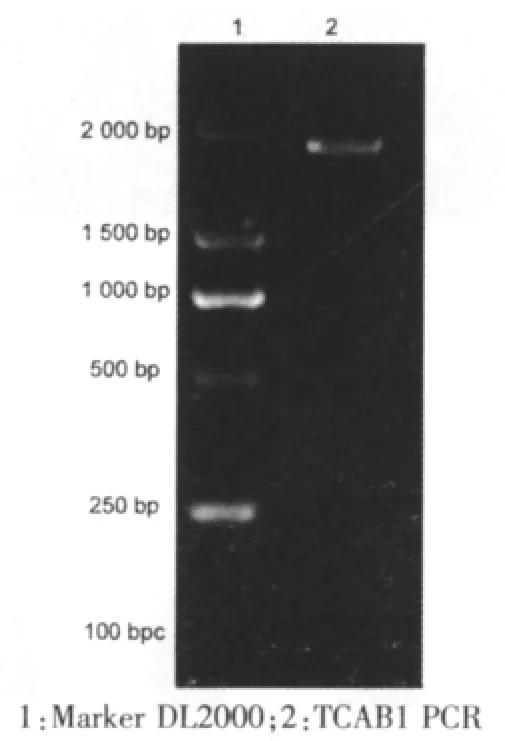
图1 目的基因TCAB1的PCR产物凝胶电泳分析
2.2 TA克隆鉴定
结果显示提取的质粒用限制性内切酶酶切后得到了与设定长度一致的TCAB1 cDNA片段,酶切成功送英俊公司测序,双向测通,经比对后,与Genbank比对后,无碱基突变。
2.3 TCAB1(WRAP53)慢病毒表达载体鉴定
构建慢病毒表达质粒,提取质粒并分别用EcoRI和NotI进行酶切鉴定,结果显示构建成功(图2)。
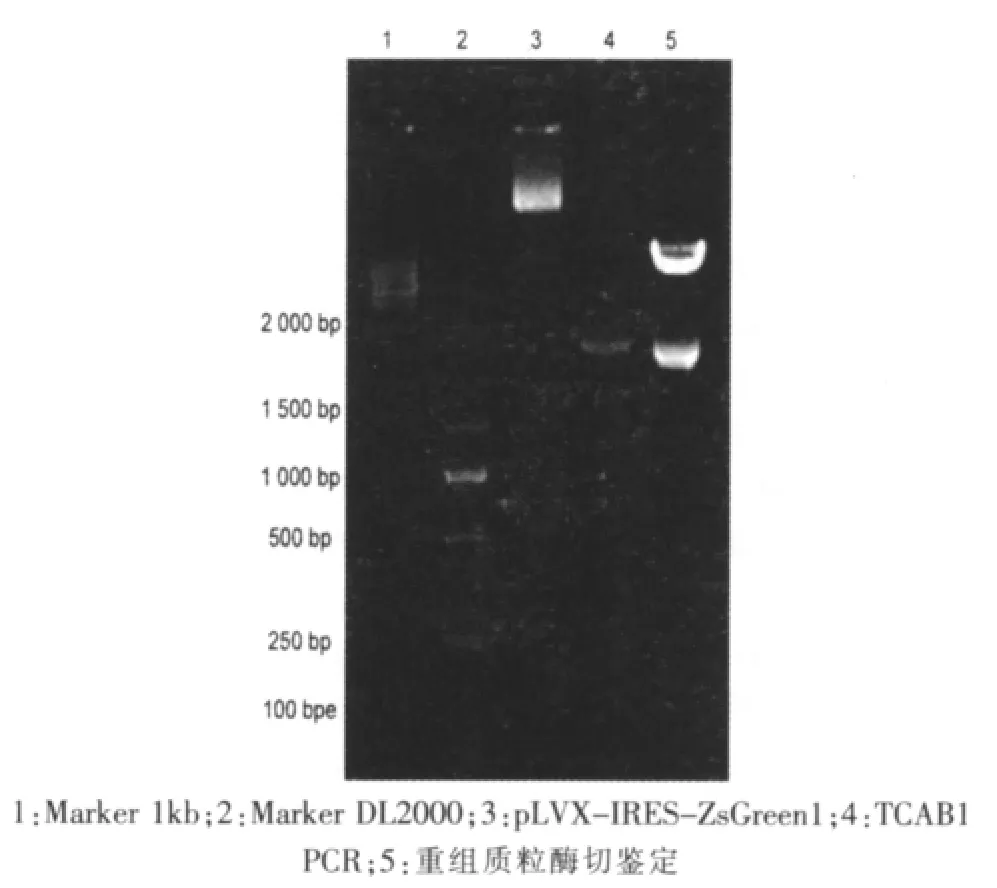
图2 慢病毒载体构建与酶切鉴定
2.4 检测TCAB1基因在St-T1b细胞中的过表达效果
荧光显微镜下观察:TCAB1基因重组慢病毒感染靶细胞后,可见较大比例的St-T1b表达绿色荧光(图3A),提示TCAB1慢病毒感染成功;实时定量PCR法检测结果提示:TCAB1基因重组慢病毒感染的细胞中TCAB1显著过表达(图3B)。证明TCAB1基因经重组慢病毒载体感染至St-T1b细胞后,能够在靶细胞中稳定持续表达。
3 讨论
TCAB1是端粒酶的新蛋白组分,它主要位于细胞核卡哈尔体内,控制端粒酶信号转导。进行生物信息学分析后发现,该基因(NM_001143990.1)mRNA全长1 837 bp,开放阅读框1 647 bp,编码548个氨基酸,预测分子量59.3 kDa;NCBI在线Blast Genome分析提示,TCAB1基因定位于染色体17p13.1;运用TMHMM2.0、SignaliP和WoLF PSORT等生物信息学工具分析其蛋白属性发现,其编码蛋白无跨膜区,可能位于胞浆内。TCAB1位于细胞核卡哈尔体内,控制端粒酶信号转导,与端粒形成密切相关[4]。已知TCAB1在多种肿瘤细胞中异常表达,能够促进细胞转移[5]。内异症具有类似恶性肿瘤的远处种植和生长特性,文献已证实内异症在位内膜组织中端粒酶活性与端粒长度高于正常内膜[6],但未见涉及TCAB1、端粒酶、端粒在内异症形成中功能研究的相关报道。由于TCAB1功能尚不是很清楚,因此构建该基因的过表达载体十分必要。
实现基因的过表达(gain of function)是基因功能研究的重要策略,其中慢病毒载体是基因表达的重要工具。慢病毒载体是以人类免疫缺陷Ⅰ型病毒为基础发展起来的基因治疗载体,该载体可以将外源基因有效地整合到宿主染色体上,从而达到持久表达。同时由于对分裂细胞和非分裂细胞均具有感染能力,对于干细胞和原代细胞研究具有重要意义。慢病毒的感染效率高、激发免疫反应的作用弱,而且目前没有证据表明其对宿主细胞有毒性作用或影响宿主细胞的活力。慢病毒表达载体感染后所获得的稳转细胞基因表达稳定、持续时间长,避免了瞬时转染每次试验均需重复操作的试验过程,而且也避免了瞬时转染时所需转染试剂对实验的影响。因此本实验选择慢病毒载体研究基因的工具。本实验选择的慢病毒表达载体是pLVX-IRES-ZsGreen1,ZsGreen1荧光蛋白可以作为包被及病毒感染时候的marker,可以方便的观察转染和病毒感染效率,也可以在后续研究中通过荧光筛选稳定表达株。本实验成功构建人TCAB1基因特异性的重组慢病毒过表达载体,且证实包被的慢病毒可实现TCAB1基因在人子宫内膜间质细胞株的过表达,为后续人TCAB1在人子宫内膜间质细胞的功能研究奠定了良好的实验基础。
[1]Goldblatt EM,Gentry ER,Fox MJ,et al.The telomerase template antagonist GRN163L alters MDA-MB-231 breast cancer cell morphology,inhibits growth,and augments the effects of paclitaxel[J].Mol Cancer Ther,2009,8(7):2027-2035.
[2]Huang W,Rha GB,Chen L,et al.Inhibition of telomerase activity alters tight junction protein expression and induces transtendo helial migration of HIV-1 infected cells[J].Am J Physiol Heart Circ Physiol,2010,298(4):1136-1145.
[3]Taylor RN,Yu J,Torres PB,et al.Mechanistic and therapeutic implications of angiogenesis in endometriosis[J].Reprod Sci,2009,16(2):140-146.
[4]Mahmoudi S,Henriksson S,WeibrechtⅠ,et al.WRAP53 is essential for Cajal body formation and for targeting the survival of motor neuron complex to Cajal bodies[J].PLoS Biol,2010,8(11):e1000521.
[5]Mahmoudi S,Henriksson S,Farnebo L,et al.WRAP53 promotes cancer cell survival and is a potential target for cancer therapy[J].Cell Death Dis,2011,2:114.
[6]Hapangama DK,Turner MA,Drury JA,et al.Endometriosis is associated with aberrant endometrial expression of telomerase and increased telomere length[J].Hum Reprod,2008,23(7):1511-1519.

