姜黄色素3种主要成分的分离纯化研究进展
赵会娟,刘红星,黄初升,黄可立
(广西师范学院化学与生命科学学院, 广西 南宁 530001)
姜黄色素3种主要成分的分离纯化研究进展
赵会娟,刘红星,黄初升,黄可立
(广西师范学院化学与生命科学学院, 广西 南宁 530001)
近年来,针对从姜黄中提取分离得到姜黄素的研究综述文章很多,但对分离得到3种单体姜黄色素的综述还未见报道。本文就近年来文献报道的对3种姜黄色素:姜黄素、脱甲氧基姜黄素、双脱甲氧基姜黄素的分离纯化研究作综述。
姜黄素;脱甲氧基姜黄素;双脱甲氧基姜黄素;分离研究
姜黄色素主要来源于中药姜黄的根茎(curcuma longa L),是姜黄中略带酸性的黄色酚性物质,是姜黄发挥药理作用的主要成分,具有抑菌[1]、抗病毒、抗氧化、保肝、利胆、降血脂、抗癌、抗艾滋病毒等作用[2],有较好的临床应用价值和研发潜力。姜黄色素主要包括了姜黄素(curcumin)、去甲氧基姜黄素(demethoxycurcumin)、去二甲氧基姜黄素(bidemethoxycurcumin),其结构式如图1所示,其中姜黄素是最重要的活性成分。姜黄色素类的3种化合物虽然结构相近,药理作用也基本上相似,但苯环上甲氧基数目的不同又使得3种化合物在抗癌、抗氧化作用等方面存在较大差异,如去甲基姜黄素抑制 TPA引起的癌细胞增生的效果最佳,其次为姜黄素;去二甲基姜黄素防止细胞脂质过氧化物形成的效果最佳,其次为去甲氧基姜黄素[3]。由于姜黄提取物—市售姜黄素通常为姜黄素、脱甲氧基姜黄素和双脱甲氧基姜黄素的混合物[4],3种化合物虽然结构相近,但结构上的微小差异又使它们在抗肿瘤、抗氧化作用等方面的能力有较大差异。为了得到姜黄色素类化合物的较纯的单品,必须对姜黄色素类化合物进行进一步的分离纯化。因此,分离3种姜黄素对于姜黄药材的鉴别、姜黄制剂的质量控制及对3种姜黄色素结果修饰改造等均具有重要意义。
近年来,对姜黄素的结构修饰及对姜黄素主要成分构效关系的研究是当今有机合成和药学研究的热点课题[5~6],而对姜黄色素主要成分的分离纯化是对姜黄素进行结果修饰和研究构效关系的前提。现代研究表明,脱甲氧基姜黄素和双脱甲氧基姜黄素也有广泛的药理作用,在某些活性方面甚至明显高于姜黄素,特别是双脱甲氧基姜黄素,表现出了广泛的药用前景[7]。而对分离3种姜黄色素的研究进展还未见报道,文献多报道从姜黄中提取和分离纯化姜黄素的方法研究进展。本文就近年来文献报道的分离和纯化3种姜黄色素成果的研究进展做一篇综述,着重对姜黄素中3种主要成分的分离纯化研究现状做介绍。
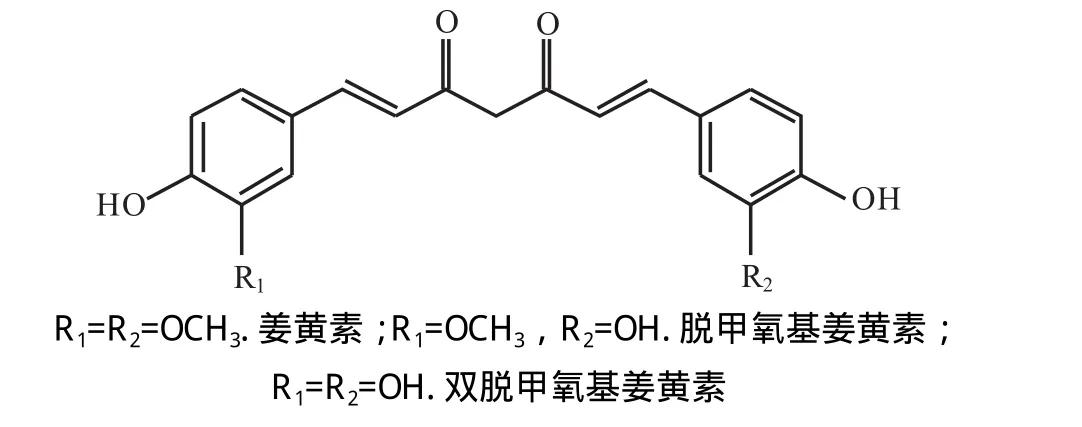
图1 姜黄色素的结构式
1 姜黄色素3种主要成分分离和纯化的方法
前人在对姜黄色素的3种主要成分的分离纯化方面做了很多工作,但大多数使用薄层色谱分离法和柱色谱法,而薄层色谱分离量小,柱色谱分离效果不理想,且不能实现一次过柱同时将3种主要色素成分同时很好地分离[8~9]。本文综述近些年来文献报道的几种不同的分离姜黄色素3种主要成分的方法,其中有通过分离得到3种化合物单体的,也有只对3种化合物含量进行测定的。
1.1 柱层析法
柱层析法是一种实验室常用且比较传统的分离方法,其分离效果的好坏取决于洗脱剂系统的选择。由于姜黄色素属于酚类物质,极性较大,且姜黄色素的3种主要成分结构极其相似,依次只相差1个甲氧基,从多种洗脱剂系统中很难选出优化的洗脱剂系统,也使柱层析法不能通过一次柱层析很好地分离出3种单体物质。柱色谱分离量大,但姜黄素在洗脱剂中溶解度小,会耗费大量溶剂,成本很高。
农克良,韦良兴等[10]通过对4种洗脱剂计算比移值Rf对比选出了优化洗脱剂系统,选择氯仿-乙酸乙酯-甲醇的三元体系体积比为38∶1∶1对姜黄色素进行梯度洗脱,得到3种纯色素的收率分别为:姜黄素45%,脱甲氧基姜黄素13%,双脱甲氧基姜黄素24%,纯色素的总收率达82%。Hemanta Chowdhury等[11]用苯和甲醇作洗脱液,利用柱层析法分离10g姜黄素粉末,分别得到了4.75g姜黄素、1.85g脱甲氧基姜黄素和1.15g双脱甲氧基姜黄素单体。李立,国大亮等[12]先利用干法柱层析分离得到双脱甲氧基姜黄素粗品及姜黄素、脱甲氧基姜黄素混合物,再经湿法柱层析洗脱而得到双脱甲氧基姜黄素,通过制备薄层色谱法分离得到姜黄素和脱甲氧基姜黄素粗品,经丙酮-水重结晶后分别得到姜黄素和脱甲氧基姜黄素。经测定,分离出的3种姜黄色素的熔点值与文献值一致且由高效液相色谱(HPLC)谱图测得3种纯度都超过96%。Hasse Bonde Rasmussen等[13]利用二氯甲烷∶乙酸乙酯依次从100∶0,98∶2,95∶5,90∶10进行梯度洗脱,1g姜黄色素得到了姜黄素685mg、脱甲氧基姜黄素169mg和双脱甲氧基姜黄素81mg。硅胶柱层析法虽然分离量大,但往往会需要大量的洗脱剂,造成浪费。
1.2 薄层色谱法
薄层色谱分离法也是一种很重要的进行快速分离和定性分析少量物质的实验室常用的分离方法,它也可以用来跟踪有机反应及进行柱层析分离之前的一种“预试”,为柱层析合适洗脱剂的选择做指导。薄层色谱法可以有效分离3种姜黄色素类物质,得到高纯度的3种化合物的单体,但薄层色谱法只能用于少量姜黄色素的分离,不能满足对大量姜黄色素分离的要求。
聂小安,马自超等[14]利用20×20的制备型硅胶板,用氯仿∶乙醇(25∶1)作为展开剂,跑板后得3条明显的桔黄色谱带,分别用丙酮洗脱,并对3种浓缩后的洗脱液依次用甲醇、丙酮、甲醇进行结晶,结晶后依次得到了姜黄素、脱甲氧基姜黄素和双脱甲氧基姜黄素的单体,经对3种单体红外、紫外、氢谱数据的分析,确定为3种姜黄素类化合物。L.Peret-Almeida,A.P.F.Cherubino等[15]在60G的硅胶板上通过对多种溶剂进行筛选。得出用二氯甲烷∶甲醇(99∶1)作为展开剂分离效果比较好,分离出的单体纯度也很高。板层析法分离效果很好,但仅适用于少量样品的分离,不能满足大量分离的要求。
1.3 大孔吸附树脂法
大孔吸附树脂是一种不溶于酸、碱及各种有机溶剂的有机高分子聚合物,通常依其极性分为非极性、弱极性、极性,它是被广泛应用于天然产物分离的一种分离方法,工作过程中影响因素少,工序简单,操作简便;提取率高,去除杂质能力强;适用于工业化生产[16]。大孔吸附树脂在分离3种姜黄色素化合物的过程中化合物间的交叉较少,溶剂消耗也少,可以满足大量工业化的对姜黄色素类化合物的分离。
陈敦国,罗瑾等[17]以静态吸附、解吸附等参数对DA201、DS401、D101A、DM301、D101等大孔吸附树脂吸附分离纯化姜黄素进行评价,从而筛选出了姜黄素的精制工艺中分离纯化效果最好的大孔吸附树脂,DM301型吸附树脂具有吸附量大,易解吸等优点,优于其他几种树脂。中国专利CN 101585757A公开了一种姜黄素、脱甲氧基姜黄素和双脱甲氧基姜黄素的制备方法,该发明采用吸附树脂HZ-816、HZ-818或HZ-801作为层析分离介质,醇水作为洗脱溶剂的工艺,得到了姜黄素、脱甲氧基姜黄素和双脱甲氧基姜黄素3种单体化合物,各单体化合物纯度达95%以上。该工艺流程简短,分离过程中3种化合物间交叉较少[18]。美国专利US 6224877用水杨酸钠溶液提取总姜黄素,得到了纯度为90.11%的总姜黄素,但提取过程要求多级纯化,使用的溶剂量大,损耗大,且得不到各单体化合物[19]。彭永芳等[20]研究了用大孔树脂吸附和分离水溶性姜黄素,选用X-5树脂作吸附剂,洗脱剂用80%的乙醇,产品质量好,树脂也很稳定,使用十几次后,吸附率仅降低了3.69%,认为该工艺对水溶性姜黄色素的提取效果较好。大孔吸附树脂法分离量很大,操作简便,成本低,可用于工业生产。
1.4 HPLC高效液相色谱法
高效液相色谱简便、快速、准确度高、分离效能高、应用范围广、灵敏度高,对姜黄色素3种主要成分进行分离,得到的单体纯度可以高达99%,但高效液相的分离量少,主要用于少量姜黄色素类化合物的分离或用于姜黄色素3种单体含量的测定。
王政等[21]应用C30-HPLC-PDA色谱,在乙腈和水的线性梯度洗脱条件下,姜黄素、脱甲氧基姜黄素和双脱甲氧基姜黄素3个组分得到了较好的分离,并根据各组分的色谱行为和光谱特征分析,鉴定确为该3种组分。S.J.Taylor等[22]和刘硕谦等[23]都提出了一种反相高效液相色谱法,该方法可以简便、快速、准确地同时完成对姜黄块根中3组分含量的分离测定。Wisut Wichitnithad等[24]研究了一种HPLC-UV联用的方法,可以同时、快速、简便、定量地分析出3种姜黄色素的单体在姜黄提取物中的含量。但HPLC法不适合做大量物质的分离,多用于化合物含量的测定和分析。
1.5 HSCCC高速逆流色谱
高速逆流色谱(high-speed countercurrent chromatography,HSCCC)是 20 世纪 80 年代发展起来的一种连续高效的液-液分配色谱分离技术,90年代以来,高速逆流色谱被广泛应用于天然药物成分的分离制备和分析检定中。它具有高效、快速、制备量大、费用低的优点,并且样品可以全部回收。这种方法已经被用于分离很多种天然产物,纯度可以达到工业大规模生产的标准[25]。高速逆流色谱法在分离天然产物方面被认为是简单、高效、低成本的分离方法[26~27],在天然产物分离方面有很大的应用前景。姜黄作为一种天然产物,在利用高速逆流色谱法对姜黄色素进行分离时,也显示了高速逆流色谱的优势和前景。
Koichi Inoue等[28]以姜黄粉末为原料,应用高速逆流色谱(HSCCC)技术,通过对制备分离方法和溶剂系统的筛选,采用溶剂系统正己烷-氯仿-甲醇-水,分离得到了3种姜黄素化合物单体,并且纯度都大于98%。但HSCCC的进样量必须控制在一定的浓度范围内,进样量太大则峰型加宽,纯度下降,进样量太小,则单次分离率太少,只能选择20~50mg,而最大的优点在于它是无载体的分离,所以不存在载体的吸附,对样品的利用率非常高,对天然产物的分离具有很大的优势,具有非常广阔的应用前景[29]。
2 小结
近年来,姜黄素已成为国内外研究的热点。姜黄素作为一种低毒、分子量小、毒副作用小、价廉易得的天然产物,曾被认为是理想的抗癌药物之一。随着人们对姜黄素及其衍生物研究的逐步加深,姜黄素的药理活性和生物活性也逐渐被人们发现和认可,姜黄已被列为第三代癌化学预防药,美国国立癌症研究所已经用姜黄进行Ⅰ期临床试验[30]。对姜黄素抗癌特性继续全面而深入的研究,使其有望被开发成一种新型、高效、低毒的抗癌药物[31]。近年来因其具有抗肿瘤、免疫调节、抗动脉粥样硬化、抗氧化作用[32~33],更是引起国内外学者的重视,姜黄素也表现出巨大的发展潜力。
综述近些年来的姜黄色素中3种主要成分的分离纯化方法,从中可以发现,国内外学者对姜黄素的分离纯化及其对它的结构修饰研究颇多,而对脱甲氧基姜黄素和双脱甲氧基姜黄素的分离纯化研究不多,且柱层析法和薄层色谱作为传统的分离方法,设备简单、廉价、方便,从而被大众接受和使用,更适合在实验室条件下使用。大孔吸附树脂法比较适合工业化生产,现在大多数工厂为了实现对姜黄色素的分离主要采用该种方法。而对高效液相色谱和高速逆流色谱法用于姜黄色素的分离报道甚少。这主要与高效液相色谱和高速逆流色谱设备比其他3种分离方法的设备昂贵、使用寿命有一定的局限性有很大的关系。总的来说,以上提出的不同的分离姜黄色素的方法都比较通用,操作上也都很简便,由于分离设备及方法的不同,各显示出了一些优缺点,因此,可以根据实验的条件和目的来选择所需要的合适的分离方法。在研究和评价姜黄色素的分离纯化方法的同时,也为人们对脱甲氧基姜黄素和双脱甲氧基姜黄素的研究奠定了基础。
[1] Ramendra K.Singh, Diwakar Rai,DiptiYadav, et al.Synthesis,antibacterial and antiviral properties of curcumin bioconjugates bearing dipeptide,fatty acids and folic acid [J].Eur.J.Med.Chem. 2010, 45:1078-1086.
[2] 韩婷, 宓鹤鸣.姜黄的化学成分及药理活性研究进展[J].解放军药学学报, 2001, 17 (2):95- 97.
[3] RASMUSSENC, KV ISIL K, et al. A simple and efficient separation of the curcumins, the antiprotozoal constituent of Curcuma longa[J]. Planta Med, 2000, 66:396-397.
[4] 杨企静, 刘桂敏.反相高效液相色谱法测定姜黄素含量[J].中草药, 1995(2):76-94.
[5] Ruby John Anto, Josely George, et al. Antimutagenic and anticarcinogenic activity of natural and synthetic curcuminoids[J].Mutation Research, 1996, 370:127-131.
[6] Joong Sup Shim, Dong Hoon Kim, et al. Hydrazinocurcumin,a Novel synthetic curcumin derivative,is a potent Inhibitor of Endothelial Cell proliferation[J]. Bioorganic & Medicinal Chemistry, 2002, 10:2987-2992.
[7] 李剑明,杨和平,等.双脱甲氧基姜黄素的提取、纯化与鉴定[J].中国新医药,2004, 3(5):21-23.
[8] 刘保启,胡孝忠,等.姜黄素的提取、分离和测定[J].中华国际医学杂志,2003,(2):183-184.
[9] 黄宇,樊艳茹,等.姜黄素的分离方法改进研究[J].广州化工,2011,39(18):49-50.
[10] 农克良,韦良兴,等.姜黄色素的简易提取与柱色谱分离研究[J].化工技术与开发,2006,35(2):3-5.
[11] Hemanta Chowdhury, Suresh Walia et al. Isolation,characterization and inset growth inhibitory activity of major tuemeric constituents and their derivatives against Schistocerca gregaria(Forsk) and Dysdercus koenigii(Walk)[J]. Society of Chemical Industry, 2000, 56:1086-1092.
[12] 李立,国大亮,等.姜黄素类物的提取、分离及精制[J].天津中医药,2010,27(6):509-511.
[13] Hasse Bonde Rasmussen, Soren Brogger Christensen, et al. A Simple and efficient separation of the curcumins,the antiprotozoal constituents of curcuma longa[J]. Planta Medica, Letters, 2000, 66:396-398.
[14] 聂小安,马自超,等.姜黄色素的分离及其结构鉴定[J].中国野生植物资源, 1993, (3):1-7.
[15] L.Peret-Almeida, A.P.F.Cherubino, et al. Separation and determination of the physi-cochemical characteristics of curcumin , demethoxycurcumin, bisdemethoxycur curmin[J]. Food Research International, Science Direct.,2005, 38:1039-1044.
[16] 王健,林毅,等.大孔吸附树脂提取分离去甲基万古霉素的工艺研究[J]. 化学与生物工程,2010, 27(5):76-79.
[17] 陈敦国,罗瑾,等.分离纯化姜黄素的大孔树脂的筛选[J].湖北中医学院学报,2010,12(3):42-44.
[18] 王辉,等.一种姜黄素、脱甲氧基姜黄素和双脱甲氧基姜黄素的制备方法[P].CN 101585757A, 2009-11-25.
[19] Vilas Gajanan Gaikar, Deepak Vijay Dandekar. Process for extraction of curcuminoids from curcuma species[P]. US 6224877, 2001-05-01.
[20] 彭永芳,马银梅,等.水溶性姜黄色素提取工艺的优化[J].食品科学, 2001, 22(9):40-42.
[21] 王政,惠伯棣,等.姜黄中姜黄素的C30-HPLC-PDA分离[J].食品科学,2006,27(11)241-243.
[22] S.J.Taylor, I.J.McDowell, et al. Determination of curcuminoid Pigments in Turmeric (curcuma domestica Val) by Reversed-Phase High-Performance Liquid Chromatography[J].Originals, Natural Resources Institute,1992,34:73-74.
[23] 刘硕谦,刘仲华,等.反相高效液相色谱法同时测定姜黄药材中3个组分的含量[J].分析化学, 2005, 33(3):309-312.
[24] Wisut Wichitnithad, et al. A Simple Isocratic HPLC Methord for the simultaneous Determination of Curcuminoids in commercial Turmeric Extracts[J]. Phyto che-mical Analysis,2009, 20:314-319.
[25] Sutherland, I .A. Recent progress on the industrial scaleup of counter-current chromatography[J].J. Chromatogr A,2007, 1151:6-13.
[26] Koichi Inoue, Chihiro Nomura, et al. Purification of curcumin,Demethoxycurcu-min and Bisdemethoxycurcumin by High-Speed CountercurrentChromatography[J]. J.Agric.Food Chem,2008, 56:9328-9336.
[27] 李静,等.用高速逆流色谱技术分离纯化莪术中的姜黄素[J].华东理工化学学报, 2005,31(5):681-683.
[28] OdotJ, A Ibert P, CarlierA, et al. In vitro and in vico antetumoral effect of curcumin in againstmelanoma cells [J].IntJ Cancer, 2004,111(3):381-387.
[29] 琚辉,郝存江,等.姜黄素固体脂质纳米粒的制备及表征[J].药物评价研究,2010,33(6):420-423.
[30] Aratanechemugei Y, et al. Selective induction of apoptosis by arturmerone isolated from turmeric (Curcuma longs L) in two human leukemia cell lines,but not in human stomach cancer cell line[J]. Intern. J. of Mol Med., 2002(9): 481-484.
[31] Selvam C,Jachak SM, ThilagavathiR,et al. Design,synthesis,biological evaluation and molecular docking of curcumin analogues as antioxidant,cyclooxygenase in-hibitory and antiintlamttsatoty agents[J]. Bioorg, Medic. Chem.Letters,2005, 15(3):525-531.
[32] Marston,A.; Hostettmann,K. Developments in the application of counter-current chromatography to plant analysis[J].J.Chromatogr. A,2006, 1112:181-194.
[33] Ito,Y. Golden rules and pitfalls in selecting optimum conditions for high-speed counter-current chromatography[J].J. Chromatogr A, 2005, 1065:145-168.
Research Progress of Separation and Purification of Three Main Components in Turmeric Pigment
ZHAO Hui-juan, HUANG Chu-sheng, LIU Hong-xing, HAUNG Ke-li
(Institute of Chemistry and Life Science, Guangxi Teachers Education University, Nanning 530001, China)
In recent years, there were many research articles about the separation of curcumin from turmeric, but there was not a review to report the separation of three monomers from turmeric pigment. This paper reported a review for separation and purif i cation of the three turmeric pigment: curcumin, demethoxycurcumin and bisdemethoxycurcumin in the literature in recent years.
curcumin; demethoxycurcumin; bisdemethoxycurcumin; separation research
R 284.2
A
1671-9905(2012)07-0043-04
广西教育厅科研资助项目[桂教科研(2010)14]
2012-04-13

