发动蛋白对心脏收缩-频率反应的调控作用
叶江川,刘 班,李 俊,陈义汉
(1.同济大学医学院,上海 200092;2.同济大学心律失常教育部重点实验室,上海 200120)
发动蛋白(dynamin,DNM)是一类生物进化上高度保守的大鸟苷三磷酸酶(large GTPase)分子家族。DNM参与广泛的细胞功能,包括网格蛋白介导的内吞、线粒体融合与分裂、顺式高尔基网状系统运输、胞质分裂以及相关信号转导过程[1]。DNM1主要定位于中枢神经系统;DNM2在体内广泛表达;DNM3主要在睾丸表达,少量分布于神经元。DNM有5个功能性结构域:GTP酶结构域、中间结构域、GTP酶效应结构域(GTPase-effector domain,GED域)、PH 结构域(pleckstrin homology domain,PH 域)以及富含脯氨酸的结构域(Prdine rich domain,PRD域)[2]。其中,GTP酶结构域是DNM 的酶活性结构域,对于GTP的结合及水解是必需的。最近的研究证明,果蝇的DNM同源基因Shibire突变后造成心脏二联律的发生,提示DNM与心脏功能之间存在潜在联系[3]。
心脏的收缩-频率反应(force-frequency response,FFR)是心肌收缩的内在调节机制,即生理情况下,心脏收缩随心率升高而增强。研究表明,正常FFR的受损或缺失是慢性心力衰竭的重要特征之一[4]。本研究拟采用重组腺病毒介导的基因导入技术,在成年大鼠心室肌细胞中对DNM2蛋白进行操纵,分析细胞对频率变化的收缩反应,并观察DNM2的药物抑制对离体心脏FFR的影响,揭示DNM2在心脏FFR中的作用及其细胞学机制。
1 材料与方法
1.1 实验动物
清洁级雄性 Sprague-Dawley大鼠,体质量250~300 g,上海西普尔必凯实验动物公司提供。
1.2 主要试剂
Fura 2-AM购自美国 Molecular公司;选择性CaMKⅡδ抑制剂KN-93、AIP及DNM 活性抑制剂Dynasore均购自美国Sigma公司;anti-PLB-pThr17抗体、anti-CaMKⅡδ抗体购自美国Santa Cruz公司,anti-DNM2抗体购自英国 Abcam公司,anti-PLB-pSer16抗体购自英国Badrilla公司,anti-CaMKⅡδ-pThr287购自美国 Millipore公司,anti-GAPDH抗体购自美国GST公司,化学发光试剂盒购自美国Pierce公司。
1.3 溶液配制
台式液(mmol/L):NaCl 136.9,KCl 5.4,CaCl22,MgCl21,NaH2PO41,Hepes 10,Taurine 10,D-glucose 11.1,NaOH调节pH至7.35~7.45。RIPA(中)缓冲液(mmol/L):Tris 50,NaCl 150,Na2-EDTA 1,NaF 2,Na3VO40.2,1%Triton X-100,1%Sodium Deoxycho-late,1 × protease inhibitor cocktail,NaOH调节pH至7.4。Krebs-Henseleit(KH)缓冲液(mmol/L):NaCl 118,KCl 4.7,MgSO41.2,CaCl22.5,KH2PO41.2,NaHCO325,D-glucose 11,NaOH调节pH至7.4。
1.4 方 法
1.4.1 重组腺病毒的构建及扩增 突变型(K44A)DNM2的cDNA序列从ATCC网站获得(DNM2K44A:MBA-95,http:∥www.atcc.org)。使用BP Clonase enzyme mix将上述序列分别克隆进pAd/CMV/V5-DEST载体,产生重组质粒 pAd/CMV/V5-DEST-DNM2K44A(pAd-DNM2-K44A)。重组质粒线性化并回收纯化后,用Lipofectamine 2000TM将其转染生长密度近90%的人胚胎肾细胞系293(HEK293)细胞。观察细胞状态,待病毒斑出现并且80%~90%的细胞崩解脱落时,收获病毒液。将纯化的病毒液在HEK293细胞中扩增,经浓缩、滴度测定后,用定量PCR方法检测目的基因表达情况。
1.4.2 成年大鼠心室肌细胞的分离培养及腺病毒转染 采用经典的酶解法分离成年大鼠心室肌细胞[5]并用199培养基进行无血清培养。在培养基中按照MOI=100加入携带突变型DNM2或GFP基因的重组腺病毒(Adv-DNM2K44A或Adv-GFP)配制成病毒培养基。Adv-GFP用作Mock阴性对照。将原有心肌细胞培养液弃去,加入最小体积的病毒培养基,置于37℃、5%CO2培养箱中。4 h后,将病毒培养基废弃,加入正常体积的199培养基。用免疫印迹法检测DNM2过表达情况以评估转染效率。
1.4.3 心肌细胞收缩及钙瞬变检测 将转染24 h的心肌细胞(部分实验用 1 μmol/L KN-93或20 μmol/L AIP预处理细胞1 h)置于洁净的灌流槽中,用32℃台式液全程灌流。为诱发细胞收缩,用一对平行铂电极对细胞施加频率0.5 Hz、脉宽5 ms、强度15 V的场刺激。选取长杆状、横纹清楚且无自发收缩的细胞,用钙-收缩检测系统(Milton,美国)记录肌节长度变化。为指示胞内Ca2+,用1 μmol/L钙敏感染料Fura-2 AM 37℃避光负载细胞30 min,台式液洗3遍并静置20 min后,记录细胞钙瞬变;设置Fura-2 AM的激发波长为340 nm和380 nm,用对应的荧光强度之比表示细胞钙水平。采集的信息通过IonWizard 6.0软件记录分析。
1.4.4 免疫印迹 用RIPA(中)缓冲液裂解转染24 h后的心肌细胞,收集蛋白裂解产物。在裂解物中加入Laemmli上样缓冲液,95℃变性5 min后在4%~20%的梯度胶上分离。将蛋白以湿转方式转印至PVDF膜上,用5%脱脂牛奶室温封闭1 h,加入一抗,4℃孵育过夜。将膜取出并洗涤后,在常温下与辣根过氧化物酶标记的二抗共同孵育1 h,用化学发光法显影曝光。蛋白条带的密度值用Quantity One软件分析。
1.4.5 离体心脏FFR测量 大鼠麻醉后迅速取出心脏置于Langendorff装置上,用37℃ KH缓冲液行主动脉逆行灌流。将连接压力转换器的乳胶球囊插入左心室以测量心室内压,并在左心房和右心室各放置一枚刺激电极。在KH液中平衡15 min后,以0.5 Hz(300次/min)频率起搏心脏。待心搏稳定5 min后,在灌流液中加入Dynasore(20 μmol/L,溶于DMSO)并一直维持至实验结束。为观察离体心脏FFR,将刺激频率提高为2 Hz(450次/min),至少持续30 s。Powerlab数字化仪(AD公司,澳大利亚)观察记录左室压力变化。用Lab Chart 7软件进行数据分析。
1.5 统计学分析
2 结 果
2.1 重组腺病毒介导的DNM2活性抑制
蛋白印迹法显示DNM2K44A在心肌细胞中得到了高效表达(图1)。DNM2K44A由于GTP酶结构域上一个关键氨基酸的替换(K44A),使其丧失了GTP 酶活性[6],因此过表达 DNM2K44A能抑制DNM2活性。

图1 腺病毒介导的DNM2K44A 过表达Fig.1 Adenovirus-mediated DNM2K44A overexpression n=3,与 Mock组比较,(1)P<0.01
2.2 DNM2缺陷导致心肌细胞FFR损伤
Mock细胞在0.5 Hz起搏频率下的肌节缩短分数(fractional shortening,FS)为(8.9±2.3)%(n=20 cells),当频率增加至2 Hz时,其FS变为(13.1±1.2)%(P<0.05,正常 FFR);然而,DNM2K44A细胞的FS 在0.5 Hz下为(13.5±2.1)%(n=26 cells),频率升高为2 Hz时仅为(13.2±2.0)%,见图2A和2C。DNM2K44A过表达虽然增强了基础频率下的细胞收缩(P<0.05),但却降低了收缩储备,导致FFR减弱或消失。
心肌细胞的收缩幅度主要受钙瞬变的强度和持续时间影响[7]。在FFR中,FS的频率依赖性变化伴随着钙瞬变大小的改变。Mock细胞在2 Hz下的钙瞬变峰值较0.5 Hz增加了12.0%(n=20 cells,P<0.05),而 DNM2K44A仅增加了 1.5%(n=26 cells),见图2B和2D。提示DNM2失活引起的FFR损伤与钙瞬变频率依赖性的变化失调有关。
2.3 DNM2缺陷对PLB磷酸化与CaMKⅡδ活性的影响
为了考察DNM2失活引起的FFR损伤是否与PLB磷酸化相关,本研究分别检测了在0.5 Hz和2 Hz起搏频率下心肌细胞的PLB磷酸化水平。如图3A和3C所示,Mock细胞在2 Hz下的 PLB Thr17位点磷酸化水平较0.5 Hz明显增高(P<0.05),而DNM2K44A细胞则没有这种差异。值得注意的是,DNM2K44A细胞在0.5 Hz下的 PLB Thr17位点磷酸化水平较Mock细胞升高(P<0.05)。另外,PLB总蛋白及 Ser16位点磷酸化既无频率依赖性的变化,亦无组间差异。

图2 DNM2缺陷引起心肌细胞FFR损伤Fig.2 Impaired cardiomyocyte FFR induced by deficiency of DNM2
CaMKⅡδ对PLB的磷酸化修饰在心脏FFR的调节中起重要作用。本研究检测了0.5 Hz和2 Hz起搏频率下心肌细胞的CaMKⅡδ活性(Thr287位点磷酸化水平),发现DNM2K44A过表达导致CaMKⅡδ Thr287位点磷酸化水平在0.5 Hz下较Mock细胞增高(P<0.05),但在2 Hz刺激时保持不变;而Mock细胞的CaMKⅡδ Thr287位点磷酸化发生了频率依赖性的变化(P<0.05,图3B和3D)。
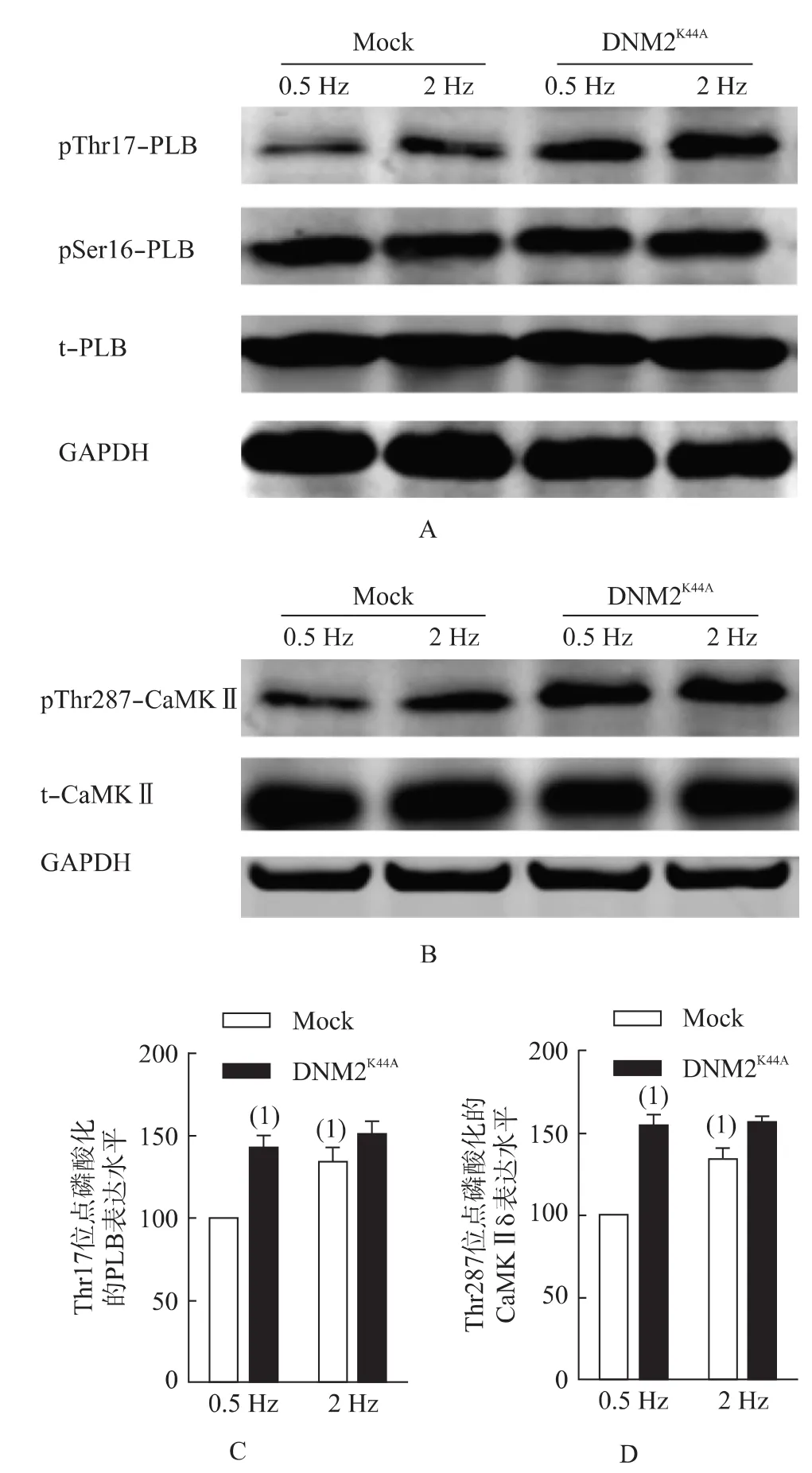
图3 PLB与CaMKⅡδ的表达及磷酸化变化Fig.3 Expression and phosphorylation of PLB and CaMKⅡδ
2.4 CaMKⅡδ抑制剂对心肌细胞FFR的影响
选择性CaMKⅡ抑制剂KN-93降低了DNM2K44A细胞0.5 Hz和2 Hz下的FS和钙瞬变峰值(DNM2K44A:n=21 cells;DNM2K44A+KN-93:n=25 cells;DNM2K44A+AIP:n=23 cells;P<0.05),并使DNM2K44A细胞恢复了频率依赖性的FS增长和钙瞬变变化(P<0.05),提示FFR阳性(图4)。另外,用AIP处理心肌细胞得到了类似的结果。这些结果说明,药物抑制CaMKⅡδ活性能逆转DNM2缺陷诱导的FFR损伤。
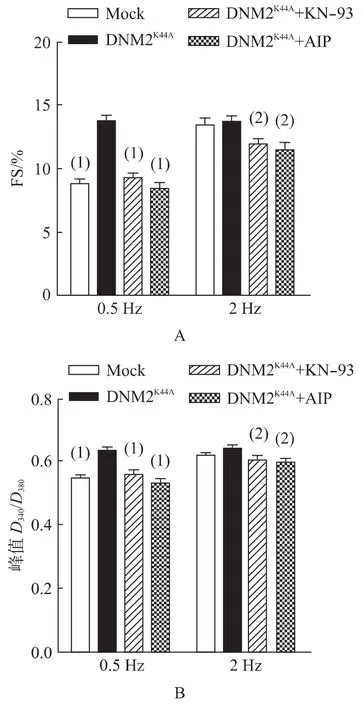
图4 药物抑制CaMKⅡδ活性对心肌细胞FFR的影响Fig.4 Effects of pharmacological inhibition of CaMKⅡδ activity on cardiomyocyte FFR
2.5 DNM2活性抑制对离体心脏FFR的影响
DNM2缺陷与心肌细胞FFR损伤有关,为了在器官层面上验证DNM2对FFR的作用,本研究采用含Dynasore(DNM的GTP酶活性抑制剂)的KH液对离体心脏进行灌流并观察其FFR。结果显示,对照组心脏(用DMSO处理)在450次/min起搏频率下的收缩力(dP/dtmax)较300次/min增加了(53±3.3)%(n=13),而Dynasore处理组仅增加了(12±2.8)%(n=15),见图 5。因此,Dynasore介导的DNM2抑制削弱了离体心脏FFR。
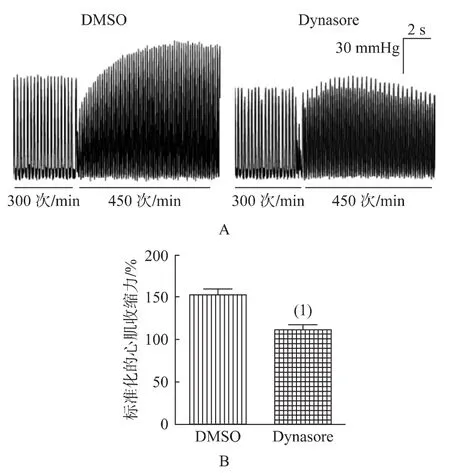
图5 DNM2活性抑制对离体心脏FFR的影响Fig.5 Effects of DNM2 inhibition on ex vivo FFR
3 讨 论
心输出量由每搏输出量和心率决定。当心率加快(如运动时),心脏收缩必须随之加强,以弥补舒张期充盈减少,保证足够的心输出量。频率升高引起L型钙通道(L-type calcium channel,LTCC)依赖的Ca2+内流增多,同时舒张期的缩短使Ca2+排出减少,最终导致胞浆和肌质网Ca2+水平增高、肌节收缩加强,这是正常阳性FFR的主要细胞学机制[4]。研究表明,PLB依赖于CaMKⅡδ活性的Thr17位点磷酸化随频率升高而增强[8],上调的PLB磷酸化促进肌质网Ca2+释放和肌节收缩。PLB频率依赖性的磷酸化改变是心脏FFR的内源性机制之一。本研究发现,DNM2对于心脏FFR是必需的,DNM2失活引起的FFR损伤与CaMKⅡδ活性上调和PLB磷酸化增强有关。
DNM2是细胞内囊泡转运的多能性调节分子。DNM2的正常活性可调控LTCC从细胞膜向胞浆的运输[9],DNM2 功能缺失(DNM2K44A过表达)将引起LTCC 在细胞膜的滞留。Muth 等[10]和 Chen 等[11]报道,LTCC α1c或β2a亚基膜表达上调可引起微小的持续性Ca2+内流,导致胞浆和肌质网钙超载。在基础频率下,DNM2K44A细胞膜LTCC的分布增多促进了Ca2+进入胞浆,提高了胞浆和肌质网钙含量;肌质网高钙负荷使钙瞬变增加,细胞收缩增强,FS升高。由于胞浆和肌质网Ca2+水平在基础频率时已经显著升高,DNM2K44A细胞的频率依赖的钙上调机制作用减弱,导致高频刺激下钙瞬变和肌节收缩无法进一步增强,形成FFR损伤。不仅如此,在Mock细胞中,频率依赖的、CaMKⅡδ活性介导的 PLB Thr17位点磷酸化增强促进了SERCA2a开放,使舒张期Ca2+回吸收增加,肌质网Ca2+水平升高,钙瞬变和肌节收缩增强(正常FFR);DNM2功能抑制使得PLB Thr17位点的磷酸化在基础频率下已达“饱和”状态,频率升高并不能使其进一步增强(图3A和3C),因而促成了FFR损伤。
CaMKⅡδ活性在DNM2K44A细胞中是上调的(图3B和3D),药物抑制CaMKⅡδ可验证CaMKⅡδ活性在DNM2缺陷诱导的FFR损伤中的作用。应用KN-93可逆转DNM2失活引起的FFR损伤(图4)。由于KN-93存在一些非特异性药理作用(如抑制钾通道等),用特异性更强的 AIP处理DNM2K44A细胞,得到了与KN-93类似的结果(图4)。在DNM2K44A细胞中,药物介导的CaMKⅡδ抑制降低了PLB Thr17位点在基础频率下的磷酸化,引起SERCA2a活性下调、肌质网钙含量减少,肌节收缩减弱;当频率升高时,胞浆和肌质网Ca2+水平升高导致的促收缩效应超过了CaMKⅡδ抑制的影响,DNM2缺陷诱导的FFR损伤得到恢复,尽管高频刺激下的肌节收缩和钙瞬变仍较无药物处理组弱。Kushnir等[12]报道,抑制 CaMKⅡ可完全阻断心脏正常FFR,提示CaMKⅡδ的正常活性是心脏FFR所必需的,过高或过低都会引起FFR失调。
DNM2缺陷不仅引起了心肌细胞FFR损伤,也能诱导离体心脏FFR障碍。Dynasore是一种细胞穿透性的DNM抑制剂,能选择性地抑制DNM2的GTP酶活性[13]。Dynasore介导的DNM2失活造成心脏对高频起搏的反应性下降,提示DNM2对离体心脏FFR具有调控作用。
综上所述,DNM2在维持心脏正常收缩-频率反应中起重要作用。DNM2功能缺失能干扰细胞钙水平并增强PLB依赖于CaMKⅡδ的磷酸化,进而削弱FFR。DNM2作为调控心脏FFR的重要分子,可能成为心力衰竭等心脏疾病的药物干预靶点。
[1] Heymann J,Hinshaw J E.Dynamins at a glance[J].J Cell Sci,2009,122(19):3427-3431.
[2] Praefcke G,Mcmahon HT.The dynamin superfamily:universal membrane tubulation and fission molecules?[J].Nat Rev Mol Cell Biol,2004,5(2):133-147.
[3] Johnson E,Ringo J,Dowse H.Dynamin,encoded by shibire,is central to cardiac function[J].J Exp Zool,2001,289(2):81-89.
[4] Bers DM.CaMKⅡ inhibition in heart failure makes jump tohuman[J].Circ Res,2010,107(9):1044-1046.
[5] Communal C,Singh K,Pimentel DR,et al.Norepinephrine stimulates apoptosis in adult rat ventricular myocytes by activation of the beta-adrenergic pathway[J].Circulation,1998,98(13):1329-1334.
[6] Gold ES,Underhill DM,Morrissette NS,et al.Dynamin 2 is required for phagocytosis in macrophages[J].J Exp Med,1999,190(12):1849-1856.
[7] Bers DM.Cardiac excitation-contraction coupling[J].Nature,2002,415(6868):198-205.
[8] Zhao W,Uehara Y,Chu G,et al.Threonine-17 phosphorylation of phospholamban:a key determinant of frequency-dependent increase of cardiac contractility[J].J Mol Cell Cardiol,2004,37(2):607-612.
[9] HongTT,Smyth JW,Gao DC,et al.BIN1 localizes the L-type calcium channel to cardiac T-tubules[J].PLoS Biol,2010,8(2):e10003122.
[10] Muth JN,Bodi I,Lewis W,et al.A Ca2+-dependent transgenic model of cardiac hypertrophy:a role for protein kinase Calpha[J].Circulation,2001,103(1):140-147.
[11] Chen X,Zhang X,Kubo H,et al.Ca2+influxinduced sarcoplasmic reticulum Ca2+overload causes mitochondrial-dependent apoptosis in ventricular myocytes[J].Circ Res,2005,97(10):1009-1017.
[12] Kushnir A,Shan J,Betzenhauser MJ,et al.Role of CaMKⅡdelta phosphorylation of the cardiac ryanodine receptor in the force frequency relationship and heart failure[J].Proc Natl Acad Sci U S A,2010,107(22):10274-10279.
[13] Macia E,Ehrlich M,Massol R,et al.Dynasore,a cell-permeable inhibitor of dynamin[J].Dev Cell,2006,10(6):839-850.

