静电纺丝壳聚糖-明胶复合纤维的制备和体外生物相容性评价
何晨光 赵莉
静电纺丝技术是一种制备纳米纤维的最简单的方法。通过静电纺丝技术,可以获得纤维直径均一,成分多样的超长纤维[1-2]。静电纺丝是一种利用聚合物溶液或熔体在强电场作用下,形成喷射流进行纺丝加工的工艺[3-4]。与其他方法相比,静电纺丝技术制备的纳米纤维支架因具有较大的比表面积,较强的力学性能和较高的孔隙率,而更接近细胞外基质的结构。因此,静电纺丝技术被广泛应用于组织工程的支架材料领域[5-7]。
壳聚糖是甲壳素部分脱乙酰化衍生物,它是由β(1~4)相连的D-葡聚胺与含量不等的N-乙酰葡聚胺无规排列起来的一种线性聚糖的多聚糖[8]。壳聚糖无毒,抗菌,具有良好的生物降解性能,可作为伤口敷料,能有效防止黏连,促进伤口愈合[9]。明胶是通过胶原部分水解而得到的,是胶原的变性产物。明胶的化学成分和胶原类似,作为一种蛋白质,明胶由一组氨基酸单链组成,可用于膨胀剂、伤口敷料、粘结剂和外科用可吸收垫片等[10]。明胶具有良好的生物相容性和生物可降解性,并且没有免疫原性;同时,明胶含有丰富的氨基和羧基亲水基团,有助于营养成分和氧气的渗入。壳聚糖和明胶被广泛应用于皮肤组织工程支架材料中[11-13]。用静电纺丝技术制备壳聚糖和明胶复合纤维支架,可以充分发挥壳聚糖抗菌和防黏连的特性,以及明胶吸水和防渗出的特性,模拟皮肤的结构,促进伤口愈合,满足组织工程皮肤支架材料的要求。
我们采用静电纺丝技术制备壳聚糖-明胶复合纤维支架,研究纺丝参数对支架纤维结构的影响,并将人皮肤成纤维细胞接种在支架材料上,观察细胞的形态以及细胞在支架材料上的生长情况,探讨壳聚糖-明胶复合纤维支架作为皮肤组织工程支架材料的可行性。
1 材料及方法
1.1 材料
壳聚糖(CS,Medium molecular weight,Sigma-Aldrich);明胶(GE,国药集团试剂有限公司);三氟乙酸(TFA,CP),二氯甲烷(DCM),醋酸,乙二醇和氢氧化钠(NaOH)购自国药集团试剂有限公司,分析级。 戊二醛(Gultaraldehyde,Grade-I,Sigma-Aldrich)。
DMEM(High Glucose,HyClone);FBS(Fetal Bovine Serum,SAFC Biosciencestm);CCK-8(Cell Counting Kit-8,DojinDo)。
1.2 纤维支架制备
1.2.1 壳聚糖纤维支架制备
以体积比为5∶1的三氟乙酸与二氯甲烷混合溶液为溶剂,配制浓度为3~5 wt%的壳聚糖溶液,在16~20 KV范围内调节电压,并在0.4~2.0 mL/h范围内调节流速。收集、干燥后获得具有不同表面形貌的壳聚糖纤维支架。
1.2.2 明胶纤维支架的制备
以体积比为9.5∶1的醋酸与乙二醇混合溶液为溶剂,配制不同浓度明胶溶液,在13~20 KV范围内调节电压,并在流速为0.4 mL/h条件下进行纺丝。收集、干燥后获得具有不同表面形貌的明胶纤维支架。
1.2.3 壳聚糖-明胶复合纤维支架制备
以体积比为7∶1的三氟乙酸与二氯甲烷为溶剂,首先加入壳聚糖,搅拌形成均一的壳聚糖溶液;按比例加入明胶,继续搅拌,配制成浓度为6 wt%的壳聚糖/明胶混合溶液。调节电压和纺丝间距,在电场强度为1.8 KV/cm,流速为1.0 mL/h条件下进行静电纺丝。为观察不同配比壳聚糖/明胶复合纤维支架的性能,壳聚糖/明胶的质量比分别设为1∶3、1∶1和3∶1。收集、干燥后获得具有不同表面形貌的壳聚糖-明胶纤维支架。
1.3 纤维支架的交联
将浓度为25%的5 mL戊二醛溶液置于密闭干燥器,放入纤维支架,用戊二醛蒸气交联3 h,再放入100℃真空烘箱内,抽真空干燥1 h,去除残留的戊二醛,干燥结束后将支架放入干燥器。
为使支架在液体环境中更好的保持其纤维结构,交联后的纤维支架用0.5 M/L的NaOH溶液浸泡30min,再以去离子水洗至液体呈中性。
1.4 支架的表征
纤维支架的形貌用扫描电镜来进行观察。分别取支架样品,表面经离子溅射仪喷金镀膜后,用Hitachi S-450扫描电镜观察支架的表面形貌。采用图像分析软件测定扫描电镜照片中支架的纤维直径,每个样品的电镜照片取30根纤维计算平均直径。
Analysis of Influencing Factors on Fatigue of Offshore Wind Turbine Monopile Foundation WANG Hongqing,LIU Xudong,BI Mingjun,LIU Jinchao(92)
1.5 细胞接种
选择壳聚糖/明胶质量比为3∶1的复合纤维支架,将支架材料裁成1.5 cm×1.5 cm大小,75%医用乙醇浸泡1 h,然后用磷酸盐缓冲液(Phosphate buffered solution,PBS)冲洗3次,加入细胞培养液(含10%胎牛血清的 DMEM),置于37℃、5%CO2培养箱内浸润过夜,接种细胞前将材料移至6孔板。
原代培养的人真皮成纤维细胞体外传代培养至第5代,待细胞铺满培养皿底部时,用0.25%胰酶消化,按3×105cells/cm2的密度接种于材料表面,待细胞黏附4h后,加入足量的细胞培养液培养,隔天换液。
1.6 细胞在纤维支架材料上的形貌
细胞接种后第3、5、7天,取出细胞-材料复合物,用PBS轻轻冲洗2次,放入2.5%戊二醛溶液中,4℃固定24h,再用六甲基二硅胺烷逐级脱水干燥。采用SEM观察细胞在支架表面的形貌。
1.7 细胞在纤维支架材料上的增殖
用CCK-8试剂定量检测细胞材料复合物上活细胞数量,并绘制生长曲线,观察其增殖情况。将材料剪裁成1.5 cm×1.5 cm的尺寸,75%医用乙醇浸泡后,PBS冲洗3次,然后放入24孔板。每块材料接种1.4×104个细胞,加入适量细胞培养液置于37℃、5%CO2培养箱内培养。 分别于接种后第 1、3、5、7、9天吸去培养液,每孔加入100μL CCK-8溶液,放入37℃烘箱孵育2 h,取上清液加入96孔板,测定在450 nm处的吸光度值,并绘制标准曲线[14]。
2 结果
2.1 壳聚糖纤维支架的形貌
壳聚糖纤维支架的制备参数及对应的纤维直径如表1。
2.1.1 电压对纤维支架形貌的影响
2.1.2 浓度对纤维形貌的影响
浓度对纤维直径有明显的影响。由表1可知,随着浓度的增加,纤维直径从(0.53±0.26)μm,增加至(0.8±0.29) μm,当浓度为 4.3 wt%时,纤维直径增加至(1.2±0.3)μm。浓度增加,壳聚糖溶液成纤效果差,大多数纤维粘结在一起,纤维间一些直径较小的纤维在干燥过程中发生断裂(图2)。
2.2 明胶纤维支架的形貌
明胶纤维支架的制备参数及纤维直径如表2所示。当保持其他参数不变时,随着纺丝溶液浓度增加,纤维直径随之增加。溶液浓度从19.4 wt%增加到 24.6 wt%时,纤维直径由(0.224±0.06)μm 增加至(0.87±0.18)μm。但纺丝溶液浓度在19.4 wt%和22 wt%之间变化时,纤维直径变化不大,反而随着浓度增加,直径略有降低。
纺丝时,电压增加,明胶纤维的直径略有增大。当电压从13 KV增加至20 KV时,纤维直径从(0.19±0.06) μm 增大至(0.217±0.08) μm(图 3)。
2.3 壳聚糖-明胶复合纤维支架
壳聚糖-明胶复合纤维支架的制备参数及性能参数如表3所示。壳聚糖/明胶质量比增加时,溶液粘度变大;壳聚糖/明胶质量比增加时,纤维粘连增多,纤维支架孔隙变小,更加致密。而且,当壳聚糖含量增加时,虽然溶液浓度保持不变,但纤维直径仍然显著增加(图 4,5)。
2.4 细胞在纤维支架上的形貌
成纤维细胞接种在壳聚糖-明胶复合纤维支架(壳聚糖/明胶质量比为 3∶1)上,培养 3 d后,细胞已基本铺满整个支架表面,透过细胞层间隙,还可见到纤维。细胞呈典型的梭状,细胞基质分泌旺盛。培养5 d后,支架表面难以看到露出的纤维,细胞基质更加丰富,细胞形态更加伸展(图6)。培养7 d后,由于细胞层增厚,扫描电镜观察时,电子束强,样品放电严重,结果无法显示。
2.5 细胞在纤维支架上的增殖
细胞接种在材料上后,前3 d增殖不明显,细胞数量没有快速增加。接种3 d后,细胞在3种比例纤维支架上都开始生长,并在5 d后进入快速增长期。壳聚糖/明胶质量比为1∶1的复合纤维支架组,培养7 d后,细胞生长进入平台期,增殖缓慢。而另外两种比例的纤维支架上,培养到第9天,细胞仍然在不断增殖,尤其是壳聚糖/明胶质量比为3∶1的复合纤维支架,7 d后,细胞在支架上的增殖速度更是超过了质量比为1∶3的复合纤维支架(图7)。
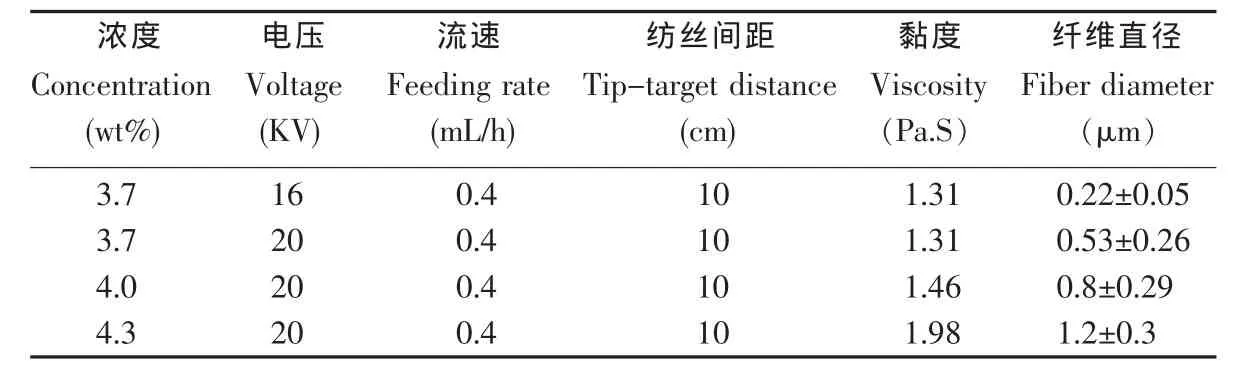
表1 壳聚糖纤维支架制备参数及纤维直径Table 1 Preparation parameters and fiber diameter of chitosan fibers

图1 电压对壳聚糖纤维支架形貌的影响。纺丝溶液浓度为3.7 wt%,流速为0.4 mL/h,纺丝间距为10 cm;A:电压为16 KV;B:电压为20 KVFig.1 Influence of votage on chitosan fibers at the concentration of 3.7 wt%,a feeding rate of 0.4 ml/h,a tip-target distance of 10cm with the different applied voltages of(A)16 KV;(B)20 KV

图2 壳聚糖纤维支架SEM观察,纺丝过程中电压为20 KV,溶液流速为0.4 mL/h。A:浓度为3.7 wt%;B:浓度为4 wt%;C:浓度为4.3 wt%Fig.2 SEM micrograph of the chitosan fibers at the applied voltage of 20 KV,a feeding rate of 0.4 mL/h with different concentrations of(A)3.7 wt%;(b)4 wt%;(c)4.3 wt%
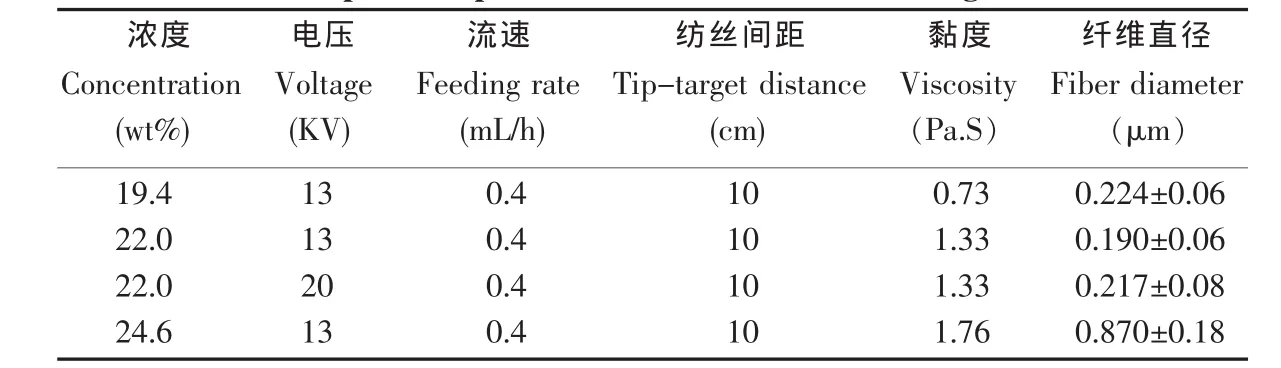
表2 明胶纤维支架制备参数及纤维直径Table 2 Preparation parameters and fiber diameter of gelatin fibers

图3 不同制备参数下的明胶纤维支架的SEM观察。溶液流速为0.4 mL/h,纺丝间距为10 cm。A:浓度为19.4 wt%,电压为13 KV;B:浓度为22 wt%,电压为13 KV;C:浓度为24.6 wt%,电压为13 KV;D:浓度为22 wt%,电压为20 KVFig.3 SEM micrograph of the gelatin fibers at a feeding rate of 0.4 mL/h with the tip-target distance of 10cm with different concentrations and applied voltages of(A)19.4 wt%,13 KV;(B)22 wt%,13 KV;(C)24.6 wt%,13 KV;(D)22 wt%,20 KV
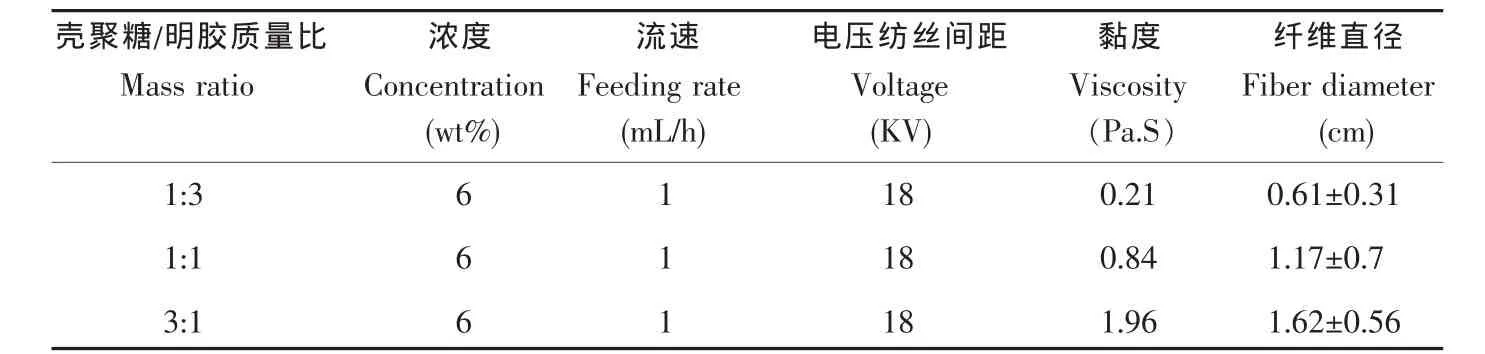
表3 壳聚糖-明胶复合纤维支架的制备参数及性能参数Table 3 Preparation and performance parameters of chitosan/gelatin composite fibers
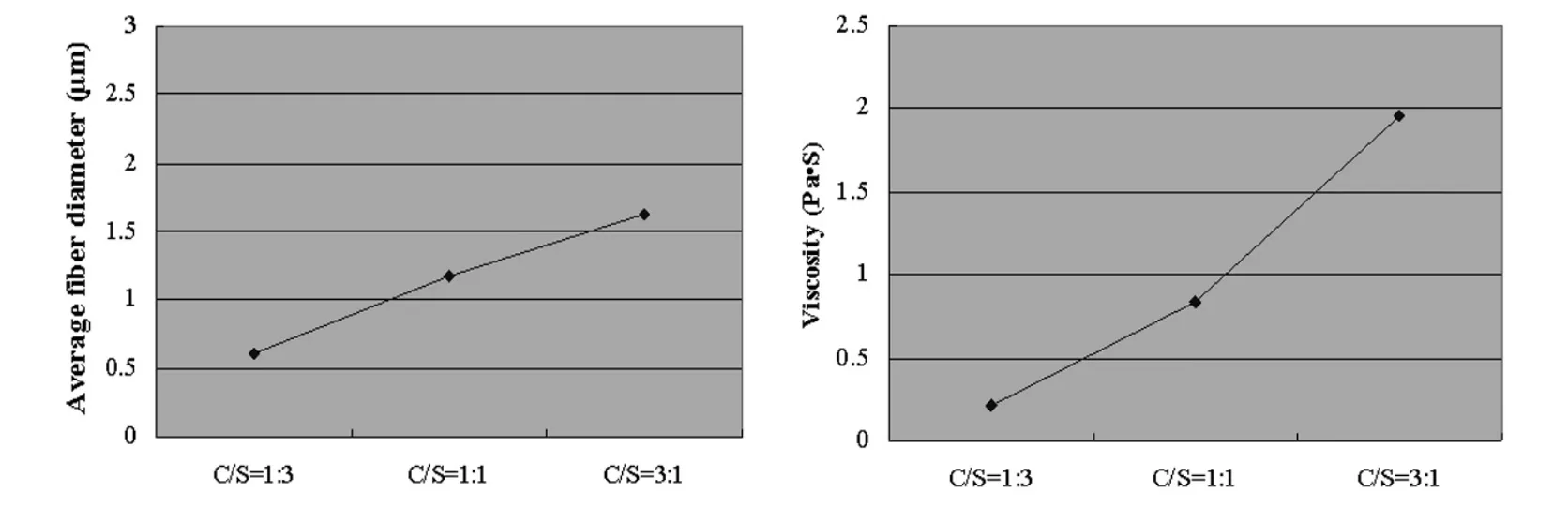
图4 壳聚糖/明胶质量比对纤维平均直径和溶液粘度的影响Fig.4 Influence of chitosan/gelatin ratios on the average fiber diameter and solution viscosity

图5 不同配比壳聚糖-明胶复合纤维支架的SEM照片Fig.5 SEM micrograph of the electrospun chitosan/gelatin composite fibers in different mass ratios
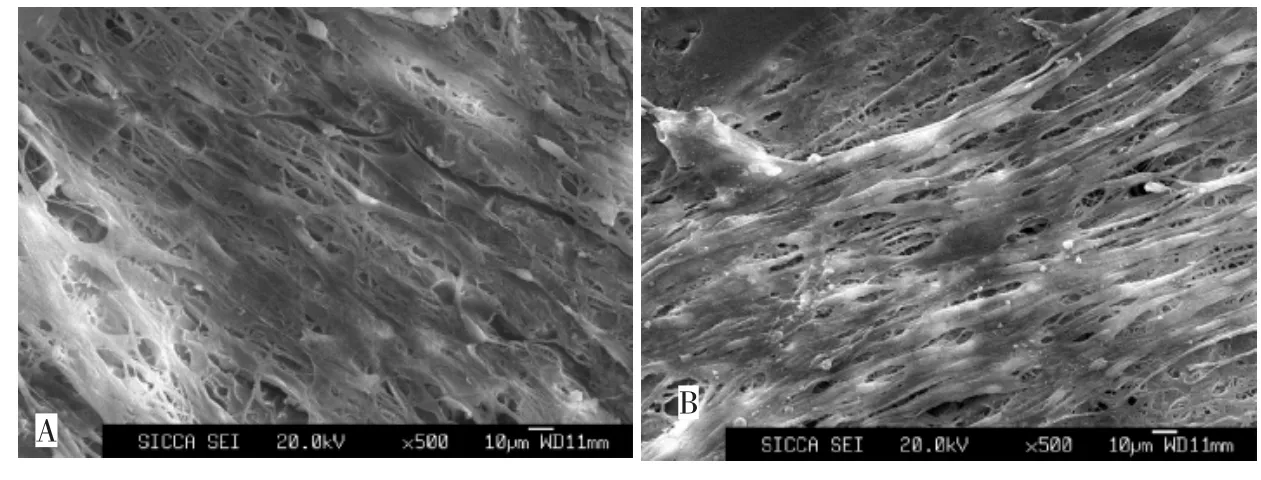
图6 成纤维细胞接种在壳聚糖-明胶复合纤维支架上,培养3 d(A)和5 d(B)后,细胞在支架上的铺展形态Fig.6 Cell morphology on the chitosan/gelatin composite fibrous scaffolds after the culture of 3 days(A)and 5 days(B)

图7 人成纤维细胞在3种不同壳聚糖/明胶质量比纤维支架上的增殖情况Fig.7 Proliferation curve of human fibroblast cultured in the chitosan/gelatin composite fibrous scaffolds
3 讨论
静电纺丝技术自1934年Formalas发明专利以来,近几十年得到飞速发展。迄今为止,有近百种聚合物通过静电纺丝技术纺制成纤维,陶瓷材料如羟基磷灰石[15]、生物活性玻璃[16]等,复合材料如PCL/CaCO3[17]、HA/PVP[18]、聚乳酸/硅酸钙[19]等,也都在不同的参数下制备出纳米纤维。静电纺丝技术获得的纤维直径从毫米级到纳米级,可满足不同的需要[20]。由于静电纺丝制备的纤维类似细胞外基质,故而在组织工程支架材料方面得到广泛应用。
壳聚糖和明胶是皮肤组织工程支架常用的材料,过去常用的支架制备方法是冷冻干燥法[21-23]。静电纺丝技术的出现,为皮肤组织工程支架的制备提供了一种新的方法[24-31]。本实验采用三氟乙酸和二氯甲烷混合溶剂,制备无珠状结构的壳聚糖-明胶复合纤维支架,着重对3种不同质量比的复合支架进行研究,并利用人成纤维细胞观察复合纤维支架的体外相容性。
我们首先制备了壳聚糖纤维和明胶纤维。在选择溶剂时,醋酸是首选。但是在纺制壳聚糖纤维时,发现醋酸挥发性差,难以获得理想的纤维支架。明胶对溶剂的适应性强,当以醋酸和乙二醇为溶剂时,纺丝溶液浓度可接近25 wt%。对于壳聚糖纤维支架而言,选择三氟乙酸和二氯甲烷混合溶液为溶剂,制备出的纤维均匀,无珠滴。三氟乙酸挥发性好,溶解能力强,可以和壳聚糖中带正电的氨基基团形成盐,从而破坏壳聚糖分子间的相互作用,因而使得壳聚糖溶液具有很好的流动性[30]。然而,即使以三氟乙酸和二氯甲烷为溶剂,可纺丝的壳聚糖溶液浓度仍然低于5 wt%,溶液黏度不超过2 Pa.s。溶液浓度过高,黏度太大,溶液推进困难,而且增加电压,也难以克服溶液的表面张力,从针头出来的溶液黏结在一起,造成多股纤维粘结。明胶溶液流动性好,黏度低,可在很大浓度范围内进行纺丝。
纺丝溶液浓度是影响纤维质量和纤维直径的主要因素,电压是另一个影响因素。电压偏低时,喷射流不能形成,容易在收集板上出现液滴。我们所施加的电压均是能够形成连续均一的纤维。电压增加,可以形成喷射流,并克服液滴的表面张力,使之形成Taylor锥,最后纤维收集在收集板上。本研究中,电压增加,纤维直径略有增大,但没有显著差异。这是因为电压增加时,纺丝溶液从针头到达收集板的时间缩短,纤维在形成Taylor锥的过程中没有经过充分的牵伸,因此纤维直径略有增大。与纺丝溶液浓度对纤维直径的影响相比,电压对纤维直径的影响较小。
壳聚糖和明胶复合时,在同样的浓度下,复合溶液的黏度随着明胶含量的增加而减小,同时复合纤维直径也相应减小。本研究选择了3种壳聚糖/明胶质量比,均获得无珠滴、纤维均一的复合纤维支架。壳聚糖大分子中,NH2+和OH-基团对形成很强的氢键相互作用具有重要意义。加入明胶后,明胶的螺旋微结构可使壳聚糖链段之间的分子间相互作用降低,从而在功能键间形成氢键。由于这些键比壳聚糖本身的功能键弱,因而壳聚糖/明胶复合溶液的黏度降低,在静电纺丝时更容易形成Taylor锥,从而获得均一、超细且无珠滴的复合纤维[31]。
壳聚糖和明胶都是具有良好生物相容性的天然高分子材料。我们在前期的研究中,将壳聚糖和明胶复合,制备出用于表皮细胞生长的膜片。结果显示,细胞在膜片上增殖良好,可用于修复裸鼠创面和瘢痕的治疗[32-33]。本研究中,来源于小儿包皮的人成纤维细胞经传代后,接种于壳聚糖-明胶复合纤维支架,培养3 d后,细胞已铺满大部分的支架表面,说明静电纺丝壳聚糖-明胶复合纤维支架具有良好的细胞相容性。细胞在支架表面铺展良好,呈典型的梭状,而且随着培养时间的增加,增殖良好;培养5 d后,细胞数量进一步增加,支架表面已全部被细胞铺满;培养7 d后,由于细胞数量增加,细胞层增厚,SEM观察时,样品放电现象严重,没有结果显示。细胞增殖曲线进一步验证了这一点。该结果证明成纤维细胞在壳聚糖-明胶复合纤维支架上生长良好,壳聚糖-明胶复合纤维支架是潜在的皮肤组织工程支架材料。
4 结论
本研究以三氟乙酸和二氯甲烷为溶剂,纺丝电压为18 KV、流速为1 mL/h,纺丝溶液浓度为6 wt%,获得的复合纤维支架具有均一、光滑、无珠滴的纤维形貌。随着纺丝溶液浓度的增加,纤维平均直径随之增加。在其他参数保持不变的条件下,壳聚糖/明胶质量比增加,纺丝溶液黏度增加,平均纤维直径也随之增加。电压对纤维直径没有显著影响。将人成纤维细胞接种在壳聚糖-明胶复合纤维支架上,细胞生长良好,增殖快。本研究制备的壳聚糖-明胶复合纤维支架具有良好的生物相容性,有望作为皮肤组织工程支架材料。
[1]Li D,Xia YN.Electrospinning of nanofibers:Reinventing the wheel[J]?Adv Mater,2004,16(14):1151-1170.
[2]Li D,Wang Y,Xia Y.Electrospinning nanofibers as uniaxially aligned arrays and layer-by-layer stacked films[J].Adv Mater,2004,16(4):361-366
[3]Huang ZM,Zhang YZ,Kotaki M,et al.A review on polymer nanofibers by electrospinning and their application in nanocomposites[J].Compos Sci Technol,2003,63(15):2223-2253.
[4]Liao S,Li B J,Ma Z,et al.Biomimetic electrospun nanofibers for tissue regeneration[J].Biomed Mater,2006,1(3):R45-53.
[5]Li WJ,Laurencin CT,Caterson EJ,et al.Electrospun nanofibrous structure:a novel scaffold for tissue engineering[J].J Biomed Mater Res,2002,60(4):613-621.
[6]Yoshimoto H,Shin YM,Terai H,et al.A biodegradable nanofiber scaffold by electrospinning and its potential for bone tissue engineering[J].Biomaterials,2003,24(12):2077-2082.
[7]Bhattarai SR,Bhattarai N,Yi HK,et al.Novel biodegradable electrospun membrane:scaffold for tissue engineering[J].Biomaterials,2004,25(13):2595-2602.
[8]朱爱萍,吴钧,张娜,等.壳聚糖——一种具有应用潜力的组织工程支架材料[J].化学通报,2002,65(1):w003
[9]Jayakumar R,Prabaharan M,Nair SV,et al.Novel chitin and chitosan nanofibers in biomedical applications[J].Biotechnol Adv,2010,28(1):142-510.
[10]Jafari J,Emami SH,Samadikuchaksaraei A,et al.Electrospun chitosan-gelatin nanofiberous scaffold:Fabrication and in vitro evaluation[J].Biomed Mater Eng,2011,21(2):99-112.
[11]Tchemtchoua VT,Atanasova G,Aqil A,et al.Development of a chitosan nanofibrillar scaffold for skin repair and regeneration[J].Biomacromolecules,2011,12(9):3194-3204.
[12]Chen JP,Chang GY,Chen JK.Electrospun collagen/chitosan nanofibrous membrane as wound dressing[J].Colloids Surf A Physicochem Eng Asp,2008,313-314:183-188.
[13]Lee SB,Kim YH,Chong MS,et al.Study of gelatin-containing artificial skin V:fabrication of gelatin scaffolds using a salt-leaching method[J].Biomaterials,2005,26(14):1961-1968.
[14]Kim D,Kim S,Jo S,et al.Effect of cross-linking spacers on biocompatibility of chitosan-spacer-poly(ethylene oxide)hydrogel[J].Macromolecular Research,2011,19(6):573-581.
[15]Kim HW,Kim HE.Nanofiber generation of hydroxyapatite and fluor-hydroxyapatite bioceramics[J].J Biomed Mater Res B Appl Biomater,2006,77(2):323-328.
[16]Xia W,Zhang D,Chang J.Fabrication and in vitro biomineralization of bioactive glass(BG)nanofibres[J].Nanotechnology,2007,18(13):135601.
[17]Fujihara K,Kotaki M,Ramakrishna S.Guided bone regeneration membrane made of polycaprolactone/calcium carbonate composite nano-fibers[J].Biomaterials,2005,26(19):4139-4147.
[18]Chen F,Tang QL,Zhu YJ,et al.Hydroxyapatite nanorods/poly(vinyl pyrolidone)composite nanofibers,arrays and three-dimensional fabrics:electrospun preparation and transformation to hydroxyapatite nanostructures[J].Acta Biomater,2010,6(8):3013-3020.
[19]Dou Y,Wu C,Chang J.Preparation,mechanical property and cytocompatibility of poly(l-lactic acid)/calcium silicate nanocomposites with controllable distribution of calcium silicate nanowires[J].Acta Biomater,2012,8(11):4139-4150.
[20]Huang ZM,Zhang YZ,Ramakrishna S,et al.Electrospinning and mechanical characterization of gelatin nanofibers[J].Polymer,2004,45(15):5361-5368.
[21]Sundararajan VM,Howard WTM.Porous chitosan scaffolds for tissue engineering[J].Biomaterials,1999,20(12):1133-1142
[22]Ho MH,Kuo PY,Hsieh HJ,et al.Preparation of porous scaffolds by using freeze-extraction and freeze-gelation methods[J].Biomaterials,2004,25(1):129-138.
[23]Kang HW,Tabata Y,Ikada Y.Fabrication of porous gelatin scaffolds for tissue engineering[J].Biomaterials,1999,20(14):1339-1344.
[24]Matsuda A,Kagata G,Kino R,et al.Preparation of chitosan nanofiber tube by electrospinning[J].J Nanosci Nanotech,2007,7(3):852-855.
[25]Jayakumar R,Prabaharan M,Nair SV,et al.Novel chitin and chitosan nanofibers in biomedical applications[J].Biotechnol Adv,2010,28(1):142-150
[26]Min BM,Lee SW,Lim JN,et al.Chitin and chitosan nanofibers:electrospinning of chitin and deacetylation of chitin nanofibers[J].Polymer,2004,45(21):7137-7142.
[27]Powell HM,Boyce ST.Fiber density of electrospun gelatin scaffolds regulates morphogenesis of dermal–epidermal skin substitutes[J].J Biomed Mater Res A,2008,84(4):1078-1086.
[28]Song JH,Kim HE,Kim HW.Production of electrospun gelatin nanofiber by water-based co-solvent approach[J].J Mater Sci Mater Med,2008,19(1):95-102.
[29]Sisson K,Zhang C,Farach-Carson MC,et al.Fiber diameters control osteoblastic cell migration and differentiation in electrospun gelatin[J].J Biomed Mater Res A,2010,94(4):1312-1320.
[30]Dhandayuthapani B,Krishnan UM,Sethuraman S.Fabrication and characterization of chitosan-gelatin blend nanofibers for skin tissue engineering[J].J Biomed Mater Res B Appl Biomater,2010,94(1):264-272.
[31]He JH,Wan YQ,Yu JY.Application of vibration technology to polymer electrospinning[J].Int J Nonlinear Sci Numer Simul,2004,5(3):253-262.
[32]杨光辉,杨军,邓辰亮,等.组织工程化表皮膜片修复裸鼠创面的实验研究[J].上海第二医科大学学报,2004,24(4):293-295.
[33]杨军,杨光辉,刘伟,等.组织工程化表皮膜片的构建及其在增殖性疤痕治疗中的应用[J].上海第二医科大学学报,2004,24(4):296-298.

