转染ANGPTL-1基因对人皮肤成纤维细胞胶原表达的影响
宋仁刚
血管生成素相关蛋白(ANGPTL-1)是新发现的一种与血管生成、脂类代谢、糖代谢和胰岛素敏感性密切相关的分泌型糖蛋白,该家族已发现ANGPTL-1~7。ANGPTL-1与血管生成素的结构相似,属于纤维蛋白原家族。然而,ANGPTL-1不能与Tie-2受体结合,因此不是真正意义上的血管生成素,故命名为血管生成素样蛋白(ANGPTL-1)[1-3]。我们的前期研究表明,ANGPTL-1基因在青年小鼠尾部皮肤中的表达明显高于老年小鼠[4-5]。为进一步研究ANGPTL-1基因在皮肤细胞中的作用,本实验以人皮肤成纤维细胞转染ANGPTL-1基因,探讨ANGPTL-1转染人皮肤成纤维细胞的可行性,及转染后对细胞增殖速率和Ⅰ、Ⅲ型胶原合成的影响。
1 材料与方法
1.1 材料
大肠杆菌top10,高效真核表达载体pcDNA3.0(Invitrogen公司,美国),DMEM培养基、胰蛋白酶(Gibco 公司,美国),胎牛血清(FBS,Hyclone 公司,美国),胶原酶NB4(Serva公司,德国),脂质体Lipofectamine 2000(Invitrogen 公司,美国),PCR 引物由上海生物工程公司合成,TRIzol RNA抽提试剂盒(Gibco公司,美国),RT-PCR 试剂盒、SYBR Premix Ex TaqTM(TaKaRa 公司,日本),GeneRulerTM1 kb DNA Ladder(Fermentas公司,立陶宛)。 激光共聚焦显微镜(Leica 公司,德国),ABI 7300 Real-time PCR扩增仪(ABI公司,美国),GIS22800型凝胶图像处理系统(上海天能科技公司)。
1.2 方法
1.2.1 ANGPTL-1真核表达载体构建与鉴定
目的基因ANGPTL-1 cDNA片段由RT-PCR方法获取。PCR扩增引物Full length-F:5'-AGCAGGCAGTCAGAGTGGG-3',Full length-R:5'-TGGAAGGAAGAGCCGAGAC-3';PCR 条件为:模板 2μL,PCR 缓冲液 5μL,上游引物 1μL,下游引物1μL,TaqDNA 聚合酶 1μL,dNT4μL,H2O 36μL。94 ℃ 4min,然后 94 ℃ 30 sec、68 ℃ 2.5min(35个循环),再68℃延伸10min,产物长度3123 bp。PCR纯化产物装入克隆载体PMD 18-T,大肠杆菌top10在LB固体培养皿上涂片培养,经蓝白斑筛选,挑取单个白色菌落在含氨苄青霉素的LB培养液中扩增。用HindⅢ和XbaI双酶切TA载体回收目的片段,表达载体pcDNA3.0用HindⅢ和XbaI双酶切回收线性载体,两者用T4连接酶连接,构建pcDNA-ANGPTL-1,经酶切电泳鉴定。
1.2.2 细胞培养与分组
皮肤标本来源于深圳市人民医院门诊患者,无菌条件下切取标本,以0.5%氯霉素冲洗标本并浸泡10min,将标本剪碎至1~2 mm3大小,0.3%NB4复合胶原酶,37℃摇床消化3 h,150目滤网收集过滤液,1500 r/min离心 10min,收集细胞,按 2×104个/cm2接种于培养皿,24h后首次换液。准备传代,转染。分组:未转染正常组、转染空载体pcDNA3.0组和pcDNA3.0-ANGPTL-1转染组。
1.2.3 细胞转染
细胞转染前24h,按2×105个/孔接种于6孔板,细胞生长至30%~45%融合时转染质粒。方法:取无血清 DMEM 培养液 240μL与 10μL Lipofectamine 2000混匀,另取 240μL DMEM 培养液与 10μL(100 pmol)质粒混匀,5min后分别合并脂质体和质粒两液,室温放置20min。吸掉培养液,以1.5 mL/孔加纯DMEM培养基,再加入脂质体质粒液,37℃培养5 h后,弃转染液,换10%FBS的DMEM培养液培养。
1.2.4 Real-time PCR 检测
分别收集对数生长期的未转染正常组细胞、转染空载体pcDNA3.0和ANGPTL-1转染组的细胞,用Trizol试剂盒提取细胞总RNA,紫外分光光度计定量后,行逆转录反应(RT)。取总 RNA 1 μg,oligo dT 1μL(0.5 μg), 补足 DEPC 处理的 ddH2O 至 13μL,65℃变性5min,立即置冰浴,加RNase抑制剂20 U,2.5 mmol/L dNTP 1μL,5×逆转录酶缓冲液 4μL,M-MLV 逆转录酶 200 U 2μL,总体积 20μL。 反应程序:25 ℃ 15min,37 ℃反应 1 h,95 ℃ 5min。终止反应后,RT产物行Real-time PCR法检测NOS、Ⅰ型胶原和Ⅲ型胶原表达。根据人ANGPTL-1基因及Ⅰ、Ⅲ型胶原基因序列,设计上、下游引物序列。ANGPTL-1-F:5'-TTCTACAGAGGCTCGTGGCT-3',ANGPTL-1-R:5'-GTATCATGAGTACCCGGTGT-3';Col-Ⅰ-F:5'-GAACGCGTGTCATCCCTTGT-3',Col-Ⅰ -R:5'-GAACGAGGTAGTCTTTCAGCAACA-3';Col-Ⅲ-F:5'-AACACGCAAGGCTGTGAGACT-3',Col- Ⅲ -R:5'-GCCAACGTCCACACCAAATT-3'。RT产物稀释10倍后取1μL作为模板 ,加入2×SYBR Premix Ex TaqTM12.5μL,上游引物、下游引物(10 pmol)各1μL, ddH2O 补足体积到 25μL。反应条件:50℃ 2min,95℃变性 15min后,95℃15 sec,60 ℃ 1min,40 个循环。
1.2.5 流式细胞仪检测
当被转染细胞生长至70%融合时,收集、离心,调整细胞浓度为1×106cells/mL,上样,行流式细胞仪检测。
2 结果
2.1 ANGPTL-1基因克隆及表达载体构建
利用RT-PCR成功扩增了ANGPTL-1基因全长,约3.3 Kb。载体在2%琼脂糖凝胶中可见约8.4 Kb DNA带,与预期质粒大小结果相一致,用HindⅢ和XbaI双酶切电泳,在同一泳道中出现2条DNA带,1条5.5 Kb,与空质粒DNA链长度一致,确定为质粒 DNA带;另 1条 3.1 Kb,与 ANGPTL-1 cDNA片段大小一致。基因测序后,证实所合成基因序列与基因库中一致率为99.95%。
2.2 人皮肤成纤维细胞ANGPTL-1转染率
流式细胞仪检测提示,人皮肤成纤维细胞被转染48 h后,(63±7.1)%的被转染细胞表达报告基因荧光(图 1)。

图1 人皮肤成纤维细胞成功转染ANGPTL-1,细胞内可见绿色荧光表达Fig.1 Observation of GFP reporter gene vector.Green fluorecence can be seen in the hypertrophic scar fibroblasts after target cells were transfected
2.3 RT-PCR检测 ANGPTL-1 mRNA表达
转染24h后,Real-time PCR检测到ANGPTL-1 mRNA在转染组、转染空载体组、未转染组细胞中的表达分别为(5.24±1.16)、(1.71±0.32)和(1.89±0.19),转染组的相对表达量较未转染组和转染空载体组明显增高(P<0.01,n=5);未转染组和转染空载体组比较无统计学差异(P>0.05,n=5)(图 2)。
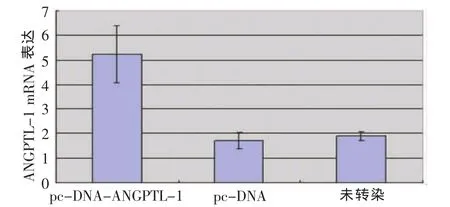
图2 ANGPTL-1 mRNA的表达Fig.2 The relative expression of ANGPTL-1 mRNA
2.4 ANGPTL-1转染后对细胞 Ⅰ、Ⅲ型胶原表达的影响
Ⅰ、Ⅲ型胶原 mRNA在转染组、转染空载体组、未转染组细胞中的表达分别为(3.33±0.53)与(2.09±0.26)、(0.91±0.19)与(0.93±0.26)和(0.94±0.14)与(0.95±0.22)。转染组的相对表达量较未转染组和转染空载体组均明显增高(P<0.01,n=5)(图 3)。
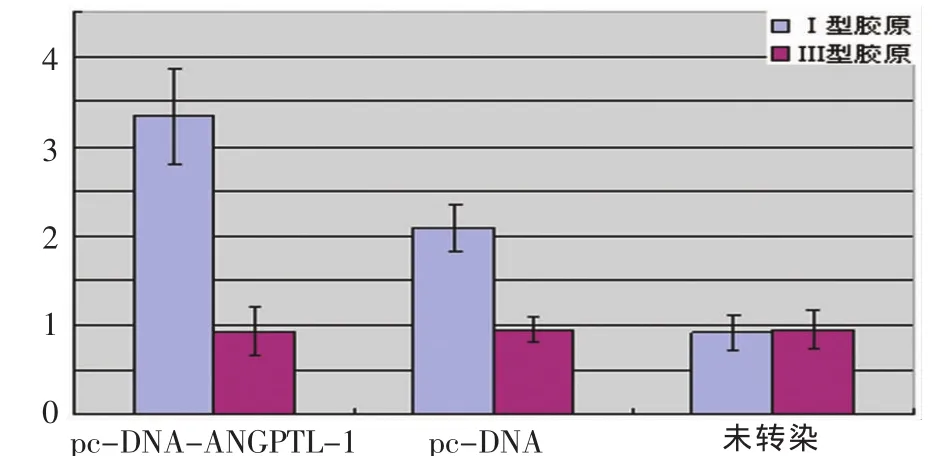
图3 Ⅰ、Ⅲ型胶原mRNA的表达Fig.3 Expression of collagenⅠ,Ⅲ mRNA
3 讨论
关于ANGPTL-1基因作用的研究,目前主要集中在血管发生、内皮细胞的保护及胚胎器官发生等方面,其他方面较少涉及。根据基因芯片数据分析,ANGPTL-1基因在青年小鼠与老年小鼠尾部皮肤中表达差异显著[4-5]。此外,我们的前期研究中还发现,ANGPTL-1基因的表达与Ⅰ、Ⅲ型胶原基因的表达呈相关性。因此,我们设计了先构建ANGPTL-1基因再进行细胞转染的研究方案,并采用真核表达载体,保证了研究结果的可靠性。
重组的ANGPTL-1基因转入体外培养的人皮肤成纤维细胞后,转染的ANGPTL-1转录因子能否有效表达,是判断转染成功与否的关键。我们采用流式细胞仪观察与相对精确的Real-time PCR方法相结合[6-7],发现(63±7.1)%的细胞表达报告基因,而且转染组表达明显高于对照组。提示ANGPTL-1基因已成功转入人皮肤成纤维细胞内。
胶原蛋白是人体真皮组织中的重要组成部分,随着紫外线的不断照射以及人年龄的增加,皮肤内透明质酸与胶原蛋白的含量逐渐减低,真皮组织被氧化、皮肤塌陷、萎缩。皮肤表现为粗糙、干燥、皱纹增大、松弛等一系列衰老征象[2]。本实验结果表明,转染后,细胞内Ⅰ、Ⅲ型胶原mRNA合成增加。ANGPTL-1表达增强可导致皮肤成纤维细胞Ⅰ、Ⅲ型胶原mRNA表达加强。进而提示我们,控制ANGPTL-1的过度表达有可能控制皮肤成纤维细胞Ⅰ、Ⅲ型胶原mRNA表达,进而调节皮肤的老化。
综上所述,我们证实皮肤成纤维细胞可作为ANGPTL-1转染的靶细胞;通过调节ANGPTL-1基因,可调节皮肤中胶原含量,起到延缓衰老的作用。
[1]Lai DM,Tu YK,Hsieh YH,et al.Angiopoietin like protein 1 expression is related to intermuscular connective tissue and cartilage development[J].Dev Dyn,2007,236(9):2643-2652.
[2]Wei D,Zhang L,Williams DL,et al.Glucan stimulates human dermal fibroblast collagen biosynthesis through a nuclear factor-1 dependent mechanism[J].Wound Repair Regen,2002,10(3):161-168.
[3]Uchihashi T,Kimata M,Tachikawa K,et al.Involvement of nuclear factor I transcription/replication factor in the early stage of chondrocytic differentiation[J].Bone,2007,41(6):1025-1035.
[4]Wu J,Ma B,Yi S,et al.Gene expression of early hypertrophic scar tissue screened by means of cDNA microarrays[J].J Trauma,2004,57(6):1276-1286.
[5]Christner PJ,Hitraya EG,Peters J,et al.Transcriptional activation of the alpha1(I)procollagen gene and up-regulation of alpha1(I)and alpha1(III)procollagen messenger RNA in dermal fibroblasts from tight skin 2 mice[J].Arthritis Rheum,1998,41(12):2132-2142.
[6]Lockey C,Otto E,Long Z.Real-time fluorescence detection of a single DNA molecule[J].Biotechniques,1998,24(5):744-746.
[7]Wang T,Brown MJ.mRNA quantification by real time TaqMan polymerase chain reaction:validation and comparison with RNase protection[J].Anal Biochem,1999,269(1):198-201.

