重组人p75NTR169-Fc抗酶裂嵌合体在大肠杆菌中的表达、纯化及活性鉴定
景丽玲 王 欣 陈 虹 张俊文
p75NTR(neurotrophins receptor,p75)属于肿瘤坏死因子受体超家族成员,最初被认定是神经营养素(neurotrophins,NTs)的“通用”受体,但随着对其研究的深入,发现 p75NTR可以和不同的配体,如proNGF、β -淀粉样肽(beta amyloid,Aβ)以及和共受体,如Trk,NgR及Sortilin等结合,不仅介导神经元的存活、分化、轴突的生长,还可以介导神经元的死亡[1~3]。p75NTR 与 sortilin 作为 proNGF(proneurotrophins)的受体介导细胞死亡[4]。近年来在神经退行性疾病的研究中,p75NTR作为Aβ的受体越来越引起关注[5~7]。在神经退行性疾病动物模型中,上调p75NTR的水平,导致更多的神经元凋亡。海马和大脑皮质的胆碱能神经元丢失是AD发病的早期特点,而这些神经元都是高表达 p75NTR的[8]。将 Aβ作用于从p75NTR基因敲除小鼠分离得到的海马神经元,与Aβ作用于富含p75NTR的海马神经元相比,Aβ不能引起p75NTR基因敲除的海马神经元的凋亡却能引起富含p75NTR的海马神经元的凋亡[5]。因此,p75NTR已成为研究治疗神经退行性疾病如阿尔茨海默病等的一个热点。
研究显示,p75NTR是通过胞外区结构域和配体结合,胞内区结构域激活介体(mediators)而发挥效应[9~11]。笔者曾经用毕赤酵母成功的表达过p75NTR194-Fc重组蛋白,但发现该重组蛋白的纯化产物中大部分为其蛋白酶降解产物,氨基端氨基酸顺序测定证实:蛋白酶切位点位于p75NTR 170位氨基酸。因此,本研究中,我们重新表达了由p75NTR胞外区1~169位氨基酸构成的p75NTR169与人Ig G Fc融合的重组蛋白。该重组蛋白特点为:①保留了p75NTR配体结合区,删除掉蛋白酶解位点,将不再有因为酶裂产生的低分子质量p75NTR-Fc融合蛋白;②融合人IgG Fc片段后将延长重组蛋白半衰期并方便蛋白纯化。重组蛋白p75NTR169-Fc的生物活性实验研究显示:该重组蛋白能够抵抗 Aβ(25-35)对PC12的细胞毒作用,抑制由NGF刺激引起PC12细胞轴突的生长,具有同NGF抗体相同的效果。
材料与方法
1.材料:大鼠PC12嗜铬细胞瘤细胞系,购自北京协和医学院细胞中心,培养液为含有5%马血清及10%胎牛血清的RPMI 1640(Hyclone公司产品)。大肠杆菌菌株DH5α,用于质粒的扩增和转化;大肠杆菌菌株BL21(DE3)是pET系列质粒表达的宿主菌,质粒pET-28a(+)系蛋白表达载体,均由本室保存。Aβ(25~35)购自 Sigma公司;纯化基质 HiTrap rProtein A FF购自GE公司;神经生长因子NGF为R&D公司产品;兔源多克隆抗p75NTR抗体购自ABCAM公司;兔源多克隆抗NGF抗体购自Santa Cruze公司;辣根过氧化物酶标记的羊抗兔IgG购自北京中杉金桥生物技术有限公司。所有引物及基因测序由北京奥科生物有限公司完成。
2.方法:(1)p75NTR169的胞外区、IgG重链铰链区和Fc区结构域基因的扩增和拼接:参考 Gene Bank中已知的p75NTR全序列,用软件Oligo分析后设计如下一对引物:上游引物:5'-TATACCATGG GCAAGGAGGCATGCCCCACAG-3'(含NcoⅠ识别位点);下游引物:5'-tgg gca tgt gtg agt ttt gtc TGT AAT CCA ACG GCCAGG-3'(小写字母示IgG铰链区顺序,大写字母示p75NTR顺序)。免疫球蛋白IgG重链恒定区Fc的 DNA片段(216~443)顺序源自文献(Capon.D.et al.Nature,1986,337:525~531),其上游引物 P216:5'-GAC AAA ACT CACACA TGCCCA C-3',下游引物P433:5'- TCGAATTCTCATTTACCCGGAGACAGGGAG-3'(含EcoRⅠ识别位点)。以本组保存的pUC12-NGFR和人肝cDNA为模板,用上述引物分别扩增出p75NTR(1~169),Fc(216~433)基因顺序,再按照重叠PCR的原则和方法,将两组扩增产物混合变性、复性后再扩增,得到p75NTR(1~169)-Fc(216~433)融合基因,缩写为p75NTR169-Fc(图1)。(2)原核表达质粒pET28a-p75NTR169-Fc的构建:将上述融合基因p75NTR169-Fc经NcoⅠ、EcoRⅠ酶切和回收,与经 NcoⅠ、EcoRⅠ酶切的载体pET28a(+),在T4 DNA连接酶作用下连接,连接产物转化感受态细胞DH5α,挑选阳性克隆、重组质粒酶切鉴定,测定克隆片段核苷酸序列。(3)重组蛋白p75NTR169-Fc表达、纯化、超滤、除菌及定量:重组质粒转化宿主表达菌BL21(DE3),涂铺于含有卡那霉素抗性的LB固体培养基上,37℃倒置培养过夜。挑选单菌落接种于含有卡那霉素的2ml LB培养基中,37℃,250r/min振荡培养过夜,按1∶100的比例接种到含卡那霉素的新 LB培养基中,37℃,250r/min振荡培养2h,至 OD600在 0.5~1.0之间,加入 IPTG至终浓度为1mmol/L,于不同温度诱导表达12~18h。8000r/min离心10min收集菌体,加入细菌裂解液,超声破碎,12000r/min离心15min,收集上清和沉淀,SDS-PAGE凝胶电泳及Western blotting检测。利用AKTA层析系统以protein A亲和层析柱纯化样品,全程低温操作以防止蛋白降解。上样前,上清需经0.45μm微孔膜过滤。亲和层析操作:用结合缓冲液(20mmol/L PBS,pH 7.0)以1ml/min的流速平衡亲和柱;将过滤后的上清样品以0.6ml/min的流速上样,再用结合缓冲液以1ml/min清洗,直至基线,然后用洗脱缓冲液(0.1mol/L glycine-HCl,pH2.5)洗脱,收集洗脱峰,收集管中预先加入1mol/L,pH9.0 Tris- HCl 80 ~100μl/ml。将纯化后的样品倒入超滤管中,4℃离心30min,转速不超过6000r/min,将蛋白样品压缩至约5ml,加入PBS离心,重复2~3次,逐步更换缓冲液。0.22μm微孔膜过滤除菌,BCA方法定量,小量分装,-80℃保存。(4)重组蛋白p75NTR169-Fc基于细胞的功能实验:1)重组蛋白p75NTR169-Fc干预β-淀粉样肽Aβ(25~35)对PC12细胞毒的作用:以100μl,约1×104细胞/孔将PC12细胞接种在96孔板中培养,细胞贴壁后分别进行如下分组处理,A组:24h后,以1∶10体积加入终浓度为10μmol/L、5μmol/L、1μmol/L Aβ(25~35)作用细胞 24h,不含 Aβ(25 ~35)的为对照组;B组:24h后,以1∶10体积加入p75NTR169-Fc融合蛋白,终浓度为 1.2μmol/L、0.9μmol/L、0.6μmol/L、0.3μmol/L、0.1μmol/L,0μmol/L;C 组:24h 后,以1∶10体积加入终浓度5μmol/L Aβ(25~35)与不同浓度的p75NTR169-Fc(分别为 0、0.1、0.3、0.6、0.9、1.2μmol/L)。每组设 5 个平行孔,24h后进行MTT检测。2)p75NTR169-Fc重组蛋白阻止NGF引起的PC12细胞分化:以100微升/孔,约5×103细胞/孔接种PC12细胞于96孔板中培养。细胞贴壁约24h后,以1∶10体积加入终浓度50ng/ml的NGF与不同浓度的NGF抗体或 p75NTR169 - Fc(分别为 0、12.5、50、100ng/ml),设100ng/ml的p75NTR169-Fc及正常培养的PC12细胞为对照组,每组3个平行孔。48h后每组随机选取视野拍照。(5)Aβ(25~35)的准备:1mg的Aβ(25~35)用高压灭菌的去离子水溶解配成终浓度200μmol/L,-20℃存放。使用前在37℃温育24h。
3.统计学方法:采用SPSS18.0统计软件进行单因素方差分析,计量资料用均数±标准差)表示,P <0.05表示差异有统计学意义。
结 果
1.重组蛋白基因的获得、在原核中的诱导表达及亲和纯化:p75NTR包括胞外区(extracellular domain,ECD)、茎区、跨膜区(transmembrane,TM)、胞内区(intracellular domain,ICD)4 区(图 1A),p75NTR194-Fc含有170位氨基酸的蛋白酶裂位点(图1B),而p75NTR169-Fc保留了完整胞外区和部分茎区的共169个氨基酸,是由人IgG的铰链区链接Fc段融合而成,该重组蛋白不含有p75NTR 170位氨基酸以后顺序(图1C)。
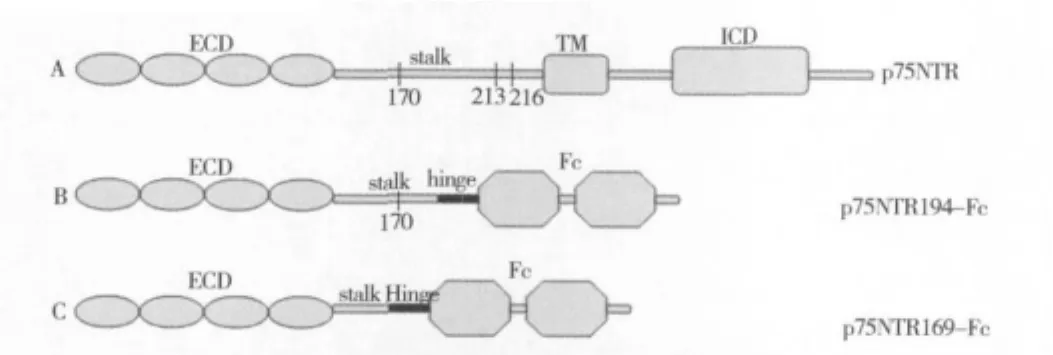
图1 抗酶裂嵌合体p75NTR169-Fc的设计
按照重叠PCR的原则和方法,将两组扩增产物混合变性、复性后再扩增,得到预期大小(1188bp)p75NTR169-Fc融合基因,如图2A。融合基因插入到表达载体pET28a(+)后,重组质粒经酶切及DNA测序证实片段的大小、碱基序列和读码框正确。表达质粒转化大肠杆菌BL21(DE3),经IPTG诱导表达后,SDS-PAGE电泳,发现在约50kDa大小处有一特异表达条带,见图2B。为进一步验证箭头所指条带为p75NTR169-Fc重组蛋白。经anti-IgG抗体及anti-p75NTR抗体进行Western blotting鉴定,50kDa特异条带确实为重组蛋白,见图2C。从图2B可见,蛋白的可溶性表达在25℃及37℃没有明显差异,所以在以后试验中,我们选择室温条件(约25℃)诱导表达。诱导表达的细菌裂解上清液经protein A亲和层析柱纯化,将分步收集到的蛋白进行SDS-PAGE电泳,银染鉴定,如图2D,可见纯化后杂蛋白较少,凝胶扫描纯度分析所得产品纯度可达到96%。
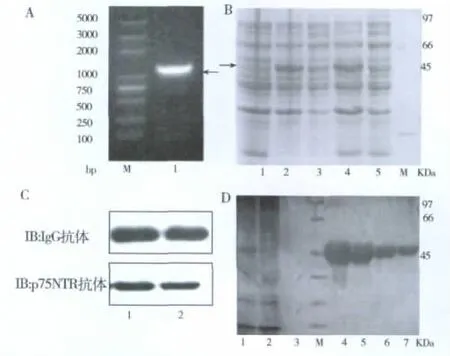
图2 重组蛋白基因的获得、在原核中的诱导表达、Western blotting鉴定及亲和纯化
2.p75NTR169-Fc重组蛋白抑制 Aβ(25~35)寡聚肽对PC12的细胞毒作用:根据文献报道,Aβ通过p75NTR促进细胞的凋亡[5~8]。本研究中,我们通过MTT检测Aβ(25~35)寡聚肽对PC12的细胞毒性,发现 PC12 暴露于 10μmol/L 和 5μmol/L Aβ(25~35)24h后,细胞活性显著下降,与不加 Aβ(25~35)的对照组相比,Aβ(25~35)引起的细胞凋亡有显著性差异(10μmol/L,5μmol/L:P <0.05),如图3A;单加0.1~1.2μmol/L的 p75NTR169-Fc重组蛋白对PC12细胞活性没有明显的影响(P>0.05),如图3B;如加入5μmol/L的 Aβ(25~35),同时又加入不同浓度的p75NTR169-Fc,与只加5μmol/L Aβ(25~35)的对照组相比,0.6μmol/L 至 1.2μmol/L p75NTR169-Fc均能抑制Aβ(25~35)引起的细胞凋亡,具有统计学意义(p<0.05),如图3C。每组实验重复3次以上,证明p75NTR169-Fc对 Aβ(25~35)寡聚肽引起的PC12细胞毒性有抑制作用。

图3 p75NTR169-Fc重组蛋白抑制Aβ(25~35)寡聚肽对PC12细胞的毒性作用
3.p75NTR169-Fc重组蛋白能够中和NGF引起的PC12细胞分化:NGF与p75NTR及TrkA结合可以促进细胞的分化,NGF抗体与NGF结合阻止其与受体相互作用。PC12细胞易分化,表现为细胞从圆形的半贴壁变为多边形或锥形的贴壁细胞,实验中,与只加培养基的对照组相比(图4B或图4C),加入NGF可以明显的引起PC12细胞体积变大并产生神经突起,长度可以达到细胞直径的3倍,如图4A;加入NGF与不同浓度的NGF抗体后,可以观察到NGF引起的PC12细胞分化受到不同程度的抑制,如图4D~F;加入 NGF与不同浓度的重组蛋白p75NTR169-Fc后,也可以观察到NGF引起的PC12细胞分化受到明显的抑制,如图4G~I。

图4 p75NTR169-Fc重组蛋白对NGF引起的PC12细胞分化的影响 (×100,48h)
讨 论
β-淀粉样肽[Aβ(40~42)]是一种神经毒性多肽,在AD病变中起到了主导作用[13]。它的低聚物是Aβ最强毒性形式,导致AD患者突触传导中神经元死亡、神经炎性病变和功能障碍[14]。脑中 Aβ的水平,是通过淀粉样前体蛋白(APP)分解产生的,正常生理状态下,新产生的Aβ与经过酶降解和运输清除掉的Aβ维持在一个动态平衡水平[15]。在神经退行性疾病的细胞研究模型中,上调或通过配体激活p75NTR 都 可 以 导 致 神 经 元 的 死 亡[8]。Aβ 与p75NTR结合后,其胞内区激活下游信号分子如JNK,NF-κB等以及介导tau蛋白磷酸化,最终介导细胞死亡[1]。基于上述主要理论,我们设计并在原核系统中成功的表达了重组蛋白p75NTR169-Fc,期望其类似p75NTR游离受体的活性能够结合Aβ并抵抗其毒性作用,为AD治疗开辟新途径。
重组人抗酶裂嵌合体蛋白p75NTR169-Fc保留了p75NTR完整的胞外区和茎部9个氨基酸,去掉了易受蛋白酶攻击的部分,使其不再被蛋白酶降解而提高了重组蛋白的稳定性,我们之前表达的重组蛋白p75NTR194-Fc稳定性差,极易被蛋白酶降解[16];在p75NTR169-Fc羧基端融合了IgG的Fc段,方便了蛋白纯化。在重组DNA设计时,通过合理使用质粒本身的酶切位点,目的蛋白不带有任何标签。经凝胶扫描纯度分析显示终产品纯度可达96%,为研究其活性提供了保证。此外Fc段蛋白的融合也为延长重组蛋白的半衰期提供了可能性。
Aβ(25~35)保留了Aβ全长的毒性,常用于Aβ的毒性研究。我们通过MTT法研究Aβ(25~35)对p75NTR阳性的PC12的细胞毒作用,表明10μmol/L、5μmol/L Aβ(25~35)作用24h可以明显杀伤 PC12细胞。而重组蛋白p75NTR169-Fc可以有效地抑制Aβ(25~35)引起的细胞毒性。有趣的是,在本研究中,重组蛋白p75NTR169-Fc的浓度600nmol/L比5μmol/L Aβ(25~35)低近10倍的情况下,仍可有效地与p75NTR竞争,可能与该重组蛋白氨基端的p75NTR的胞外区(ECD)对Aβ的高亲和力结合有关。
为了更好地研究重组蛋白p75NTR169-Fc与配基结合的生物学活性,我们通过PC12细胞轴突生长实验,发现重组蛋白可以抑制NGF引起的轴突生长。根据文献报道,p75NTR与trkA受体介导NGF引起的轴突生长和突触连接[2]。在我们的实验中,50ng/ml的NGF刺激PC12细胞轴突生长;同时加入NGF与NGF抗体或者重组蛋白p75NTR169-Fc,与只加NGF相比,神经轴突明显变短、数量变少,随着NGF抗体或者重组蛋白p75NTR169-Fc剂量的增加,抑制轴突生长的程度更加明显。毋庸置疑,NGF抗体是通过竞争游离的NGF,而减少NGF与受体相互作用的机会,而重组蛋白p75NTR169-Fc保留了和配体结合的胞外结构域,理论上讲,其可以和NGF结合,但由于其不含传递细胞外信号的跨膜区和胞内结构域,所以重组蛋白p75NTR169-Fc和p75NTR竞争结合 NGF,而不能发挥刺激轴突生长的功能。proNGF是NGF未经蛋白酶切割的前体,也是NGF在AD中存在的主要形式。有研究表明,proNGF通过p75NTR抑制神经轴突的生长。p75NTR169-Fc作为新型重组蛋白,与p75NTR竞争结合配体,有望在AD的治疗中,除了结合Aβ也能结合proNGF而发挥一箭双雕的作用。
针对p75NTR为药物靶点的研究,不少研究者做了很多的工作,如Yaar M等合成的NGFβ发夹环类似物可以和Aβ竞争结合p75NTR,从而保护神经元免受Aβ介导的毒性作用,而我们构建的重组蛋白p75NTR169-Fc与p75NTR竞争结合Aβ,同样是为了保护神经元免受Aβ的毒性作用。尽管该工作还有待更深一步的研究,但重组人抗酶裂嵌合体蛋白p75NTR169-Fc是一个有生物活性的新型抗凋亡蛋白,有可能为阿尔茨海默病等神经退行性疾病的治疗开辟了又一途径。
1 Roux PP,Barker PA.Neurotrophin signaling through the p75 neurotrophin receptor[J].Prog Neurobiol,2002,67(3):203 - 233
2 Schor NF.The p75 neurotrophin receptor in human development and disease[J].Prog Neurobiol,2005,77(3):201 -214
3 Chao MV.The p75 neurotrophin receptor[J].JNeurobiol,1994,25(11):1373-1385
4 Nykjaer A,Lee R,Teng KK,et al.Sortilin is essential for proNGF-induced neuronal cell death[J].Nature,2004,427(6977):843 -848
5 Sotthibundhu A,Sykes AM,Fox B,et al.Beta-amyloid(1-42)induces neuronal death through the p75 neurotrophin receptor[J].J Neurosci,2008,28(15):3941 - 3946
6 Costantini C,Rossi F,Formaggio E,et al.Characterization of the signaling pathway downstream p75 neurotrophin receptor involved in beta-amyloid peptide - dependent cell death[J].J Mol Neurosci,2005,25(2):141-156
7 Yaar M,Zhai S,Pilch PF,et al.Binding of beta-amyloid to the p75 neurotrophin receptor induces apoptosis.A possible mechanism for Alzheimer's disease[J].JClin Invest,1997,100(9):2333 -2340
8 Wu CK,Thal L,Pizzo D,et al.Apoptotic signals within the basal forebrain cholinergic neurons in Alzheimer's disease[J].Exp Neurol,2005,195(2):484-496
9 Coulson EJ,Reid K,Baca M,et al.The role of neurotransmission and the Chopper domain in p75 neurotrophin receptor death signaling[J].Prog Brain Res,2004,146:41 -62
10 Coulson EJ,Reid K,Baca M,et al.Chopper,a new death domain of the p75 neurotrophin receptor that mediates rapid neuronal cell death[J].J Biol Chem,2000,275(39):30537-30545
11 Welcher AA,Bitler CM,Radeke MJ,et al.Nerve growth factor binding domain of the nerve growth factor receptor[J].Proc Natl Acad Sci USA,1991,88(1):159 -163
12 Zampieri N,Xu CF,Neubert TA,et al.Cleavage of p75 neurotrophin receptor by alpha-secretase and gamma-secretase requires specific receptor domains[J].J Biol Chem,2005,280(15):14563 -14571
13 Dickson DW.Apoptotic mechanisms in Alzheimer neurofibrillary degeneration:cause or effect?[J].J Clin Invest,2004,114(1):23 -27
14 Pike CJ,Walencewicz AJ,Glabe CG,et al.In vitro aging of beta -amyloid protein causes peptide aggregation and neurotoxicity[J].Brain Res,1991,563(1 -2):311 -314
15 Roger N,Rosenberg MD.Translational research on the way to effective therapy for Alzheimer disease[J].Arch Gen Psychiatry,2005,62(11):1186-1192
16 周素芳,王欣,陈虹,等.p75NTR-Fc融合蛋白在毕赤酵母中的表达、鉴定和活性分析[J].中国生物化学与分子生物学报,2004,20(5):604-609
——一道江苏高考题的奥秘解读和拓展

