瘦素受体基因Gln223Arg多态性与中国北方汉族人2型糖尿病的关联研究
史晓红 孙 亮 王 沥 金 锋 朱小泉 唐 雷 杨 泽
瘦素受体(leptin receptor,Lepr)属细胞因子受体超家族,人类Lepr基因定位于染色体1p31。Lepr基因是T2DM的一个重要候选易感基因,目前已经发现多种Lepr基因的多态性,Lepr基因的多态性对T2DM的影响日益受到关注。本文旨在研究Lepr基因第6外显子内的Gln223Arg多态性与中国北方人T2DM发生发展的关系。
材料与方法
1.实验材料:(1)对象:所有研究对象选自2004~2005年北京地区和哈尔滨地区T2DM流行病学调查资料,本研究中病例样本为:有糖尿病家族史,且相互间无亲缘关系的T2DM患者333例,其中男性120例,女性213例,年龄40~89岁,平均年龄60.61±11.05岁。对照样本为:无糖尿病家族史的糖耐量正常者,无急性心脑血管疾病、内分泌疾病,且相互间无亲缘关系,共395例。其中男性181例,女性214例;患者年龄40~80岁,平均年龄47.50±6.25岁。所有受试者均为汉族人,均签署了知情同意书。T2DM诊断依据1999年WHO诊断标准:①有明确糖尿病病史;②空腹血浆葡萄糖≥7.0mmol/L和(或)口服葡萄糖耐量实验2h血糖≥11.1mmol/L。根据病史和家族史排除1型糖尿病、年轻起病的成人型糖尿病及线粒体性糖尿病。(2)主要试剂:全血DNA提取试剂盒购自北京天为时代科技有限公司;DNA marker购自天根生化科技(北京)有限公司;引物由上海生工生物技术有限公司合成;限制性内切酶Msp I购自TaKaRa公司;dNTP,Taq酶购自北京鼎国昌盛生物技术有限公司。(3)主要仪器:PCR扩增仪为美国MJ公司的PTC-225型PCR仪;凝胶成像系统为美国Bio-Rad公司的Gel DOC-2000成像系统。
2.方法:(1)基因组DNA的提取:取EDTA Na2抗凝的外周血0.3ml,用全血DNA提取试剂盒抽提基因组DNA。(2)PCR-RFLP分析 上游引物:5'-ACCCTTTAAGCTGGGTGTCCCAAATAG-3',下游引物:5'- AGCTAGCAAATATTTTTGTAAGCAATT-3'。PCR反应体系为20μl,其中包含10×PCR buffer 2μl,10mmol/L dNTP 0.4μl,引 物 (10pmol/μl)各0.4μl,Taq 酶(2.5U/μl)0.4μl,基因组 DNA(10ng/μl)2μl。扩增条件为95℃ 预变性5min;95℃ 变性 30s、64.1℃ 退火30s、72℃ 延伸30s,共35个循环,完成后72℃延伸7min。扩增产物用8%的聚丙烯酰胺凝胶电泳检测,Bio-Rad凝胶成像系统成像。PCR产物用Msp I酶进行消化,反应体系10μl,包含 Msp I(10U/μl)0.3μl、10 × buffer 1μl、0.1%BSA 1μl、PCR产物6μl,37℃酶切过夜,取4μl酶切产物用8%的聚丙烯酰胺凝胶电泳检测,凝胶成像系统成像,观察结果。
3.统计学方法:所有统计学分析均采用SPSS11.5软件完成。以Hardy-Weinberg平衡判断样本的代表性。相对风险用比数比(OR)值及其95%置信区间(95%CI)来评价。组间基因型频率及等位基因频率比较采用χ2检验,以p<0.05为差异显著性标准。
结 果
1.T2DM病例组与正常对照组一般特征比较:T2DM病例组与正常对照组相比,不仅表现为临床上血糖、血脂等指标的变化,其他身体特征和功能也与正常人群有一定的差异。包括T2DM病例组具有显著高的体质量指数(BMI),腰臀比,腰围,总胆固醇和三酰甘油。
2.基因型分析:包含Lepr基因第6外显子 Gln 223 Arg多态性的PCR产物长度为421bp,此多态性位点可被限制性内切酶Msp I识别。AA基因型不能被Msp I识别,GG基因型可被Msp I切割,可见294和127bp两条带;因此酶切后不同基因型的电泳带型分别为:AA(421bp),AG(421bp,294bp,127bp),GG(294bp,127bp)(图 1)。
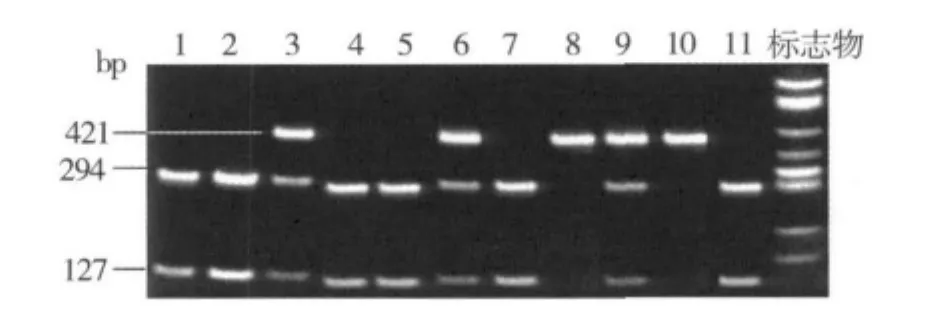
图1 Lepr基因第6外显子Gln23Arg变异基因分型图片1,2,4,5,7,11.GG 型;3,6,9.AG型;8,10.AA 型
T2DM组和正常对照组基因型频率经Hardy-Weinberg拟合优度检验,均符合Hardy-Weinberg平衡(P>0.05),表明此基因各基因频率已达遗传平衡,所选择的T2DM和正常对照样本均具有群体代表性。T2DM组和正常对照组间Lepr基因第6外显子Gln223Arg多态性基因型与等位基因频率的比较见表1。

表1 Lepr基因第6外显子Gln223Arg多态性的基因型与等位基因频率在2型糖尿病组和正常对照组中的分布比较[n(%)]
经自由度为2的χ2检验,Lepr基因第6外显子Gln223Arg多态性基因型频率在T2DM组与正常对照组间的分布存在显著差异(P=0.047)。对逐个基因型进行比较发现,GG基因型在病例组和对照组间的频率分布具有显著差异(P=0.024),GG基因型的携带能增加T2DM的患病风险(OR=1.55,95%CI:1.04~2.32)。χ2检验表明,Lepr基因第 6 外显子Gln223Arg多态性的等位基因频率在T2DM组与对照组间的分布有显著性差异(P=0.016)。
3.Lepr基因Gln 223 Arg多态性的多因素Logistic回归分析:由于年龄、性别可能作为T2DM的混杂因素,影响基因型参与T2DM发生风险的评价,而本研究选取病例对照样本的年龄和性别没有得到很好的匹配,因此对该研究多态性的基因型进行年龄和性别调整,排除其混杂效应,评价易感基因的多态位点的不同基因型独立于年龄和性别之外的风险。同时由于体质指数(BMI)和腰围对于T2DM的公认影响,同时在回归模型分析中引入BMI和腰围两个变量,见表 2。由表 2可见,Lepr基因第 6外显子Gln223Arg多态性与T2DM有显著的相关性(P=0.003)。GG基因型的携带能够增加T2DM的患病风险(OR=2.212,95%CI:1.316 ~3.717)。

表2 Lepr基因Gln223Arg多态性的多因素非条件Logistic回归分析
讨 论
Lepr基因又称糖尿病基因(diabetes gene,DB)。1995年人类的Lepr基因被定位克隆,并定位于染色体1p31,由20个外显子和19个内含子组成,共编码1165 个氨基酸[1]。
1996 年,Considine等[2]首次报道在人类 Lepr基因第6外显子上存在有Gln223Arg变异,该变异第6外显子第668位A→G的碱基突变,该突变位于瘦素受体的胞外区,其所编码的氨基酸由精氨酸(Arg)变成谷氨酸(Gln)。1997年Tuomi等报道该变异与芬兰白种人T2DM患者的血糖水平相关。2005年,Salopuro T等[3]在芬兰的DM干预研究中发现,Lepr基因Gln223Arg变异与IGT向T2DM的转归有关,Gln223Gln基因型的个体较Arg223等位基因的携带者相比,更容易发展为T2DM。Chagnon等[4]在魁北克人群中的研究提示Gln223Arg多态性与BMI相关。Van Rossum等[5]在荷兰青少年中的研究发现Arg223变异与高瘦素水平及增重相关。Ataka Y等[6]对太平洋岛民以及Duarte等对巴西人群的研究显示,该多态性与肥胖相关。Fnrusawa[7]对南部印度人的研究显示,该多态性与肥胖和 T2DM相关。而 Heo等[8]观察了3263例研究对象,包括非洲裔美国人、高加索白种人、丹麦人、芬兰人、法裔加拿大人、尼日利亚人,结果未发现Lepr基因Gln223Arg多态性与BMI或 WC 相关。在 Park等[9,10]对韩国人群的研究中,未发现该多态性与糖尿病的相关性[9,10]。Wang等对中国台湾人群的研究结果显示,该多态性与肥胖无相关性。这些表明Lepr基因Gln223Arg多态性与表型的关系存在种族的差异。目前为止,Gln223Arg多态性与T2DM的相关性仍存在争议。
本次对Lepr基因Gln223Arg变异的研究显示,对照组的G等位基因频率为88.6%、A等位基因频率为 11.4%,与上海地区正常汉族人 88.9%、11.1%,山西正常人群87.6%、12.4%,日本人报道的83.8%、16.2%以及韩国人报道的85%、15%分布相似,提示该等位基因频率分布在亚洲人种中可能保持一致;但与白种人的39.0%、61.0%分布存在极显著差异(p<0.001),提示该基因型和等位基因频率分布存在明显的种族差异。
本研究结果显示,在中国北方人群中Lepr基因Gln223Arg多态性的野生型纯合子GG在人群中最为常见,而在病例组和对照组中突变纯合型AA个体均极少。χ2检验结果显示,Lepr基因Gln223Arg多态性的基因型频率在T2DM组与正常对照组间的分布存在显著差异(P=0.047),GG基因型的携带能增加T2DM 的患病风险(P=0.024,OR=1.55,95%CI:1.04~2.32)。进行年龄、性别、BMI和腰围调整后,GG基因型的携带对增加T2DM患病风险的作用更加显著(P=0.003,OR=2.212,95%CI:1.316~3.717)。结果表明,Lepr基因 Gln223Arg多态性的GG基因型是中国北方汉族人罹患T2DM的风险基因型。
综上所述,本研究发现Lepr基因Gln223Arg多态性与中国北方汉族人T2DM的发生相关,GG基因型的携带能够增加T2DM的患病风险。对于Lepr基因Gln223Arg多态性对T2DM的影响机制还有待更深入的研究。
1 Tartaglia LA,Demmbis M,Weng X,et al.Identification and expression cloning of a leptin receptor[J].Cell,1995,83:1263 - 1270
2 Considine RV,Considine EL,Williams CJ,et al.The hypothalamic leptin receptor in humans:identification of incidental sequence polymorphisms and absence of the db/db mouse and fa/fa rat mutations[J].Diabetes,1996,45(7):992-994
3 Salopuro T,Pulkkinen L,Lindstrom J,et al.Genetic variation in leptin receptor gene is associated with type 2 diabetes and body weight:The Finnish Diabetes Prevention Study[J].Int J Obes(Lond),2005,29(10):1245-1251
4 Chagnon YC,Chung WK,Perusse L,et al.Linkages and associations between the leptin receptor(LEPR)gene and human body composition in the Quebec Family Study[J].Int JObes Relat Metab Disord,1999,23(3):278-286
5 Van Rossum CT,Hoebee B,Van BaakMA,et al.Genetic variation in the leptin receptor gene,leptin,and weight gain in goung Dutch adults[J].Obes Res,2003,11(3):377 - 386
6 Furusawa T,Naka I,Yamauchi T,et al.The Q223R polymorphism in LEPRis associated with obesity in Pacific Islanders[J].Hum Genet,2010,127(3):287 -294
7 Murugesan D,et al.Association of polymorphisms in leptin receptor gene with obesity and type2 diabetes in the local population of Coimbatore[J].Indian J Hum Genet,2010,16(2):72 -77
8 Heo M,Leibel RL,Fontaine KR,et al.A meta-analytic investigation of linkageand association of common leptin receptor(LEPR)polymorphisms with body mass index and waist circumference[J].Int J Obes Relat Metab Disord,2002,26(5):640-646
9 Park KS,Shin HD,Park BL,et al.Polymorphisms in the leptin receptor(LEPR)- -putative association with obesity and T2DM[J].JHum Genet,2006,51(2):85 -91
10 Han HR,Ryu HJ,Cha HS,et al.Genetic variations in the leptin and leptin receptor genes are associated with type 2 diabetes mellitus and metabolic traits in the Korean female population[J].Clinical Genetics,2008,74(2):105 -115

