内皮抑素对卵黄囊瘤裸鼠模型血管生长的影响
陈聪德 吴碎春 王 浩 陈肖鸣 张 华
自20世纪70年代Folkman提出血管生成抑制疗法以来,目前已发现了多种血管生长抑制因子,特别是近几年抗血管生成治疗发展迅速。血管内皮抑制素(endostatin,ES)是近年来发现的一种新的强效血管生成抑制因子,由于ES特异性地靶向作用于增生的内皮细胞,对转移性肿瘤和原发性肿瘤的种植瘤均有显著的抑制作用。但目前国内针对儿童生殖细胞肿瘤的抗血管治疗研究甚少,几乎未见报道。本实验采用国内首次建立的卵黄囊瘤移植瘤模型为实验对象,对内皮抑素的抗肿瘤作用进行深入研究[1]。
材料与方法
1.材料:(1)实验动物及标本:裸鼠BALB/C(nu/nu)小鼠40只,雌雄各半,3~4周龄,购自上海斯莱克实验动物有限公司。饲养于温州医学院实验动物中心SPF级实验室。肿瘤标本来源于小儿卵黄囊瘤荷瘤鼠第17代模型。已对荷瘤鼠肿瘤鉴定,证实保留原肿瘤生物学特性[1,2]。(2)主要试剂:重组人血管内皮抑制素注射液15毫克/(3毫升·支),避光保存于4℃冰箱,移液器量取,加入医用生理盐水,配制成溶液,浓度为 0.06mg/ml及 0.03mg/ml,现配现用。
2.方法:(1)动物模型建立:对荷瘤鼠第17代肿瘤生物学性质再次鉴定,证实具有良好的原肿瘤生物学特性。按照陈聪德等[1,2]人移植瘤模型建立的方法,把第17代肿瘤移植在40只雄性裸鼠单侧腹股沟皮下区。(2)成瘤模型分组:裸鼠按照高剂量组 1.5mg/(kg·d)、低剂量组 0.75mg/(kg·d)、实验对照组、空白对照组分组后开始重组人血管内皮抑制素注射液药物干预,每日测量裸鼠重量并记录,依照测得体重数据,计算用药量。实验对照组注射医用生理盐水25ml/(kg·d),空白对照组不予干预。于实验第7天开始干预,注射部位为肿瘤皮下及瘤内。每日定时注射药物,连续给药14天。(3)肿瘤生长测量:定期观察肿瘤生长情况,记录肿瘤生长的潜伏期和肿瘤生长速度,当肿瘤直径达3mm时,定人每隔5天用游标卡尺测量肿瘤的最大直径a及横径b,按公式V=π/6 ×a×b2计算肿瘤体积。取第 1、3、6、9、12、15 天肿瘤体积进行各组间点差异的比较。(4)免疫组化标记:雌性裸鼠各组5只,颈椎脱臼法处死,迅速剥离肿瘤,4℃生理盐水冲洗,观察肿瘤标本大体形态(表面及切面颜色、有无坏死灶),4%多聚甲醛固定液固定,石蜡包埋,连续切片。免疫细胞化学步骤参照SP试剂盒提供的说明书进行,AFP、CD34、VEGF的一抗浓度均为1∶100。用Image-pro plus软件进行图像分析。随机选取10个高倍视野,计数免疫组化阳性细胞数及测定阳性细胞的光密度。将两项数据相乘即为所测样本的免疫组化染色的相对定量结果(expression value,OD)。用CD34来计算血管密度(microvessel density,MVD),对肿瘤的新生血管形成进行量化。(5)肿瘤血管造影:1)药物干预完成后,每组取雄性裸鼠各5只,4%水合氯醛溶液12ml/kg腹腔注射麻醉,沿胸骨左缘打开胸腔,剪开心包膜,暴露心尖部,心尖部穿刺,明胶-氧化铅悬浊液75ml/kg灌注,至裸鼠鼻尖、趾缘、尾尖、虹膜及肿瘤表层血管变色产生橘红色斑片状,清洁裸鼠体表,4℃冷藏过夜以便明胶凝集。2)球管至台面的高度为102cm,曝光时间为0.25s,电流为100mA,电压为45V,X线拍片。3)拍片后以Image-Pro Plus图像分析软件计算肿瘤血管网平面面积,计算面积比率,面积比率=肿瘤血管网平面面积/肿瘤平面面积,对面积比率进行各组间比较。
3.统计学方法:全部数据经SPSS 13.0统计软件进行分析,数据以均数±标准差)表示,多组间比较用单因素多重方差分析,组间两两比较方差齐者用LSD检验,方差不齐者用Dunnett'T3检验,取α=0.05作为检验水准,以p<0.05为差异具有显著性,p<0.01为差异具有高度显著性。
结 果
1.各组肿瘤生长状况:裸鼠移植肿瘤组织后1周,全部接种成功,瘤体开始生长(图1)。给药第1天(即分组后)及第3天测量各组间肿瘤体积均无明显差异(F=0.567,P >0.05),自第 6 天测量内皮抑素治疗组,肿瘤生长受到明显抑制,肿瘤生长速度明显低于对照组(F=14.254,P <0.01);第12天测量结果提示高剂量组与低剂量组肿瘤体积出现显著差异(F=12.989,P <0.01),实验对照组与空白对照组比较,各时间点肿瘤体积测量结果均无差异。至实验结束,内皮抑素高剂量治疗组,平均肿瘤抑制率随治疗时间的推移持续增长,最高抑瘤率为第15天测得49%,明显高于低剂量治疗组及实验对照组;低剂量治疗组肿瘤抑制率曲线稍有波动,最高抑瘤率为第15天测得31%;实验对照组肿瘤抑制率低,且呈下降趋势,与高剂量组及低剂量组差异明显(F=15.147,p<0.01),不同剂量间肿瘤抑制率存在差异(F=9.628,P <0.05)(表1)。
图1 第18代卵黄囊瘤移植瘤模型

表1 各实验组肿瘤体积测量结果(mm3)
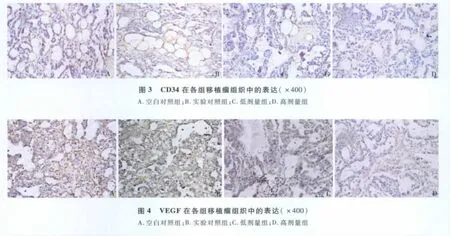
2.免疫组化结果:各实验组肿瘤切片中均可见不同程度的AFP表达(图2),AFP定位于胞质,染色阳性者呈黄棕色,细胞核及周围细胞间质无AFP表达处,苏木素染色呈蓝色。CD34表达,从高剂量、低剂量、实验对照、空白对照的 OD 值为 7.24±4.01、12.28 ±5.59、22.32 ±3.75、22.52 ± 3.06,高剂量组MVD值明显低于低剂量组(F=18.852,P <0.01)及两对照组(F=20.198,P <0.01),低剂量组 MVD 值低于两对照组(F=11.323,P <0.01),两对照组之间无明显差别(F=1.658,P >0.05)(图 3)。各实验组从高剂量、低剂量、实验对照、空白对照的VEGF的OD 值为 12.40 ± 3.25、9.50 ± 3.12、7.08 ± 2.93、7.48±2.39,表达强度上,两对照组均较强且之间无明显差别(F=1.459,P >0.05),低剂量组弱于实验对照组(F=11.225,P <0.05),强于高剂量组(F=15.978,P <0.01)(图4)。
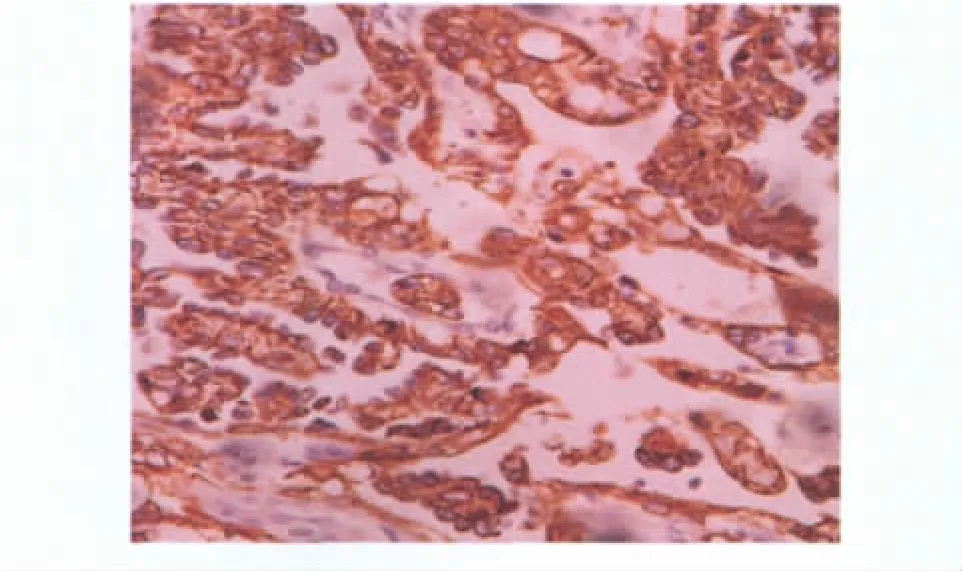
图2 移植瘤组织AFP表达(×400)
3.肿瘤血管明胶-氧化铅造影:荷瘤裸鼠血管灌注并拍片后,由X线片可以发现经药物干预的组别,肿瘤内部未见明显的坏死空腔,两个对照组个别肿瘤内部可以见到偏心性坏死空腔。肿瘤周边部位正常血管。各实验组肿瘤血管面积比率:高剂量组0.36±0.12、低剂量组 0.49 ±0.04、实验对照组 0.69 ±0.07、空白对照组0.65±0.12。治疗组与对照组之间存在显著差异(F=12.989,P <0.01),两治疗组之间存在差异(F=1.275,P <0.05)。
讨 论
睾丸生殖细胞肿瘤的发生率在过去的40年里增加了2倍,达7.5/10万人[1]。而儿童生殖细胞肿瘤占小儿睾丸肿瘤的60% ~75%,其中以卵黄囊瘤最多。我们首次在国内建立了卵黄囊瘤裸小鼠移植瘤模型,并通过对其生物学特性的鉴定,已经成功应用于对卵黄囊瘤的抗肿瘤研究[2]。本次研究选取卵黄囊瘤模型,为血管密度高、血运丰富的恶性实体瘤,而且血道转移较多,目前国内尚无针对该瘤血管治疗的相关报道。
自20世纪70年代Folkman提出血管生成抑制疗法以来,发现了很多具有血管抑制活性的药物,由其是近几年抗血管生成治疗发展迅速[3~5]。针对血管内皮细胞的抗血管生成疗法具有针对肿瘤细胞的化疗所不可比拟的优越性,肿瘤细胞具有基因突变性,因而化疗容易产生耐药性且不良反应大,而肿瘤内的血管具有基因的相对稳定性,因而不易耐药,重复给药有效。而血管内皮抑制素(endostatin,ES)是近年来发现的一种新的强效血管生成抑制因子,可通过抑制内皮细胞增生和迁移、拮抗肿瘤新生血管生成,阻断肿瘤血液供应,抑制肿瘤生长而使其进入“休眠状态”并导致凋亡[6,7]。体内外实验表明,ES显示出强大的特异性抑制血管内皮细胞增殖的作用,由于ES特异性地靶向作用于增生的内皮细胞,对转移性肿瘤和原发性肿瘤的种植瘤均有显著的抑制作用,一般不会诱发骨髓抑制和胃肠道反应等化疗药物常表现出的不良反应[8~11]。
本实验结果提示,肿瘤组织中VEGF含量,高剂量组<低剂量组<实验对照组≈空白对照组。关于ES对VEGF的影响机制仍不十分清楚,Hohenester等[12]的研究认为内皮抑素可能是与bFGF和VEGF竞争细胞表面的硫酸肝素黏蛋白类,阻挡有丝分裂生长因子的信号传导,抑制内皮细胞增殖,并阻止内皮细胞移向bFGF,从而抑制血管生成。目前较肯定的信号传导通路有:通过抑制EGFR、Raf-Ras-MEK-MAPK、STAT3和PI3K-AKT等信号传导途径下调VEGF[13];通过Thrombin受体启动PAR -1和PAR -2通路,下调血管内皮生长因子(VEGF)的mRNA和蛋白质表达,从而减少其产生;影响内皮细胞上一氧化氮合成酶的活性,减少VEGF诱导的一氧化氮的生成,从而抑制了VEGF介导的内皮细胞迁移和血管的形成。ES可能通过上述或者尚未知的途径对肿瘤组织内的VEGF起作用,从而减少其在肿瘤组织中的含量,进而抑制新生卵黄囊瘤血管发生及进展,但具体机制仍需后续研究发现。
本实验首次选择明胶-氧化铅悬浊液作为造影剂应用于卵黄囊瘤裸鼠移植瘤模型。氧化铅是解剖标本血管灌注造影最常用的造影剂之一,管径0.1mm的动脉也可以清晰显影,造影效果保留相对之间较长可以反复拍片观察,并且操作简便,价格低廉,适用肿瘤血管的观察。本实验结果非常直观地显示,经内皮抑素干预后,肿瘤体积明显小于未经干预者,肿瘤内血管管径较小,血管分布范围及密度低,面积比率高剂量组<低剂量组<实验对照组≈空白对照组。也验证了内皮抑素抗血管生成治疗的靶点是新生的卵黄囊瘤血管的观点。
通过研究笔者发现,ES抑制卵黄囊瘤VEGF的生成,减少其对血管内皮的作用,从而减少血管生成,从而抑制卵黄囊瘤裸鼠移植瘤的生长。为卵黄囊瘤的临床抗血管生成治疗提供有效的实验依据。
1 陈聪德,陈肖鸣.顺铂诱导体外培养儿童睾丸卵黄囊瘤细胞凋亡机制研究[J].中华小儿外科杂志,2009,30(7):423-426
2 陈聪德,陈肖鸣.卵黄囊瘤裸鼠移植瘤模型的建立及其生物学特性的研究[J].中华小儿外科杂志,2010,30(3):176-179
3 Folkman J.Antiangiogenic gene therapy [J].Proc Natl Acad Sci USA,1998,95(16):9064- 9066
4 Kong HL,Crystal RG.Gene therapy strategies for tumor antiangiogenesis[J].Natl Cancer Inst,1998,90(4):273 - 286
5 Cao Y.Endogenous angiogenesis inhibitors:angiostatin,endostatin,and other proteolytic fragments[J].Prog Mol Subcell Biol,1998,20:161-176
6 Perletti G,Concari P,Giardini R,et al.Antitumor activity of endostatin against carcinogen-induced rat primary mammary tumors[J].Cancer Res,2000,60(7):1793- 1796
7 Ziche M,Donnini S,Morbidelli L,et al.Development of new drugsin an giogenesis[J].Curr Drug Targets,2004,5:485
8 Luo X,Slater JM,Gridley DS.Enhancement of radiation effects by pXLG - mEndo in a lung carcinoma model[J].Int JRadiat Oncol Biol Phys,2005,63(2):553- 564
9 Bloch W,Huggel K,Sasaki T,et al.The angiogenesis inhibitor endostatin impairs blood vessel maturation during wound healing[J].FASEB J,2000,14(15):2373- 2376
10 Abraham D,Abri S,Hofmann M,et al.Low dose carboplatin combined with angiostatic agents prevents metastasis in human testicular germ cell tumor xenografts[J].JUrol,2003,170(4 Pt 1):1388 -1393
11 Scharovskyo G,Binda MM,Rozados VR,et al.An giogenic andantian giogenic balance regulates concomitant antitumoral resistance[J].Clin Exp Metastasis,2004,21:177
12 Hohenester E,Sasaki T,Olsen BR,et al.Crystal structure of the angiogenesis inhibitor endostatin at 1.5 A resolution [J].Embo J,1998,17(6):1656-1664
13 Kuhn H,Hammerschmidt S,Wirtz H.Targeting tumorangiogenesis in lung cancer by suppression of VEGF and it s receptor-results from clinical trials and novel ecperimental approaches[J].Curr Med Chem,2007,14(30):3157-3165

