丝裂霉素C-聚乳酸凝胶兔气管外壁给药后体内释放量的测定
汤 瑶,孙 旭,李 响,彭莉莉,李进让,张双庆,闻 镍,于 敏,李佐刚,李 波
(1.中国食品药品检定研究院国家药物安全评价监测中心,北京 100176;
2.吉林大学生命科学学院,吉林长春 130012;3.中国人民解放军海军总医院,北京 100048)
聚乳酸(PLA)是近年来临床实验中最常用的合成高分子聚合物[1-2],已通过FDA批准。对于可降解植入剂的载体材料,PLA具备良好的生物相容性,对机体无毒性和无刺激性,对组织、血液、免疫等系统不产生副作用,聚乳酸在体内经非酶性酯键随机水解生成低聚物,最终转变为CO2和H2O排出体外,为体内正常的代谢产物。PLA的不对称碳链为非规整结构,有利于药物均匀分布于基质中,适用于药物释放系统[3-4]。
丝裂霉素 C(mitomycin C,MMC)是一种非特异性抗肿瘤抗生素,对多种实体瘤有效。MMC主要经静脉途径给药,全身化疗,对肿瘤细胞和正常细胞无特异性识别,具有骨髓抑制、胃肠道反应及肝肾功能障碍等毒副作用[5-7]。我们将MMC与PLA制成载药温敏型凝胶,药物以受控的方式从载体中释放,然后在局部组织上发挥药效作用,具有良好靶向性、保持药物活性、提高透膜能力、提高生物利用度,降低其毒副作用,提高疗效。
国外已有关于丝裂霉素C在动物和人体内的测定方法及药代动力学的研究报道[8-13],国内对MMC在生物基质中的液质联用方法报道较少。随着液质联用技术在体内药物分析领域中的大量应用[14-15],本研究采用超高效液相色谱-三重四极杆串联质谱(UHPLC-MS/MS)联用技术[16],建立简便快捷、灵敏专属的体内药物分析方法,研究丝裂霉素C-聚乳酸凝胶兔气管外壁给药后体内药物释放量,为丝裂霉素C的临床前药代动力学研究提供方法学支持。
1 材料与方法
1.1 仪器 Thermo Accela-TSQ Quantum Access超高效液相色谱-三重四极杆串联质谱仪(美国Thermo Fisher公司),配有电喷雾离子源(ESI)和Xcalibur 2.0.7色谱工作站;LABCONCO CentriVap台式冷冻离心浓缩仪(美国 LABCONCO公司);NEVAP112氮吹仪和OA-SYS加热系统(美国Organomation Associoates公司);Mettler-Toledo AX205电子天平(瑞士Mettler-Toledo公司);Advantec PWU-400型超纯水仪(日本Advantec公司);Eppendorf Centrifuge 5415R高速台式离心机(德国Eppendorf公司);Votex Genie-2涡旋仪(美国Scientific Industries公司)。
1.2 药品与试剂 丝裂霉素 C(Roche107409,纯度98%,购自罗氏公司),曲安奈德(批号:100055-200302,纯度>98%,中国食品药品检定研究院)。甲醇(色谱纯,Fisher Scientific公司),甲酸(色谱纯,批号CDK4581,Wako公司),水为自制超纯水,其余试剂均为分析纯。兔空白血浆为海军总医院采血制备,-70℃冻存,使用前复融,离心,取上清液使用。
1.3 药物体内缓释实验方法 成年健康新西兰大白兔30只,体质量为2~2.5 kg(海军总医院动物室),外科手术,分离气管前组织,对气管外壁(约第2~5气管环)不断搔刮至明显充血,形成瘢痕组织。分别将0.2 ml载有不同的药物剂量(0.05、0.1、0.2、0.4和0.6 mg)的聚乳酸凝胶与明胶海绵的混匀后置于损伤后的气管外壁,并用半圆形的硅胶管固定,逐层缝合手术切口,于给药前和给药后的1、3、7、10、14 和 21 d,由耳缘静脉采血 1 ml。将取得的全血置肝素抗凝处理过的离心管中,3 000 r·min-1离心 15 min,取上层血浆,置-70℃保存,待测。
1.4 血浆样品前处理方法 血浆室温解冻后,精密吸取200 μl兔血浆于4.0 ml eppendorf管中,加内标溶液10 μl(10 mg·L-1曲安奈德甲醇溶液),振荡混匀,再分别加入乙酸乙酯2.2 ml,振荡2 min,以6 000 r·min-14℃离心 5 min,取上清液 2.0 ml于40℃离心浓缩挥干后,加200 μl流动相复溶,振荡1 min,于7 000 r·min-14℃高速离心5 min,取上清液10 μl进样分析。
1.5 超高效液相色谱条件 色谱柱:Thermo Hypersil Gold C18(50 mm×2.1 mm,1.9 μm),预柱:Phenomenex Security Guard C18(4 mm×3.0 mm);流动相:甲醇:0.1%甲酸水溶液=90∶10,流速:0.2 ml·min-1,等度洗脱,柱温:35。进样量为 10 μl,整个分析时间为3 min。
1.6 质谱检测条件 离子化方式为电喷雾(ESI);选择反应监测(SRM);检测离子为正离子。鞘气压力(N2)为20 arb(3 500 kPa),辅助气压力(N2)为5 arb(1.5 L·min-1),碰撞气压力(Ar)1.5 mTorr(0.2 Pa),喷雾电压4 500 V,离子传输管温度为300℃,扫描时间为 0.2 s,扫描宽度为 0.2 amu。MMC的碰撞能量(CE)为15 eV,采集离子为m/z 335.2→242.2。内标物曲安奈德的采集离子为m/z 435.2→415.2(8 eV)/397.3(11 eV)。
1.7 标准样品和最低定量限(LLOQ) 于10支具塞离心管中加入兔空白血浆200 μl,精密加入MMC标准溶液,使血浆中 MMC浓度分别为 1,2,5,20,50,100,200,500,800,1 000 μg·L-1,按“血浆样品前处理方法”项下测定,记录样品及内标峰面积,用样品浓度对样品峰和内标峰面积之比作线性回归。配制6份MMC的血浆样品浓度为1 μg·L-1,并根据当日标准曲线求得每一样本的测定浓度。
1.8 准确度与精密度 考察日内、日间准确度与精密度(5 d)。按标准曲线配制方法制备含MMC(5,100,800 μg·L-1)低、中、高3 种浓度的含药血浆样品,测定后记录峰面积比值。根据随行标准曲线求得准确度与精密度。
1.9 提取回收率及基质效应 配制含MMC浓度为5,100,800 μg·L-1的血浆样品各 6 份,按“血浆样品前处理方法”项下操作,与相应浓度的纯品溶液,加入内标对比。测定后以提取后的色谱峰面积与相同浓度样品未经提取获得的色谱峰面积之比,计算提取回收率。
取空白血浆,除不加内标外,其余按“血浆样品前处理方法”项下操作得上清液,添加适当浓度的MMC标准溶液,测得的峰面积和以流动相添加MMC标准溶液测得的峰面积之比,在5,100,800 μg·L-1的3个浓度平行6份样品评价MMC在血浆中的基质效应。
1.10 稳定性考察 考察5和800 μg·L-1MMC血浆样品在室温放置0、2、4 h,-20℃冰箱内冷冻保存0、6、28 d及3次冻融循环后的稳定性。
2 结果
2.1 质谱条件的优化 取1.0 mg·L-1的MMC和内标物的标准溶液,在ESI源正离子检测方式下进行一级质谱分析(Q1扫描)和二级质谱分析(子离子扫描,Q2扫描),得到各自的碎片离子,进而优化喷雾电压和碰撞能量,以准分子离子与特征碎片离子产生的离子对强度得到最大时为最佳。将UHPLC与串联四级杆质谱仪连接,选择各自的监测离子对,再对离子传输管温度、透镜电压、鞘气压、辅助气压等进行优化,使进样溶液中样品的离子化效率得到最佳,得到本实验的质谱条件(见Tab 1):鞘气压20 arb(3 500 kPa),辅助气 5 arb(1.5 L·min-1)。
Tab 1中,MMC全扫描一级质谱得到准分子离子峰[M+H]+为基峰,对此峰进行产物离子全扫描质谱分析,主要生成碎片离子为m/z 242.2,该碎片离子峰为[M+H]+脱去HOCONH2得到m/z 274.1碎片离子峰[M+H-HOCONH2]+,继续脱去CH3OH得到的[M+H-HOCONH2-CH3OH]+峰,m/z 242.2碎片离子稳定且强度大,为基峰。内标曲安奈德全扫描一级质谱主要生成[M+H]+峰,对此峰进行产物离子全扫描质谱分析,曲安奈德碎片离子较多,选择响应较强且稳定的碎片离子,主要为:脱去HF生成m/z 415.2离子;进一步脱水生成m/z 397.3的离子。
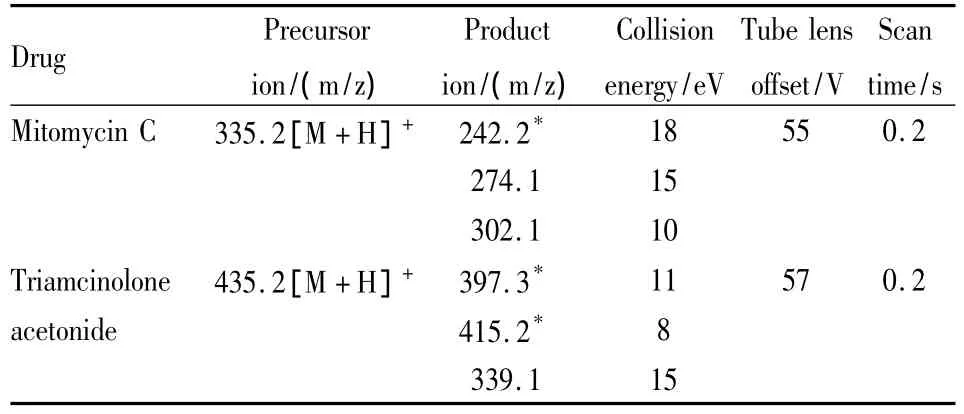
Tab 1 UHPLC-MS/MS parameters for mitomycin C and IS
2.2 色谱分离和专属性 在本色谱质谱条件下,测定乙酸乙酯萃取处理过的空白血浆样品、添加0.5 mg·L-1内标溶液的血浆样品、含有0.05 mg·L-1分析物和0.5 mg·L-1内标溶液的血浆样品和兔气管外壁给药后采集血浆样品,比较上述4种血浆样品选择反应监测模式(SRM)下获得的色谱图(见Fig 1)。采用优化后的色谱条件以及SRM方式,其专属性强,灵敏度高,血浆中的内源性物质不干扰分析物与内标物的测定,且内标物独立出峰不干扰分析物的分离。
2.3 标准曲线及最低定量限(LOQ) 按“1.5”项下方法测定的标准曲线为Y=0.007854X+0.0008116,r=0.997 7(权重系数 W:1/x2)。MMC血药浓度在1~1 000 μg·L-1范围内线性关系良好,相关系数对于0.997。对于灵敏度的测定,标准曲线的最低浓度被认为最低定量限(LLOQ),因此MMC 的 LLOQ 为 1 μg·L-1,其日内与日间准确度和精密度分别为94.88%(RSD=9.9%,n=6)和93.52%(RSD=6.9%,n=3),此浓度下MMC的偏差小于20%,标准曲线中其它各点的峰面积的偏差小于15%。以定量离子对3倍信噪比(S/N)的响应值对应的样品浓度作为检出限(LOD),因此MMC的 LOD 为 0.2 μg·L-1。
2.4 准确度与精密度 本方法的日内与日间准确度和精密度通过分析 5,100,800 μg·L-1这 3 个浓度水平的各6个血浆样品5 d内得到的,分别在95.71% ~105.44%(RSD≤6.9%,n=6)和93.71% ~106.0%(RSD≤5.8%,n=5)。结果表明,准确度与精密度在可接受范围内(±15%),符合生物样本测定指导原则的要求。
2.5 提取回收率与基质效应 MMC在低、中、高3个浓度的提取回收率分别为95.46%±3.68%、104.9% ±2.23%和92.54% ±2.64%,结果基本一致。基质效应分别为98.61% ±4.61%、94.95% ±2.89%和95.23% ±3.85%,没有观察到基质对于离子化(离子抑制或离子增强现象)的影响,本试验方法可以有效排除内源性物质对测定的干扰,提高灵敏度,能够在较低的浓度水平上完成MMC的定性和定量分析。
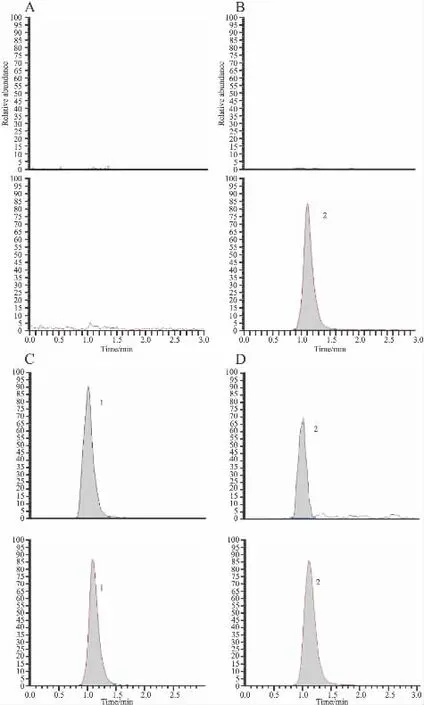
Fig 1 Typical UHPLC-MS/MS chromatograms of mitomycin C and triamcinolone acetonide in rabbit plasma
2.6 稳定性试验 MMC血浆样品(5和800 μg·L-1)在室温放置4 h测定结果分别为95.08% ±6.47%和100.9% ±3.26%,含量没有下降;将血浆样品于-20℃冰箱中分别储存28 d,测定结果分别为98.20% ±4.29%和105.2% ±3.91%,含量没有
出现变化;将血浆样品经历3次冻融循环后,测定结果分别为95.94% ±3.48%和101.0% ±2.42%,含量没有下降。结果表明,MMC在上述条件下稳定性良好,保证了分析过程中实验操作的可靠性。
2.7 兔血浆样品测试与方法应用 将本方法应用于兔气管外壁给药后血药浓度的测定中,每组6只成年健康兔,外科手术,将0.2 ml载有(0.05、0.1、0.2、0.4和0.6 mg)MMC的聚乳酸凝胶与明胶海绵的混合体置于气管外壁。于给药后不同时间采血,从耳缘静脉取血1 ml,测定血浆样品中的MMC浓度(结果见Tab 2)。
Tab 2 Plasma concentrations after single dose(0.05,0.1,0.2,0.4 and 0.6 mg)of mitomycinC-polylactide gel of ectotheca to rabbits(±s,n=6)

Tab 2 Plasma concentrations after single dose(0.05,0.1,0.2,0.4 and 0.6 mg)of mitomycinC-polylactide gel of ectotheca to rabbits(±s,n=6)
Time point Plasma concentration/μg·L -1 0.05 mg 0.1 mg 0.2 mg 0.4 mg 0.6 mg 1 d - - - 0.11 ±0.04 0.80 ±1.4 3 d - - - 0.13 ±0.07 -7 d 0.20 ±0.24 0.56 ±0.68 0.24 ±0.15 0.41 ±0.48 0.22 ±0.04 10 d 0.42 ±0.52 0.25 ±0.19 0.18 ±0.11 0.10 ±0.08 -14 d 0.20 ±0.19 0.36 ±0.25 0.11 ±0.03 0.11 ±0.06 0.22 ±0.15 21 d - - - 0.10 ±0.05 -
3 讨论
本文采用UHPLC-MS/MS方法,测定新西兰大白兔气管外壁给予丝裂霉素C聚乳酸凝胶后血浆内丝裂霉素C的浓度,并对体内可能释放的原型药物进行了初步确证与定量,方法专属性强、灵敏度高、分析时间短等特点,尤其适用于大批量生物样品测定。
本实验对样品前处理方法、色谱条件及质谱条件进行了优化。为了更有效地避免内源性物质的干扰,缩短样品前处理时间,选择乙酸乙酯为提取溶剂并去除血浆杂质,萃取效果好,易于分离,操作简单且回收率高。流动相中加入少量甲酸可以提高离子化效率,改善色谱峰形,提高灵敏度,有效排除内源性物质引起的基质效应。内标物的选择与丝裂霉素C性质相似,不干扰待测物的测定,并且得到良好分离。
质谱条件选择效应较高的ESI源,采用正离子方式检测,优化质谱参数。由一级质谱选择其分子离子,二级质谱选择其主要子离子,根据两者子离子的色谱峰面积比定量。这种定量分析方法具有很强的专属性,且定量准确。
聚乳酸被用作缓、控释系统的载体材料,用于半衰期短或口服生物利用度低的药物,其优点可在几周甚至几个月内以一定速率释放药物。丝裂霉素C与聚乳酸制成凝胶制剂用于局部给药,具有良好靶向性并保持药物活性,而体内缓释且吸收量少,血液浓度低,对全身的影响不大,可预防喉气管瘢痕组织形成并对瘢痕组织形成的抑制作用。
本文研究了丝裂霉素C-聚乳酸凝胶兔气管外壁给药后体内释放量,在反复摸索与调整试验中确定了UHPLC-MS/MS条件,通过方法学验证和应用,证明该方法具有灵敏度高、操作简便、快速、准确等优点,但测定的丝裂霉素C含量极低,无法进行药代动力学计算。可能是由于丝裂霉素C的给药部位为气管外壁,原型药物难以吸收入血,因此血浆药物浓度极低,且低于本方法的最低定量限,其结果有待于进一步证实。同时,还需摸索丝裂霉素C-聚乳酸凝胶的其它给药剂量或给药方式,并建立更灵敏的分析方法,以探究此剂型在体内的药动学行为。
[1]Sinha V R,Khosla L.Bioabsorbable polymers for implantable therapeutic systems[J].Drug Dev Ind Pharm,1998,24(12):1129-38.
[2]Mckeown S R,Cowen R L,Williams K J.Bioreductive drugs:from concept to clinic[J].Clin Oncol,2007,19(6):427-42.
[3]Jung Y K,Lee S Y.Efficient production of polylactic acid and its copolymers by metabolically engineered Escherichia coli[J].J Biotechnol,2011,151(1):94-101.
[4]Ho E A,Vassileva V,Allen C,Piquette-Miller M.In vitroandin vivocharacterization of a novel biocompatible polymer-lipid implant system for the sustained delivery of paclitaxel[J].J Control Release,2005,104(1):181-91.
[5]Boku N,Ohtsu A,Muro K,et al.A case of advanced gastric cancer complicated by severe toxicity induced by a combination of tegafur,uracil and mitomycin C,and associated with abnormal pharmacokinetics[J].Jpn J Clin Oncol,1996,26(5):379-83.
[6]Vestermark V,Havsteen H,Kamby C.Lack of effect from mitomycin c plus 5-fluorouracil in platin-resistant ovarian cancer a phase Ⅱ study[J].Int J Gynecol Cancer,1995,5(5):386-9.
[7]Adjadj E,Roy S,Zimmermann C,et al.Dosage and kinetics of MMC release of a collagen implant used as a delivery device in glaucoma surgery in the rabbit eye[J].J Fr Ophtalmol,2006,29(9):1042-6.
[8]Sato M,Onishi H,Takahara J,et al.In vivodrug release and an-titumor characteristics of water-soluble conjugates of mitomycin C with glycol-chitosan and N-succinyl-chitosan[J].Biol Pharm Bull,1996,19(9):1170-7.
[9]van Ruth S,Mathot R A,Sparidans R W,et al.Population pharmacokinetics and pharmacodynamics of mitomycin during intraoperative hyperthermic intraperitoneal chemotherapy[J].Clin Pharmacokinet,2004,43(2):131-43.
[10]Cerretani D,Roviello F,Pieraccini M,et al.Pharmacokinetics of intraarterial mitomycin C in hypoxic hepatic infusion with embolization in the treatment of liver metastases[J].Vascul Pharmacol,2002,39(1-2):1-6.
[11]Song J S,Kim J H,Yang M H,et al.Concentrations of mitomycin C in rabbit corneal tissue and aqueous humor after topical administration[J].Cornea,2006,25(10 Suppl 1):S20-S3.
[12]Xu Y,Kolesar J M,Schaaf L J,et al.Phase I and pharmacokinetic study of mitomycin C and celecoxib as potential modulators of tumor resistance to irinotecan in patients with solid malignancies[J].Cancer Chemother Pharmacol,2009,63(6):1073-82.
[13]Gu Y,Wang G J,Sun J G,et al.A new method for plasma citrate determination by reversed-phase high-performance liquid chromatography after ultrafiltration extraction:an example for bioequivalence evaluation of a medicinal endogenous substance[J].Methods Find Exp Clin Pharmacol,2008,30(7):513-20.
[14]刘子修,刘史佳,居文政,等.UPLC-MS法测定大鼠血浆中积雪草苷的浓度及其药代动力学研究[J].中国药理学通报,2010,26(4):543-6.
[14]Liu Z X,Liu S J,Ju W Z,et al.Pharmacokinetic study of a siaticoside in rat plasma by UPLC-MS[J].Chin Pharmacol Bull,2010,26(4):543-6.
[15]白永涛,文红梅,周 华,等.UPLC法测定大鼠血浆中大豆苷元浓度及药动学研究[J].中国药理学通报,2010,26(11):1512-5.
[15]Bai Y T,Wen H M,Zhou H,et al.Determination of daidzein and its pharmacokinetics in rat plasma by UPLC[J].Chin Pharmacol Bull,2010,26(11):1512-5.
[16]汤 瑶,张双庆,李 响,等.超高效液相色谱-串联质谱法测定兔血浆中的丝裂霉素 C[J].色谱,2012,30(2):154-9.
[16]Tang Y,Zhang S Q,Li X,et al.Determination of mitomycin C in rabbit plasma by ultra-high performance cipid chromatography-trndem mass spectrometry[J].Chin J Chromatogr,2012,30(2):154-9.

