聚乙二醇重组人粒细胞集落刺激因子注射液Ⅰ期临床药代动力学和药效学研究
韩晓红,张春玲,刘 鹏,宋媛媛,姚嘉瑞,秦 燕,唐 乐,张淑香,李 丹,冯 云,石远凯
(北京协和医学院中国医学科学院肿瘤医院肿瘤研究所内科,北京 100021)
化疗是目前治疗肿瘤的主要手段之一,但化疗药物造成的不良反应如骨髓抑制等不仅给患者增加了感染、出血等风险,同时还直接影响了化疗的顺利进行。
重组人粒细胞集落刺激因子(recombinant human granulocyte colony-stimulating factor,rhG-CSF)是一种防治肿瘤化放疗引起的中性粒细胞减少症的有效药物,它与表达在中性粒细胞及其祖细胞表面的高亲和性、特异性受体结合,促进粒细胞系的造血干细胞的分化和增殖,促进骨髓中成熟的中性粒细胞向外周血释放,同时刺激造血干细胞向外周血释放[1]。但因rhG-CSF易被酶水解和肾脏清除,在体内半衰期短,需每日给药,重复注射不仅增加了患者的痛苦,也会引起一些不良反应。目前,为了解决这些问题,降低酶解机会,增加稳定性,延长血浆消除半衰期,减小血药浓度波动,许多药品研究机构进行了大量长效rhG-CSF制剂的研究,部分制剂已上市,如美国Amgen公司生产的PEG-rhG-CSF(商品名Neulasta)。
北京双鹭药业股份有限公司研发的PEG-rhGCSF制剂,通过基因重组技术在大肠埃希菌表达并纯化rhG-CSF,以分子质量为20 ku的PEG共价修饰后制成制剂。经国家食品药品监督管理局批准(临床研究批件号:2009L01505),在中国医学科学院肿瘤医院开展Ⅰ期临床研究。
1 材料与方法
1.1 药品、试剂和仪器 聚乙二醇重组人粒细胞集落刺激因子注射液(PEG-rhG-CSF,规格:1.0 g·L-1/支,批号:20090401,由北京双鹭药业股份有限公司研制),重组人粒细胞集落刺激因子注射液(rhG-CSF,规格:150 mg·L-1/支,北京双鹭药业股份有限公司生产)。Human G-CSF ELISA试剂盒,美国R&D Systems。超纯水处理系统(型号:MILLIQ),美国密理博公司;酶标仪(型号:680型),美国伯乐公司;血细胞分析仪(型号:XT-1800i),日本希森美康;流式细胞仪(型号:FACSCalibur),美国BD公司;全自动生化分析仪(型号:Modular P-800),瑞士罗氏公司。
1.2 受试患者入选标准 经病理组织学或细胞学确诊的肿瘤患者;KPS评分≥60,年龄18~75岁,男女不限,预计生存期3个月以上;既往未接受过放疗、化疗;骨髓造血功能正常(骨髓穿刺细胞学检查示骨髓增生活跃,且未见恶性肿瘤细胞浸润);外周血常规正常,无出血倾向;无明显心功能障碍或代谢性疾病,肝功能指标AST、ALT、总胆红素均在正常上限的2.5倍以内,肌酐、尿素氮均在正常上限的1.5~2倍以内,自愿受试并签署知情同意书;能遵守试验用药及血液样品采集规程。
临床试验方案、临床病例报告表、知情同意书等均取得中国医学科学院肿瘤医院GCP中心伦理委员会审批并备案。
1.3 受试者一般情况 入组受试患者共24例,其中14例男性,10例女性,中位年龄为57岁(34岁~69岁),23例非小细胞肺癌患者,1例鼻咽癌患者(Tab 1)。
Tab 1Patient characteristics by dosage group(±s,n=8)

Tab 1Patient characteristics by dosage group(±s,n=8)
Characteristic Group 60 μg·kg-1100 μg·kg-1150 μg·kg -1 Sex Male 5 5 4 Female 3 3 4 Age(years)Mean 54.3 52.8 59.1 Median 57.5 52.5 58 SD 7.1 9.9 4.5 Range 41~62 34~69 53~67 Baseline ANC(×109cells·L-1)Mean 5.66 4.75 5.30 Median 5.55 4.76 5.20 SD 1.5 1.4 1.7 Range 3.69 ~8.1 2.69 ~7.36 2.95 ~8.01 Cancer type Non-small cell lung cancer 7 8 8 Nasopharyngeal cancer 1 0 0
1.4 试验设计 本研究为单中心、开放性剂量递增的Ⅰ期临床试验,受试患者均采用以卡铂和紫杉醇为基础的2个周期化疗方案,用药剂量分别为紫杉醇175 mg/m2,化疗周期 d 1静脉输注3 h,卡铂AUC 5化疗周期d 1静脉输注30 min,21 d为一周期,两个化疗周期用药剂量和时间相同。
第1周期化疗时不用PEG-rhG-CSF或其它升白细胞药物,但当 ANC<0.5×109cells·L-1或ANC <1.0×109cells·L-1且伴有发热时,每日1次皮下注射rhG-CSF 150 μg,至连续2次外周血白细胞数(WBC)≥10×109cells·L-1或 ANC≥5.0×109cells·L-1时停止给药。
第2周期在化疗药物给药结束后48 h皮下注射PEG-rhG-CSF 1次,参照费氏递增法,递增剂量分别为60、100、150 μg·kg-13 个剂量组(每一剂量组受试患者8例,同一受试患者不进行重复试验,从小剂量开始,每个剂量观察结束后,才可进行下一剂量。不可同时进行2个以上剂量组的试验。如出现重度不良反应或半数以上受试者出现中度不良反应,即使未达到最大剂量,均停止试验)。
1.5 样本采集
1.5.1 PEG-rhG-CSF血药浓度监测 分别于PEG-rhG-CSF 给药前 3 0 min(0 h)、给药后2、4、8、12、16、24、36、48、72、96、144、216、288、360、432 h 于静脉采血并分离血清,于-80℃冰箱保存,备测。
1.5.2 血常规及CD34+检查 血细胞分析仪测定血常规,流式细胞仪检测CD34+细胞,第一周期化疗期间从化疗d 2起隔日检查血常规,直到化疗周期的d 20结束。第2周期化疗期间从化疗d 2起每日定时检查血常规(含ANC)及CD34+细胞,至d 14(其中d 3注射PEG-rhG-CSF后12 h加测一次血常规及CD34+细胞),以后隔日检查一次直到化疗周期的d 20结束。
1.5.3 血清生化指标检查 两个化疗周期的给药前、化疗周期中d 8、15利用全自动生化分析仪分别检测谷丙转氨酶、谷草转氨酶、碱性磷酸酶、总胆红素、血糖、尿素氮、血清肌酐、β2微球蛋白等血清生化指标。
1.6 血药浓度测定 使用Human G-CSF检测试剂盒,按试剂盒说明书操作步骤,进行血清中rhG-CSF浓度检测。
1.7 数据处理及分析 用Microcal origin 8.0软件以四参数方程拟合标准曲线,WinNonlin 5.2.1软件进行药代动力学参数分析,并计算AUC0-t、CL_F等参数,Excel for Windows(2007版,微软公司)进行数据处理,实验结果数据以±s表示,利用SPSS 13.0统计软件进行单因素方差分析。
2 结果
2.1 方法学研究 本方法的准确度和精密度良好,均符合生物样品的测定要求,用试剂盒定量检测血清中的 P EG-rhG-CSF浓度,经试验验证,在39~2 500 ng·L-1范围内,呈现良好的线性。标准曲线用四参数方程进行拟合,相关系数均大于0.99。本试验最低定量限为标准曲线的最低浓度,即39 ng·L-1。方法学考察结果显示,日内精密度(RSD%)为4.3% ~6.8%,日间精密度(RSD%)为 4 .7% ~13.3%,准确度(RE%)为 -5.0% ~2.7% 。同时验证了血清样本在室温放置2 h及-20℃放置8周稳定性均良好。血清样品的稀释因子范围为5~300。用6个健康人的空白血清配制与质控样品相同浓度的高、中、低3个浓度样品,每个浓度进行3个平行样品考察是否存在基质效应,结果显示低浓度点 RE%小于20%,中、高浓度点 RE%均小于15%。另外该试剂盒与IL-2、IL-3、GM-CSF、IFN-γ、TNF-α等多种细胞因子均无明显交叉反应。
2.2 血药物浓度测定结果 测定各剂量组不同采血时间点血清中药物浓度,绘制平均血药浓度-时间曲线(Fig 1)。

Fig 1 The concentration-time curve of subjects after injecting different doses of PEG-rhG-CSF(±s)
2.3 药代动力学研究 药代动力学研究结果(Tab 2),将3个剂量组间Tmax、T12进行比较,低、中剂量组差异不具有统计学意义(P>0.05),低、中剂量组与高剂量间差异均具有统计学意义(P<0.05)。提示给药剂量 < 100 μg·kg-1,吸收速率和半衰期并未受到给药剂量的影响,但当给药剂量 > 100 μg·kg-1,可能是由于给药部位及体内的受体达到局部饱和状态,导致吸收速率和半衰期延长。3个剂量组间Vz_F差异较小(0.935~0.821 ml·g-1)(P>0.05),提示表观分布容积并未受给药剂量影响;3个剂量组间 A UC0-t,Cmax,CL_F 比较,低、中、高剂量差异均具有统计学意义(P<0.05),随着给药剂量的增加,AUC0-t增加,Cmax增加,CL_F 降低,提示药物在体内存在一定的蓄积,在当前给药剂量范围内,PEG-rhG-CSF在体内呈现非线性的药代动力学特征。
2.4 药效学研究
2.4.1 两个周期中ANC动态变化 rhG-CSF是防治肿瘤化放疗引起的中性粒细胞减少症的有效药物,通过检测患者外周血中性粒细胞绝对计数(ANC)可以初步判断其疗效。观察各剂量组第1周期ANC变化(Fig 2),第1周期3个剂量组ANC第1峰值均值分别为(9.0±5)、(12.7±3)、(5.8±1)×109cells·L-1,ANC 最 低点均值分别为(1.0 ±1)、(0.7 ±0.1)、(1 ±1)×109cells·L-1,最低点时间为13、11、15 d,在60 μg·kg-1剂量组有3 位患者在化疗过程中出现Ⅳ度骨髓抑制,注射了rhG-CSF,故ANC呈现双峰变化。
Tab 2Pharmacokinetic parameters of PEG-rhG-CSF(±s)

Tab 2Pharmacokinetic parameters of PEG-rhG-CSF(±s)
Parameter Group 60 μg·kg-1 100 μg·kg-1150 μg·kg -1 T 12/h 37.5 ±7 40.8 ±12 80.7 ±48 Tmax/h 16±10 23±7 33±8 Cmax/mg·L-1 112.41 ±61 199.49 ±75 371.5 ±145 AUC0-t/mg·h·L -1 5,593.6 ±5,435 14,651.3±12,183 23,002.5 ±6,655 Vz_F/ml·g-1 0.935 ±0.634 0.576 ±0.327 0.821 ±0.576 CL_F/μl·h-1·g-117±9 9±4 7±2

Fig 2 The contrast of ANC among different drug dose groups in the 1st chemotherapy cycle(±s)
各剂量组第2周ANC均呈现双峰变化(Fig 3),3个剂量组ANC第1峰值分别为(35.0±10)、(25.2±5)、(27.4 ±11)×109cells·L-1,3 个剂量组的ANC均值最低点依次为(1.9±1)、(2.3±2)、(6.6 ±5)×109cells·L-1,最低点时间点为 7、7、2 d,第2峰值分别为(7.8±3)、(11.0±3)、(16.7±9)×109cells·L-1。随着给药剂量的提高,ANC最低值、第2峰的峰值均有增高趋势,各剂量组的ANC的变化与PEG-rhG-CSF呈现一定程度的量效关系。
对比第1周期和第2周期的ANC平均值,第2周期的第1峰值、最低值均高于第1周期,ANC最低值出现时间前移。
2.4.2 药代动力学和药效学联合分析 第2周期各剂量组ANC与血药浓度的动态变化拟合图显示(Fig 4),以100 μg·kg-1为例,该剂量组 ANC 在化疗周期的d3起开始下降,到d7降到最低点,期间PEG-rhG-CSF于d 3达到峰值,随后开始缓慢下降;在d 7~10之间ANC持续上升,d 10达第2峰,此后ANC数值维持在一个较高的水平,此时PEG-rhG-CSF的血药浓度开始迅速下降。血药浓度变化与ANC值呈现相关性,且药效峰值的出现时间滞后于血药浓度峰值出现的时间,药物的效应与血药浓度存在一定的滞后性。
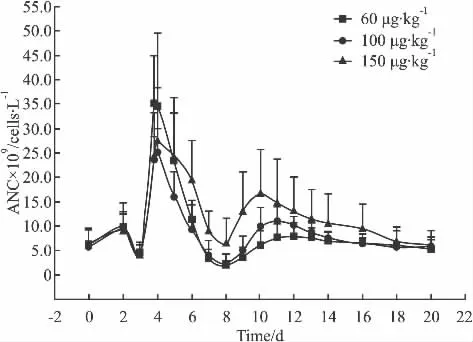
Fig 3 The contrast of ANC among different drug dose groups in the 2nd chemotherapy cycle(±s)
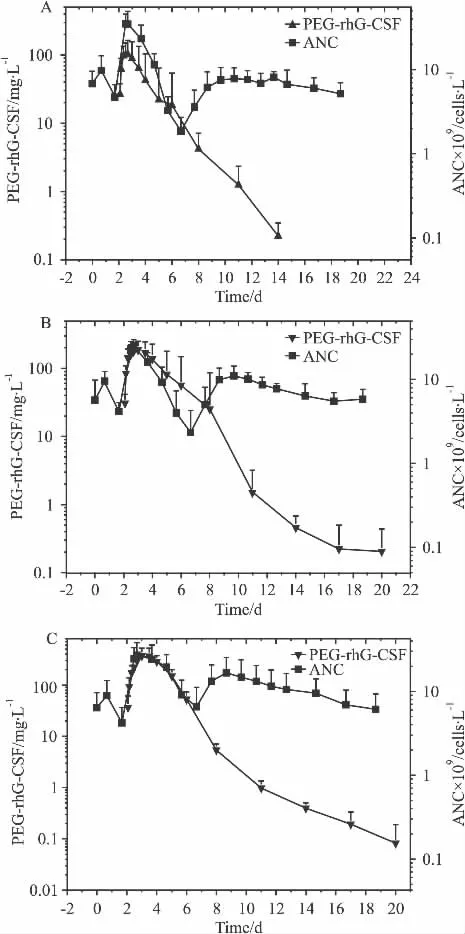
Fig 4 The relationship of ANC and serum drug concentration among different drug dose groups(±s)
2.4.3 外周血CD34+细胞数量的变化 应激、内毒素、剧烈运动、化疗和细胞因子(G-CSF、GM-CSF等)可明显增加外周血中造血干细胞数,目前以细胞因子(G-CSF、GM-CSF)动员居多,同时动态检测动员后外周血中CD34+细胞的含量可确定采集最佳时机。本实验通过观察PEG-rhG-CSF对外周CD34+细胞数量的影响,观察其对造血干细胞的动员作用(Fig 5),在第2周期化疗中,发现3个剂量组的平均CD34+细胞达峰中位时间为d 9(9~10 d),峰值分别为(19.7±14.2)、(30.8±15.0)和(27.6±21.2)×106cells·L-1,3 个剂量组 CD34+细胞均增高,但从变化趋势来看,组间的量效关系并不明显。
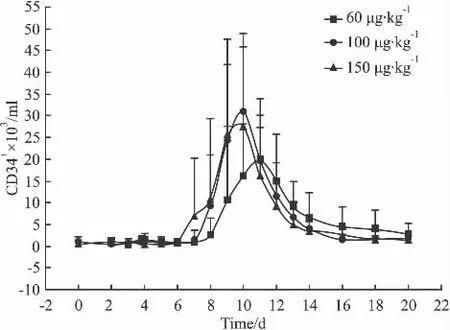
Fig 5 The cell numbers of peripheral blood CD34+cell among different drug dose groups(±s)
2.4.4 两个周期血清生化指标的变化 观察PEG-rhG-CSF的使用是否对生化指标有影响。根据检测结果,进行数据统计学分析,比较不同剂量组在化疗的不同时间,差异均没有统计学意义(P>0.05)。
3 讨论
rhG-CSF目前已广泛应用于临床治疗各种原因引起的中性粒细胞减少症[2-3],同时还用于造血干细胞移植的干细胞动员与移植后造血功能重建等。但rhG-CSF半衰期短,需要频繁给药,易引起不良反应,增加了患者的痛苦。PEG化的rhG-CSF分子量增大,稳定性提高,清除率减慢,半衰期延长,作用更为持久,减少了给药次数,减轻了患者的痛苦。
rhG-CSF在体内可以通过肾脏和中性粒细胞介导的两种途径清除,但PEG-rhG-CSF分子量增大,肾小球滤过减少,中性粒细胞介导清除占主导地位[4-9]。当ANC降低时,中性粒细胞介导清除过程减缓,药物在体内蓄积,PEG-rhG-CSF血药浓度开始上升,使ANC增高;而当ANC增高时,中性粒细胞介导清除过程加快,血药浓度迅速下降,ANC值维持在基线水平之上。这种自我调节大大提高了PEG-rhG-CSF在使用上的安全性。
本研究中PEG-rhG-CSF在低剂量组的平均半衰期为 37.5 h,平均清除率为 17 μl·h-1·g-1,与文献报道的rhG-CSF半衰期3.37~3.5 h,清除率30 ~ 39.6 μl·h-1·g-1[6,8]相比,PEG-rhG-CSF 的半衰期明显延长,清除速率明显减慢。同时发现在第1周期化疗过程中,受试患者均在不同程度上出现了骨髓抑制现象,其中60 μg·kg-1剂量组有3位患者在化疗过程中出现Ⅳ度骨髓抑制,在第2周期给予受试药物后,无1例病人出现骨髓抑制现象,且ANC最低值出现时间前移,ANC最低值提高,1次注射后无重复注射,同时该PEG-rhG-CSF(100 μg·kg-1)单次注射疗效与 filgrastim(5 μg·kg-1·d-1)多次给药的疗效[5]相当。本研究表明PEG-rhG-CSF的使用维持药效时间长、减少患者给药次数、降低化疗后出现Ⅳ度骨髓抑制的发生率。结合血药浓度、ANC变化及临床治疗需要,本研究确定100 μg·kg-1为Ⅱ期临床研究的推荐剂量。
与其他PEG化的制剂相比较,本研究的100 μg·kg-1剂量组消除相半衰期为40.8 h、平均清除率为 9 μl·h-1·g-1,而国外临床研究中 PEG-rhGCSF 100 μg·kg-1剂量组的清除半衰期为 40.7 h,平均清除率为 12.3 μl·h-1·g-1[7],本实验 PEG-rhG-CSF半衰期稍有延长,清除率降低明显。同时还发现,本研究中给予PEG-rhG-CSF后,随着给药剂量的提高,ANC最低值、第2峰的峰值均有增高趋势,各剂量组ANC的变化与PEG-rhG-CSF呈现一定程度的量效关系,但在国外临床研究中[7],ANC的变化与PEG-rhG-CSF并没有量效关系,这可能是由于本研究中患者既往未接受过放、化疗,给予两个周期相同的化疗药物和化疗剂量,而国外临床研究的患者给予的化疗方案和化疗剂量各不相同,导致了治疗反应性的差异,影响了实验的结果。
另外,本研究考察了PEG-rhG-CSF用于肿瘤患者自体外周血干细胞动员的可行性,PEG-rhG-CSF对外周血CD34+细胞动员效果存在明显的个体差异,化疗后动员的 CD34+细胞以 100 μg·kg-1剂量组动员最高,150 μg·kg-1剂量组动员效果与国外研究中 300 μg·kg-1剂量组接近[6],同时 PEG-rhGCSF与外周血干细胞动员不具有量效关系。因此PEG-rhG-CSF是否适用于肿瘤患者外周血干细胞动员及其最适剂量仍有待研究。
本研究还发现,PEG-rhG-CSF的效应与血药浓度存在一定的滞后现象,有研究报道,血液通常不是药物的直接作用部位,而直接靶标是效应部位,通常指受体、酶和细胞膜等特异性超微结构,所以大多数药物效应的变化滞后于血药浓度的变化[11-12],基于这种变化已有研究者将PK/PD结合模型运用于PEG-rhG-CSF[13]和 rh-GSF[14]的研究,将剂量-浓度-效应关系进行估算,该模型能很好的反映药物与受体结合及药物从体内清除的过程,从而能够解释效应与血药浓度滞后的原因,因此PK/PD结合模型在Ⅰ期临床研究中的意义有待研究。在今后国内的临床研究中,我们应积极将PK/PD结合模型运用在药物临床研究方案中,加速药物开发进程。
[1]Kotto-Komea A C,Fox S E,Lu W,et al.Evidence that the granulocyte colony-stimulating factor(G-CSF)receptor plays a role in the pharmacokinetics of G-CSF and pegG-CSF using a G-CSF-R KO model[J].Pharmacol Res,2004,50(1):55-8.
[2]石远凯,孙 燕.造血生长因子在肿瘤化疗中应用的研究进展[J].癌症进展,2003,1(2-3):91-6.
[2]Shi Y K,Sun Y.Application of hematopoietic growth factors in malignancy chemotherapy[J].Oncol Prog,2003,1(2-3):91-6.
[3]李 静,陶维良,魏世东,等.重组人粒细胞集落刺激因子(rhG-CSF)的安全性与临床评价[J].中国医院用药评价与分析,2008,8(7):484-6.
[3]Li J,Tao W L,Wei S D,et al.Safety and clinical evaluation of recombinant human granulocyte colony-stimulating factor[J].Eval Analy Drug-Use Hosp Chin,2008,8(7):484-6.
[4]Tanaka H,Satake-Ishikawa R,Ishikawa M,et al.Pharmacokinetics of recombinant human granulocyte colony-stimulating factor conjugated to polyethylene glycol in rats[J].Cancer Res,1991,51(14):3710-4.
[5]Holmes F A,Jones S E,O’Shaughnessy J,et al.Comparable efficacy and safety profiles of once-per-cycle pegfilgrastim and daily injection filgrastim in chemotherapy-induced neutropenia:a multi-center dose-finding study in women with breast cancer[J].Ann Oncol,2002,13:903-9.
[6]Johnston E,Crawford J,Blackwell S,et al.Randomized,doseescalation study of SD/01 compared with daily filgrastim in patients receiving chemotherapy[J].J Clin Oncol,2000,18(13):2522-8.
[7]Yamamoto N,Sekine I,Nakagawa K,et al.A pharmacokinetic and dose escalation study of pegfilgrastim(KRN125)in lung cancer patients with chemotherapy-induced neutropenia[J].Jpn J Clin Oncol,2009,39(7):425-30.
[8]蔡永明,陈拯民,李 铭,等.酶联免疫法研究注射用聚乙二醇化重组人粒细胞集落刺激因子的临床药动学[J].中草药,2009,40(8):1267-70.
[8]Cai Y M,Chen Z M,Li M,et al.Pharmacokinetics of PEG-rhGCSF of injection to cancer patients by elisa[J].Chin Trad Herb Drugs,2009,40(8):1267-70.
[9]杨 晟,石远凯,刘 鹏,等.注射用聚乙二醇化重组人粒细胞集落刺激因子Ⅰ期临床药效学[J].中国医学科学院学报,2006,28(3):339-44.
[9]Yang S,Shi Y K,Liu P,et al.Efficacy of once-per-cycle administration pegylated recombinant human granulocyte colony-stimulating factor in chemotherapy-induced neutropenia in a PhaseⅠTrial[J].Acta Acd Med Sin,2006,28(3):339-44.
[10]Ho A D,Young D,Maruyama M,et al.Pluripotent and lineagecommitted CD34+subsets in leukapheresis products mobilized by G-CSF,GM-CSF vs.a combination of both[J].Exp Hematol,1996,24(13):1460-8.
[11]杨昭毅,魏 伟.药代动力学药效动力学结合模型研究进展[J].中国药理学通报,2005,21(8):918-22.
[11]Yang Z Y,Wei W.Advance in pharmacokinetics/pharmacodynamics modeling[J].Chin Pharmacol Bull,2005,21(8):918-22.
[12]Derendorf H,Lesko L J,Chaikin P,et al.Pharmacokinetic/pharmacodynamic modeling in drug research and development[J].J Clin Pharmacol,2000,40(12):1399-418.
[13]Roskos L K,Lum P,Lockbaum P,et al.Pharmacokinetic/pharmacodynamic modeling of pegfilgrastim in healthy subjects[J].J Clin Pharmacol,2006,46(7):745-57.
[14]Krzyzanski W,Wiczling P,Lowe P,et al.Population modeling of filgrastim PK-PD in healthy adults following intravenous and subcutaneous administrations[J].J Clin Pharmacol,2010,50(9 Suppl):S101-S12.

