灵芝多糖和当归多糖促进人外周血T淋巴细胞增殖和分泌IFN-γ
耿卫朴,徐 曼,罗 祎,王婷婷,黄文炼,陈 瑜
(重庆医科大学1.病理教研室,分子与肿瘤研究中心,2.附属第一医院妇产科,重庆 400016)
手术、放疗和化疗是目前临床治疗恶性肿瘤的常规治疗方法,但放疗和化疗都有明显的毒副作用。灵芝和当归因无明显毒副作用,有一定的“生血”和增强患者机体抵抗力效果,故常用于肿瘤患者的辅助治疗[1],但其作用机制尚不完全清楚。
灵芝多糖是灵芝(Ganoderma lucidum polysaccharide,GLP)的水提取物中主要的活性成分,体内外实验证明它对抗原递呈细胞、单核巨噬细胞系统以及体液免疫和细胞免疫均有调节作用,尤其通过促进T细胞功能而增强实验小鼠机体的抗肿瘤效应[2-4];文献报道灵芝多糖促进 ConA诱导的小鼠淋巴细胞增殖,还促进淋巴细胞的细胞因子基因转录和蛋白质合成,尤其是Th1类细胞因子IFN-γ和IL-12的表达。此外,灵芝多糖还有助于 γ射线损伤T细胞的修复[5]。当归多糖(Angelica sinensis polysaccharide,ASP)是当归水溶性提取物。文献报道当归提取物能促进PI3K/ALT信号通路,该作用可能参与抑制小鼠外周血细胞的凋亡;此外,它还促进小鼠脾脏T细胞增殖、抑制移植性肿瘤的生长,延长荷瘤小鼠的生存时间[6-7]。因PI3K/Akt信号途径在T细胞增殖中发挥重要作用,而Caspase-3是细胞凋亡信号途径的效应分子,本研究采用免疫荧光染色、流式细胞术、MTT和ELISA方法观察了灵芝多糖和当归多糖对人外周血活化T细胞PI3K和Caspase-3蛋白表达及T细胞增殖、凋亡和分泌细胞因子的作用。
1 材料与方法
1.1 材料
1.1.1 主要试剂 新鲜人外周血取自健康献血者;人淋巴细胞分离液为天津灏洋生物公司产品;尼龙毛为德国KISKER公司产品;RPMI 1640培养基为美国Gibco公司产品;小牛血清和胎牛血清为杭州四季青公司产品;灵芝多糖和当归多糖为陕西慈缘生物技术有限公司产品;PHA和MTT为美国Sigma公司产品;细胞增殖试剂盒为南京凯基生物公司产品;IFN-γ试剂盒为美国RD公司产品;鼠抗人PI3K和Caspase-3抗体为北京中杉金桥生物技术有限公司产品。
1.1.2 主要仪器 超净工作台(苏州净化设备集团公司,苏州),CO2细胞培养箱(SHEL-LAB公司,美国),倒置相差显微镜(OLYMPUS公司,日本),流式细胞仪(Beckman Coulter XL公司,美国)。
1.2 方法
1.2.1 健康人外周血T细胞的分离活化和培养新鲜抗凝外周血梯度离心后吸取单个核细胞,再经尼龙毛柱获得T淋巴细胞。将T淋巴细胞分为对照组、灵芝多糖组和当归多糖组,在含PHA(10 mg·L-1)的RPMI 1640(含10%胎牛血清)培养液中,37℃、5%CO2孵箱内培养,各组分别加入PBS、灵芝多糖(100 mg·L-1)和当归多糖(100 mg·L-1)培养1、2、24、72 h后进行后续实验。每组实验分别重复3次。
1.2.2 免疫荧光观察各组T细胞PI3K和Caspase-3蛋白表达 T淋巴细胞培养1、2和24 h后细胞涂片及10%甲醛固定后,分别加入鼠抗人PI3K抗体(1∶50)和Caspase-3抗体(1∶50)4℃冰箱孵育过夜,FITC标记抗鼠抗体(1∶50)37℃避光孵育1 h后,PBS清洗并用甘油封片,荧光显微镜观察。
1.2.3 MTT检测T细胞增殖 将对照组、灵芝多糖组和当归多糖组T细胞分别培养72 h并接种于96 孔板(每孔100 μl,细胞数1×108·L-1),每组设3个复孔。每孔加入MTT溶液10 μl(5 g·L-1)培养4 h后,离心后吸去上清并加入二甲基亚砜(60 μl/孔),低速震荡10 min,酶标仪490 nm测量各孔吸光度值(OD值)。
1.2.4 流式细胞术检测T细胞的细胞周期和凋亡率 收集上述各组培养72 h的T淋巴细胞,经体积分数为0.70的乙醇固定24 h后,流式细胞术检测T细胞的细胞周期和凋亡率。
1.2.5 ELISA检测T细胞培养上清液中IFN-γ含量 分别收集对照组、灵芝多糖组和当归多糖组T细胞培养72 h的上清液,按ELISA试剂盒说明书操作检测各组T淋巴细胞的IFN-γ含量。
1.2.6 图像分析和统计学方法 采用图像分析系统(Imagepro-Plus)对免疫荧光染色阳性强度进行分析。随机选5个高倍视野测量PI3K和Caspase-3的平均光密度,计算出平均值。采用SPSS 17.0软件计算各组数据的均数与标准差,实验结果以±s表示,t检验比较实验组与对照组间的差异。
2 结果
2.1 灵芝多糖和当归多糖对T细胞PI3K表达和T细胞增殖的影响 免疫荧光染色结果显示空白对照组、灵芝多糖组及当归多糖组T细胞培养1、2及24 h后细胞内均表达PI3K蛋白,但各组间平均光密度值无明显差别。MTT实验结果显示空白对照组、灵芝多糖组及当归多糖组T细胞增殖的OD值如表1,灵芝多糖组、当归多糖组与空白对照组间差异均有显著性(P<0.01,P<0.05)。
2.2 灵芝多糖和当归多糖对T细胞生长周期的影响 正常人外周血T细胞与灵芝多糖和当归多糖混合培养72 h后,各组细胞的G1、G2/M期及S期分布无差别。
2.3 灵芝多糖和当归多糖对Caspase-3蛋白表达及凋亡的影响 免疫荧光染色结果显示空白对照组和当归多糖组培养24 h后T细胞Caspase-3蛋白表达的平均光密度值分别为0.51±0.24和0.46±0.22,两组间差别无显著性;而灵芝多糖组T细胞Caspase-3蛋白表达的平均光密度值为0.38±0.16,明显低于空白对照组(P<0.05)(Fig 1)。流式细胞术检测结果显示空白对照组和当归多糖组T细胞凋亡率分别为29.74%和29.87%,两组间差别无显著性;而灵芝多糖组T细胞凋亡率为18.23%,明显低于前两组。
Tab 1 Proliferation of T lymphocytes which were cultured 72 h(±s)

Tab 1 Proliferation of T lymphocytes which were cultured 72 h(±s)
t=16.955,**P=0.003<0.01 vs blank control;t=6.634,*P=0.022<0.05 vs blank control
Group Blank control GLP ASP OD value 0.36±0.04 0.55±0.02** 0.52±0.02*
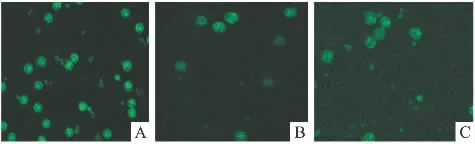
Fig 1 The expression of Caspase-3 of T lymphocytes
2.4 灵芝多糖和当归多糖对T细胞分泌IFN-γ的影响 ELISA检测结果显示T细胞培养72 h后,空白对照组上清液中IFN-γ含量为(1850.09±93.34)ng·L-1,灵芝多糖组和当归多糖组上清液中IFN-γ含量分别为(2071.41±166.40)ng·L-1和(2030.33±28.76)ng·L-1,均明显高于空白对照组(P<0.05,P<0.05)(Fig 2)。
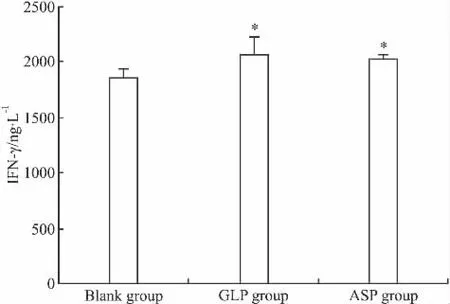
Fig 2 IFN-γ concentration in supernatant of T lymphocytes
3 讨论
本实验观察到灵芝多糖和当归多糖均促进人外周血T细胞PI3K的表达,使T细胞增殖水平明显提高。PI3K在T细胞生存和增殖中的重要作用已得到研究者的证实,如 Hand等[8]发现无论记忆CD8+T还是效应CD8+T细胞都依赖于PI3K而生存,Soond等[9]发现PI3K不仅参与初始T细胞的分化,还与其分泌IFN-γ有密切关系。但本实验观察到空白对照组的T细胞也表达蛋白激酶PI3K,这可能与该组T细胞培养液内加入了具有刺激细胞增殖作用的PHA有关。Li等[10]还报道灵芝多糖可通过激活PKC和PKA激酶诱导小鼠脾脏CD4+T和CD8+T细胞增殖并促进细胞免疫,提示PI3K可能只是灵芝多糖刺激T细胞增殖的信号途径之一。Liu等[11]报道当归多糖也通过PI3K途径促进小鼠造血干细胞增殖。当归多糖还能促进小鼠脾细胞增殖,并刺激免疫功能低下小鼠的CD4+T细胞增生。我们对照观察灵芝多糖、当归多糖与对照组T细胞的细胞周期情况,结果3组间并无明显差别,这可能与空白对照组培养液内的PHA作为有丝分裂原也促进T细胞的细胞周期运行,但灵芝多糖和当归多糖促进了更多的T细胞进入细胞周期有关。
本实验还观察到灵芝多糖和当归多糖均能降低人外周血活化T细胞Caspase-3的表达,尤其是灵芝多糖下调Caspase-3表达和抑制T细胞凋亡的作用明显。文献报道肿瘤患者外周血T细胞Caspase-3高表达与 T细胞凋亡有密切关系[12]。Liu等[11]报道当归多糖具有抑制小鼠造血干细胞凋亡的作用,但本实验未发现其有抑制人外周血T细胞凋亡的作用,推测当归多糖抗凋亡的作用可能在人和鼠之间存在差异。
本实验还观察到灵芝多糖和当归多糖均明显促进人外周血T细胞分泌IFN-γ。Gao等[13]证实灵芝多糖喂饲荷瘤小鼠明显抑制了肿瘤的生长,体外实验证实灵芝多糖不仅刺激了小鼠脾细胞的增殖,还促进了IFN-γ的分泌,T细胞的细胞毒作用也明显增强。灵芝多糖促进小鼠脾细胞增殖及分泌IFN-γ与细胞内GTP酶、磷脂酰肌醇转移蛋白等的活化,抑制凋亡相关蛋白如 CARD、β-actin,tubulin-α2,copine I和 γ-actin等活化有关[14]。我们推测本实验中灵芝多糖和当归多糖促进外周血T细胞分泌IFN-γ的作用可能与它们通过PI3K途径促进T细胞增殖,下调细胞凋亡相关蛋白Caspase-3从而抑制T细胞凋亡的作用密切相关。
本研究结果表明当归多糖和灵芝多糖具有促进人T细胞增殖和分泌IFN-γ的功能,灵芝多糖还具有抑制T细胞凋亡的作用。因此,灵芝多糖和当归多糖具有确切的促进人外周血T细胞免疫的作用。
[1]杨铁虹,卢保华,贾 敏,等.当归多糖对小鼠免疫功能的影响[J].中国药理学通报,2003,19(4):448-51.
[1]Yang T H,Lu B H,Jia M,et al.Immunoloregulation effect of Angelica polysaccharide isolated from Angelica sinensis[J].Chin Pharmacol Bull,2003,19(4):448-51.
[2]Ramberg J E,Nelson E D,Sinnott R A.Immunomodulatory dietary polysaccharides:a systematic review of the literature[J].Nutr J,2010,9:54.
[3]张 群,雷林生,朱正光,等.灵芝多糖拮抗前列腺素E2对小鼠脾细胞IFN-γ和TNF-α mRNA表达的抑制作用[J].南方医科大学学报,2006,26(6):780-3.
[3]Zhang Q,Lei L S,Zhu Z G,et al.Ganoderma polysaccharides antagonize prostaglandin E2-induced suppression of murine splenocyte IFN-γ and TNF-α mRNA expression[J].J South Med Univ,2006,26(6):780-3.
[4]李颖博,李宇华,王 瑞,等.灵芝多糖对肿瘤细胞与内皮细胞相互作用的影响[J].中国药理学通报,2008,24(2):250-3.
[4]Li Y B,Li Y H,Wang R,et al.Effect of Ganoderma lucidum polysaccharides(GIPS)on tumor-endothelium interactions[J].Chin Pharmacol Bull,2008,24(2):250-3.
[5]Lin Z B.Cellular and molecular mechanisms of immuno-modulation by Ganoderma lucidum[J].J Pharmacol Sci,2005,99(2):144-53.
[6]Cao W,Li X Q,Liu L,et al.Structure of an anti-tumor polysaccharide from Angelica Sinensis(Oliv)Diels[J].Carbohydrate Polymers,2006,66(2):149-59.
[7]Tsai N M,Lin S Z,Lee C C,et al.The antitumor effects of Angelica sinensis on malignant brain tumorsin vitroandin vivo[J].Clin Cancer Res,2005,11(9):3475-84.
[8]Hand T W,Cui W,Jung Y W,et al.Differential effects of STAT5 and PI3K/AKT signaling on effector and memory CD8 T-cell survival[J].Proc Natl Acad Sci USA,2010,107(38):16601-6.
[9]Soond D R,Bjørgo E,Moltu K,et al.PI3K p110delta regulates T-cell cytokine production during primary and secondary immune responses in mice and humans[J].Blood,2010,115(11):2203-13.
[10]李明春,雷林生,王庆彪,等.灵芝多糖对小鼠T细胞蛋白激酶A和蛋白激酶C活性的影响[J].中国药房,2001,12(2):78-9.
[10]Li M C,Lei L S,Wang Q B,et al.Effects of Ganoderma polysaccharides on PKC and PKA activities in murine T cells[J].China Pharm,2001,12(2):78-9.
[11]Liu C,Li J,Meng F Y,et al.Polysaccharides from the root of Angelica sinensis promotes hematopoiesis and thrombopoiesis through the PI3K/AKT pathway[J].BMC Complement Altern Med,2010,10:79.
[12]Takahashi A,Kono K,Amemiya H,et al.Elevated caspase-3 activity in peripheral blood T cells coexists with increased degree of T-cell apoptosis and down-regulation of TCR zeta molecules in patients with gastric cancer[J].Clin Cancer Res,2001,7(1):74-80.
[13]Gao Y,Gao H,Chan E,et al.Antitumor activity and underlying mechanisms of ganopoly,the refined polysaccharides extracted from Ganoderma lucidum,in mice[J].Immunol Invest,2005,34(2):171-98.
[14]Ma C,Guan S H,Yang M,et al.Differential protein expression in mouse splenic mononuclear cells treated with polysaccharides from spores of Ganoderma lucidum[J].Phytomedicine,2008,15(4):268-76.

