在Hs578T乳腺癌细胞由Cx43组成的细胞缝隙连接对阿霉素细胞毒性的影响
蒋国君,童旭辉,祝晓光,董淑英,韩 溪,郑 超
(蚌埠医学院药学系药理学教研室,安徽蚌埠 233030)
乳腺癌是严重威胁女性健康的恶性肿瘤之一,化疗是常见的治疗手段。阿霉素(adriamycin,ADM)易产生心脏毒性、骨髓抑制、消化道反应等严重的不良反应,因此寻找增加乳腺癌细胞对ADM敏感性同时降低机体不良反应的方法,对减少耐药、增加ADM的疗效和扩大其临床应用范围具有重要的指导意义。
细胞缝隙连接(gap junction,GJ)是细胞间进行物质交流的主要连接通道,由特殊的通道蛋白——连接蛋白(connexin,Cx)组成。连接蛋白通道介导的细胞间信号转导对于细胞正常生理状态的维持以及机体内环境的稳定非常重要[1]。
目前已经证实,在人正常的乳腺组织中,Cx43是乳腺上皮细胞表达的特异性连接蛋白之一[2],具有抑制肿瘤生长的作用,并且有研究证明,Cx43的存在可以增强化疗药物诱导的细胞凋亡作用[3]。在乳腺癌细胞中Cx43基因表达常常异常或者缺失[4]。因此,国内外许多学者也将提高肿瘤间GJIC功能作为了肿瘤治疗研究的新方向[5-6]。
本实验主要研究维甲酸(ratinoic acid,RA)、油酸酰胺(oleamide)和 18-α-甘草次酸(18-α-GA)对乳腺癌Hs578T细胞中Cx43表达的影响,进而观察由Cx43形成的GJ对抗肿瘤药物ADM细胞毒性的影响。
1 材料与方法
1.1材料
1.1.1 细胞 细胞系Hs578T购于中科院上海细胞库。
1.1.2 试剂 阿霉素、胰蛋白酶(Typsin)、MTT、二甲基亚砜(DMSO)均为美国Sigma公司产品;DMEM高糖培养基、新生牛血清、荧光染料CM-Dil、calcein-AM(Molecular Probes)均为美国Gibco公司产品。其他常用试剂均为国产分析纯级。
1.2 方法
1.2.1 细胞培养 乳腺癌细胞 Hs578T采用DMEM高糖培养基,含有10%(V/V)新生牛血清,100 kU·L-1青霉素,100 mg·L-1链霉素,置于37℃、含体积分数5%CO2以及饱和湿度的细胞培养箱中培养。细胞常规培养于培养瓶中,0.25%胰蛋白酶溶液消化传代,一周传代2~3次,传代比例约为1∶3。
1.2.2 Western blot检测 Hs578T细胞内 Cx43蛋白表达 收集稳定表达Cx43的乳腺癌细胞Hs578T,用细胞裂解液(总体积200 ml:100 mmol·L-1Tris-HCl pH 7.4 20 ml、1 mol·L-1NaCl 28 ml、100 mmol·L-1CaCl21 ml、100 mmol·L-1MgCl221 ml、15 mmol·L-1NaN340 ml、Triton X-100 2 ml,用前加入蛋白酶抑制剂 12 μmol·L-1Leupeptin、1 mmol·L-1PMSF 各2 ml·L-1)冰上裂解30 min,提取细胞总蛋白,BCA蛋白定量法(参照试剂盒说明书操作)测各组蛋白浓度,用细胞裂解液将各组蛋白稀释至相同浓度,与2×上样缓冲液1∶1混合,100℃煮沸5 min使蛋白变性。取蛋白 200 μg/组,12%SDSPAGE 凝胶电泳(70 V,30 min;150 V,90 min);转膜(50 V,180 min);5%脱脂牛奶室温封闭过夜;一抗:1∶4 000稀释,4℃孵育过夜;TPBS洗涤3次×15 min;二抗1∶4 000稀释,室温孵育2 h;TPBS洗涤3次×15 min,PBS洗涤1次×15 min;ECL发光试剂盒暗室发光、显影、定影。Bio-Rad凝胶成像系统采集图像。
1.2.3 细胞免疫荧光法 检测细胞膜Cx43蛋白表达 将细胞以5×104cells·L-1的密度接种于盖玻片上,放置培养箱中培养2~3 d,待细胞生长稳定后,吸去培养基,PBS洗2次×5 min;4%多聚甲醛-0.1%Triton溶液室温固定10 min,PBS洗2次×10 min;1%BSA封片2 h;一抗:1∶1 000稀释,4℃孵育过夜,PBS洗涤3次×10 min;二抗1∶500稀释,湿盒37℃孵育2 h,PBS洗涤3次×10 min;碳酸甘油缓冲液封片;倒置荧光显微镜检测。
1.2.4 细胞接种荧光示踪法(Parachute Assay)测定Hs578T细胞间GJ功能 将表达有Cx43的乳腺癌细胞与荧光指示剂calcine-AM共同孵育,使calcine-AM进入细胞。该细胞称为“供体细胞”(donor cell)。将“供体细胞”接种到表达有相同Cx,已生长融合的 Hs578T细胞(“接受细胞”,receiver cells)上,培养4 h。待形成稳定的GJ后,小分子的calcine(发绿色荧光)可以通过GJ进入相邻的“接受细胞”,用荧光显微镜观察,记录GJ荧光传递功能。一个“供体细胞”周围含有calcine的“接受细胞”数目多少作为GJ功能指标[7]。分别用GJ功能增强剂维甲酸钠(RA)诱导细胞24 h,GJ功能抑制剂oleamide、18-α-GA分别诱导细胞 1h后,观察细胞GJ功能改变(即荧光传递的变化)[8]。
1.2.5 MTT法检测GJ功能对ADM细胞毒性的影响 将细胞按每孔190 μl(细胞密度为5×107cells·L-1)接种于96孔板,每组药物浓度设5个复孔,药物终浓度如下:1.5、3.0、6.0、12、24、48 μmol·L-1。检测每组药物浓度处理Hs578T细胞后24、48和72 h的细胞存活率,另设阴性对照组(不加药物)和空白对照组(不加细胞,只加培养基)。加药后24~72 h(药物作用终点时间)终止培养,终止培养前4 h,每孔加 MTT 15 μl(5 g·L-1),弃上清液,加入二甲基亚砜150 μl/孔,微量振荡器震摇10 min,全自动定量绘图酶标仪测定每孔的570 nm波长处吸光度A值,实验重复3次。在细胞融合状态下用GJ功能调节剂改变细胞GJ功能,观察药物处理细胞24 h后的细胞存活率。各试验重复3次。
1.3 统计学分析 实验结果使用SPSS 13.0软件进行分析。数据资料以±s表示,两组之间计量资料比较进行t检验,统计图表采用Sigma Plot绘制。
2 结果
2.1 Hs578T细胞天然表达Cx43蛋白 本研究采用Western blot检测细胞Cx43蛋白[9],如Fig 1结果显示,与空白对照组相比,10μmol·L-1RA预处理Hs578T细胞24 h,可以增加细胞Cx43表达水平。25 μmol·L-1的 oleamide 和 10 μmol·L-1的 18-α-GA分别预处理Hs578T细胞24 h,明显降低细胞Cx43表达水平。
2.2 Hs578T细胞胞膜Cx43的表达 本研究在天然表达Cx43的Hs578T细胞,用“细胞免疫荧光法”(Immunofluorescence Assay)检测Hs578T细胞膜上Cx43的表达(Fig 2)。
2.3 抗肿瘤药物在一定浓度范围内对Hs578T细胞的增殖抑制作用 不同浓度ADM刺激Hs578T细胞24、48和72 h,使用MTT法检测细胞的存活率。由 Fig 3 可以看出:1.5 μmol·L-1~48 μmol·L-1的ADM作用组的细胞存活率明显降低,其差异有统计学意义。随着ADM浓度增加和作用时间的延长,细胞存活率也明显降低,即呈时间、剂量依赖性。48.0 μmol·L-1ADM 处理 Hs578T 细胞 24、48和72 h后,细胞存活率分别为55.23%、25.89%和18.18%。
2.4 用药物改变GJ功能对ADM细胞毒性的影响
2.4.1 GJ功能增强剂对ADM细胞毒性的影响
2.4.1.1 RA 对由 Cx43组成的 GJ荧光传递功能的影响 本实验用 parachute方法,在天然表达Cx43 的 Hs578T 细胞中,观察 RA(10 μmol·L-1)对由Cx43组成的GJ荧光传递功能的影响(Fig 4,5)。
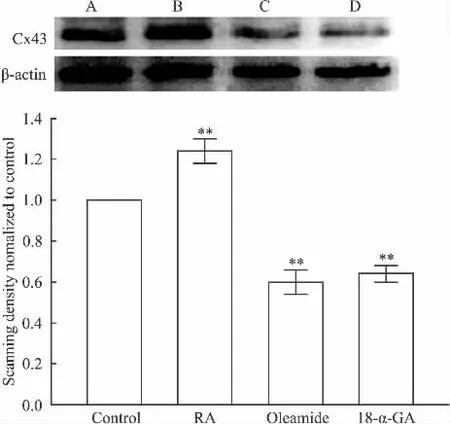
Fig 1 Effect of RA,oleamide or 18-α-GA on the expression of Cx43 in Hs578T(±s,n=3)
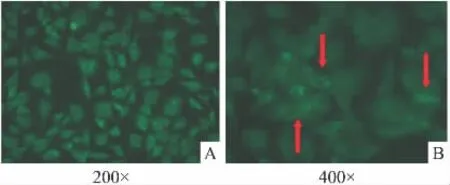
Fig 2 Expression of Cx43 on the surface of Hs578T cells(n=3)
Fig 5的结果显示,用RA预处理Hs578T细胞24 h,可以明显增强由Cx43组成的GJ荧光传递功能。与对照组相比,RA处理后的细胞荧光传递率增强了39.52%。
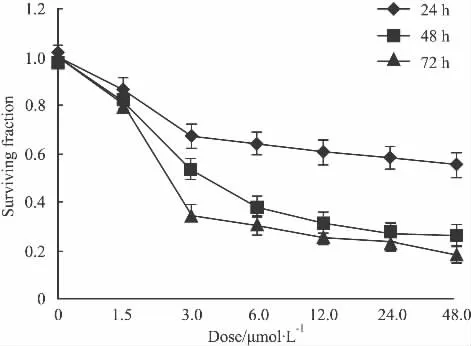
Fig 3 Surviving fraction of Hs578T cells treated with ADM for 24,48 and 72 h(n=3)
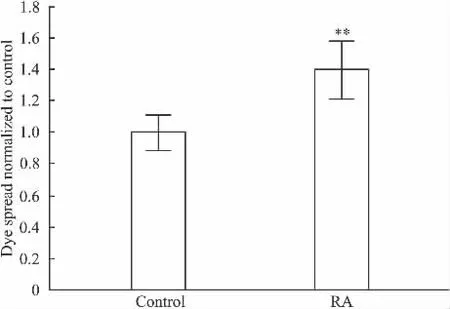
Fig 5 Effect of RA on the dye spread through GJ composed of Cx43 in Hs578T cells(±s,n=3)
2.4.1.2 RA对ADM细胞毒性的影响 本实验在Hs578T细胞生长融合(有GJ形成)和生长未融合(无 GJ形成)的状态下,预先用 10 μmol·L-1的 RA处理细胞24 h增强GJ功能,然后再加入6 μmol·L-1的ADM,作用24 h后,用MTT法检测细胞存活率(Fig 6)。
Fig 6的结果显示,在高密度接种的细胞(生长融合,有GJ形成),ADM单用组的细胞存活率为0.54±0.04,低密度接种的细胞(生长未融合,无GJ形成),ADM单用组的细胞存活率0.59±0.03。高密度接种的细胞,用RA(本身对细胞生长无影响)预处理细胞以增强 GJ功能后,6 μmol·L-1的 ADM作用Hs578T细胞24 h,细胞的存活率低于单用ADM 的细胞(0.49±0.04,P<0.01);结果表明,RA可以增强ADM的细胞毒性。而在低密度接种的细胞(生长未融合,无 GJ形成),用 RA预处理后,ADM作用于细胞24 h,细胞的存活率与单用ADM组相比增加(0.65±0.04,P<0.01)。
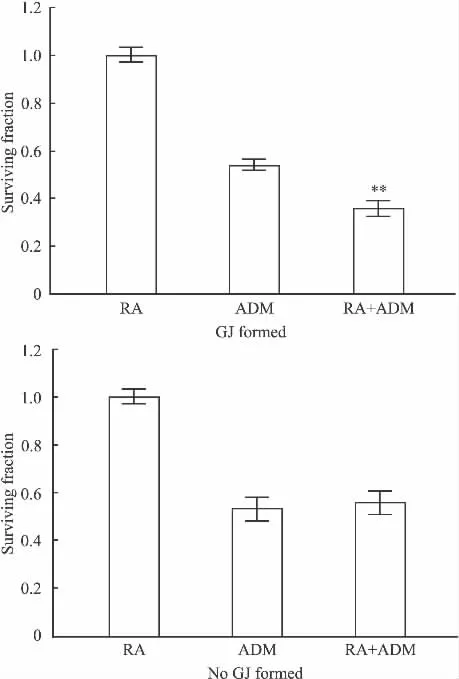
Fig 6 Effect of RA on cytotoxicity of ADM in Hs578T cells expressing Cx43(±s,n=3)
以上结果可以证明,在有GJ形成的细胞,RA可以增强抗肿瘤药物ADM的细胞毒性,而在无GJ形成的细胞,RA不能对细胞间GJ进行调控。
2.4.2 GJ功能抑制剂对ADM细胞毒性的影响在天然表达Cx43的Hs578T细胞中,为了进一步证实细胞GJ对抗肿瘤药物ADM细胞毒性的影响,本实验采用公认的GJ功能抑制剂oleamide和18-α-GA,在细胞融合(有GJ形成)和细胞未融合(无GJ形成)两种情况下观察它们对ADM的细胞毒性的影响。
2.4.2.1 oleamide 和18-α-GA 对由 Cx43 组成的GJ荧光传递功能的影响 Oleamide和18-α-GA是目前公认的 GJ抑制剂[10-11],能抑制由 Cx43,Cx37 等连接蛋白组成的GJ,因此,我们首先用parachute的方法学观察这两种抑制剂在天然表达Cx43的Hs578T细胞中对由Cx43组成的GJ荧光传递功能的影响(Fig 7,8)。

Fig 7 Effect of oleamide or 18-α-GA on dye spread in Hs578T cells expressing Cx43(n=3)
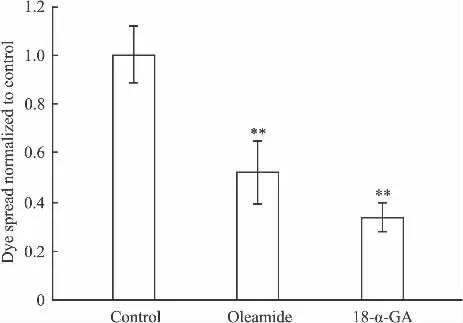
Fig 8 Effect of oleamide or 18-α-GA on the dye spread through GJ composed of Cx43 in Hs578T cells(±s,n=3)
Fig 8的结果显示,用oleamide和18-α-GA预处理Hs578T细胞1 h,均可以抑制由Cx43组成的GJ荧光传递。与对照组相比,oleamide(25 μmol·L-1)或 18-α-GA(10 μmol·L-1)处理的 Hs578T 细胞,其荧光传递率分别降低了47.94%和66.19%。结果证明,oleamide和18-α-GA可以降低由Cx43组成的GJ功能。
2.4.2.2 oleamide 和 18-α-GA 对 ADM 细胞毒性的影响 本实验在Hs578T细胞生长融合(有GJ形成)和生长未融合(无GJ形成)的状态下,预先用25 μmol·L-1的 oleamide 和 10 μmol·L-1的 18-α-GA分别处理细胞 1 h,然后再加入 6 μmol·L-1的ADM,作用24 h后,用MTT法检测细胞存活率(Fig 9)。
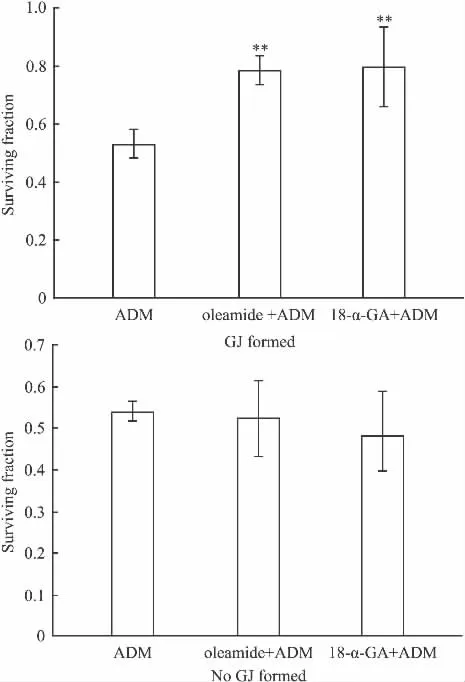
Fig 9 Effect of oleamide or 18-α-GA on the cytotoxicity of ADM in Hs578T cells expressing Cx43(±s,n=3)
Fig 9结果显示:在高密度接种的细胞(生长融合,有GJ形成),ADM单用组的细胞存活率为0.54±0.04,低密度接种的细胞(生长未融合,无GJ形成),ADM单用组的细胞存活率为0.59±0.03。高密度接种的细胞,与单用ADM组相比,用oleamide(25 μmol·L-1)或 18-α-GA(10 μmol·L-1)(两药本身对细胞生长无影响)预处理细胞1 h后,6 μmol·L-1的ADM作用Hs578T细胞24 h,细胞的存活率明显增加(P<0.01);结果表明,在有GJ形成的细胞,oleamide和18-α-GA能降低ADM的细胞毒性。而在低密度接种的细胞(生长未融合,无GJ形成),与 ADM 单用组相比,用 oleamide或18-α-GA,不影响ADM处理后的细胞存活率(P>0.05)。
以上结果可以证明,在有 GJ形成的细胞,oleamide和18-α-GA可以抑制抗肿瘤药物ADM的细胞毒性,而在无GJ形成的细胞,oleamide和18-α-GA不能对细胞间GJ进行调控,因此对ADM的细胞毒性无影响。
3 讨论
Cx已经成为乳腺癌治疗的热点,该蛋白在不同组织中表达不同,其中Cx43是乳腺上皮细胞主要表达的连接蛋白,Cx43异常与乳腺癌之间的关系越来越受到关注。
肿瘤化疗药物的作用在某些情况下与细胞GJ功能密切相关[12-13],文献报道,恢复和上调肿瘤细胞的GJIC功能,可降低抗肿瘤药物的浓度并降低其不良反应。其调节途径主要有两种:第一种是通过药物诱导方法来恢复和上调肿瘤细胞GJIC功能。药物诱导主要是通过药物来诱导肿瘤细胞中Cx表达,促进细胞GJ的形成,从而加强细胞间的物质交流,如维生素 D、类维生素 A、某些黄酮类的药物[3,14-16]等均可以通过增强细胞的 GJ功能抑制肿瘤细胞的生长、分化和增殖。第二种途径是通过基因转染的方法来恢复和上调肿瘤细胞的GJIC功能。
本实验所选用的Hs578T细胞株天然表达Cx43,目前常用的GJ功能增强剂为RA,该药物可以通过增加Cx43mRNA转录、Cx43蛋白的表达而增强GJ功能[17]。本实验观察了RA对乳腺癌细胞Hs578T中Cx43蛋白水平的影响,及对GJ功能的影响。结果显示,RA可以明显增强 Cx43蛋白的表达,及乳腺癌细胞中由此连接蛋白形成的GJ功能。本研究进一步在高密度(有GJ形成)和低密度(无GJ形成)两种条件下观察对ADM细胞毒性的影响,结果显示,在GJ形成的Hs578T细胞中,RA可以明显增强ADM的细胞毒性,表明RA增强ADM的细胞毒性是通过GJ实现的。
oleamide和18-α-GA是本实验采用的两种GJ功能抑制剂。oleamide的作用途径尚不明确,通常认为该药是通过选择性地抑制钙离子通过GJ的能力,从而抑制细胞的群体死亡[18],油酸酰胺衍生物MI-18和MI-22,通过抑制由Cx26介导的GJIC,阻止细胞自发转移,并且药物的毒副作用较低[19],但是对于oleamide对Cx43蛋白表达影响的研究较少。本研究证明,oleamide和18-α-GA均可不同程度地抑制乳腺癌细胞Hs578T中Cx43蛋白的表达,以及由Cx43形成的GJ的荧光传递,细胞毒性结果显示,oleamide和 18-α-GA通过抑制 GJ功能,可降低ADM对Hs578T的细胞毒性。
本研究通过改变GJ的功能下测定ADM细胞毒性的方法证实了,由Cx蛋白形成的GJ功能对ADM抗肿瘤作用的影响,结果表明,改变和调节乳腺癌细胞中Cx蛋白的表达可能会为乳腺癌治疗提供一个新的思路。
[1]Li M W,Mruk D D,Lee W M,et al.Connexin 43 is critical to maintain the homeostasis of the blood-testis barrier via its effects on tight junction reassembly[J].Proc Natl Acad Sci USA,2010,107(42):17998-8003.
[2]McLachlan E,Shao Q,Laird D W.Connexins and gap junctions in mammary gland development and breast cancer progression[J].J Membr Biol,2007,218(1-3):107-21.
[3]Huang R P,Hossain M Z,Huang R,et al.Connexin 43(cx43)enhances chemotherapy-induced apoptosis in human glioblastoma cells[J].Int J Cance,2001,92(1):130-8.
[4]Conklin C M,Bechberger J F,MacFabe D,et al.Genistein and quercetin increase connexin 43 and suppress growth of breast cancer cells[J].Carcinogenesis,2007,28(1):93-100.
[5]杨 燕,陶 亮.细胞缝隙连接与HSV-TK/GCV系统旁观者效应的关系[J].中国药理学通报,2009,25(1):9-12.
[5]Yang Y,Tao L.The relationship of gap junction with the bystander effect in the HSV-TK/GCV treatment[J].Chin Pharmacol Bull,2009,25(1):9-12.
[6]Oktem G,Bilir A,Ayla S,et al.Role of intercellular communications in breast cancer multicellular tumor spheroids after chemotherapy[J].Oncol Res,2007,16(5):225-33.
[7]郑素平,洪晓婷,王 琴,等.以siRNA表达载体稳定抑制缝隙连接蛋白43表达的睾丸间质细胞和睾丸支持细胞系的建立[J].中国药理学通报,2010,26(10):1285-9.
[7]Zheng S P,Hong X T,Wang Q.Establishment of Cx43-stablydownregulated leydig cell line and sertoli cell line by siRNA expression vector[J].Chin Pharmacol Bull,2010,26(10):1285-9.
[8]贤明华,杨 燕,李 荔,等.一种快速可靠筛选作用于细胞缝隙连接药物的方法建立[J].中国药理学通报,2011,27(5):733-6.
[8]Xian M H,Yang Y,Li L,et al.The establishment of a high-efficient and reliable drug screening method for gap junction[J].Chin Pharmacol Bull,2011,27(5):733-6.
[9]Hatakeyama S,Mikami T,Habano W,et al.Expression of connexins and the effect of retinoic acid in oral keratinocytes[J].J Oral Sci,53(3):327-32.
[10]Stains J P,Civitelli R.Gap junctions regulate extracellular signalregulated kinase signaling to affect gene transcription[J].Mol Biol Cell,2005,16(1):64-72.
[11]Yamamoto Y,Yoshizaki G,Takeuchi T,et al.Role of gap junctions and protein kinase A during the development of oocyte maturational competence in Ayu(Plecoglossus altivelis)[J].Gen Comp Endocrinol,2008,155(3):789-95.
[12]He B,Tong X,Wang L,et al.Tramadol and flurbiprofen depress the cytotoxicity of cisplatin via their effects on gap junctions[J].Clin Cancer Res,2009,15(18):5803-10.
[13]Tanaka M,Grossman H B.Connexin 26 induces growth suppression,apoptosis and increased efficacy of doxorubicin in prostate cancer cells[J].Oncol Rep,2004,11(2):537-41.
[14]Kaneda M,Zhang D,Bhattacharjee R,et al.Vitamin K2suppresses malignancy of HuH7 hepatoma cells via inhibition of connexin 43[J].Cancer Lett,2008,263(1):53-60.
[15]Gonzalez-Reyes S,Fernandez-Dumont V,Calonge W M,et al.Expression of connexin 43 in the hearts of rat embryos exposed to nitrofen and effects of vitamin A on it[J].Pediatr Surg Int,2006,22(1):61-5.
[16]Naves M M,Silveira E R,Dagli M L,et al.Effects of beta-carotene and vitamin A on oval cell proliferation and connexin 43 expression during hepatic differentiation in the rat(1)[J].J Nutr Biochem,2001,12(12):685-92.
[17]Tanmahasamut P,Sidell N.Up-regulation of gap junctional intercellular communication and connexin 43 expression by retinoic acid in human endometrial stromal cells[J].J Clin Endocrinol Metab,2005,90(7):4151-6.
[18]Krutovskikh V A,Piccoli C,Yamasaki H.Gap junction intercellular communication propagates cell death in cancerous cells[J].Oncogene,2002,21(13):1989-99.
[19]Nojima H,Ohba Y,Kita Y.Oleamide derivatives are prototypical anti-metastasis drugs that act by inhibiting connexin 26[J].Curr Drug Saf,2007,2(3):204-11.

