胆碱能M受体信号通路在芍药苷抗脑缺血神经保护中的作用
王国峰,尹鲁平,赵 霞,陈冬梅
(1.济南军区总医院干部病房三科,山东 济南 250031;2.中国科学院生物物理所脑与认知科学中心,北京 100101)
脑卒中(stroke)是以局灶性神经功能缺失为共同特征,或伴发意识障碍的急性脑血管疾病。缺血性脑卒中(ischemic stroke)是最常见脑卒中类型,有关脑缺血病理机制的学说众多,如兴奋性氨基酸释放增多、细胞内钙超载、代谢性酸中毒等,但据此采取的治疗措施均不能获得理想疗效,尚缺乏有效的治疗药物。
芍药苷(paeoniflorn,PAE)是传统中药处方芍药根的主要成分,具有抗氧化、增强认知功能及内皮依赖性舒张血管等药理活性[1-3]。既往研究表明,PAE可通过激活腺苷Al受体,并抑制与之偶联的MAPK通路,阻断花生四烯酸通路炎症蛋白COX-2和5-LOX在脑缺血中过度表达,模拟缺血预适应(ischemic preconditioning,IPC)诱导药理预适应发挥延迟神经保护作用[4]。
本文在上述基础上进一步研究PAE对脑缺血的治疗作用及其对M受体信号通路的调节机制,旨在为脑卒中的治疗提供新靶点、新策略。
1 材料与方法
1.1 实验动物 健康♂大鼠(Sprague-Dawley,鼠龄60~90 d,体质量220~250 g)由中国科学院上海实验动物中心提供[SPF级,合格证书号:SCXK(沪)2002-0010]。
1.2 药品与试剂 PAE(纯度98.5%):购于中国药品与生物制品检定所。2,3,7-三苯基氯化四氮唑(TTC)购自 Sigma(Aldrich,St Louis,USA);TRI-REAGENT-LS试剂盒购自 Molecular Research Center,Inc.(Cincinnati,USA);RNasin、dNTP、Oligo(dT)18引物和 DNA polymerase购自 Sangon Biotechnology Co.(Shanghai,China);M-MuLV 逆转录酶购自 Fermentas,Inc.(Vilnius,Lithuania);DNA 荧光染 料SYBR Green I购自 Roche Co.(Mannheim,Germany);其它均为国产分析纯试剂。
1.3 实验分组 ① 模型组:MCAO(90 min),再灌注(24 h),缺血同时给予生理盐水(2 ml·kg-1,ip,14 days,每天两次),即从缺血计算为0时,大脑中动脉梗死90 min后拔出丝线再灌24 h;于缺血0时给予生理盐水,连续14 d;② PAE治疗组:MCAO(90 min),再灌注(24 h),缺血同时给予PAE(2.5、5、10 mg·kg-1,ip,14 d,每天两次);③ 假手术组。n=8。大鼠生理指征如血氧、血糖等于MCAO前、MCAO过程中及再灌后30 min分别测定,实验过程中动物体温始终维持(37±1)℃。
1.4 大脑中动脉梗死模型的建立 参考Takano模型[5],采用可逆性大鼠大脑中动脉栓塞法造成局灶性脑缺血模型。以水合氯醛(300 mg·kg-1,ip)麻?醉大鼠,颈部切口,游离颈外动脉,远端结扎。取头端呈圆球状4#尼龙线,由颈外动脉根部经颈内动脉向前延伸,插入约20 mm,遇到阻力停止。栓塞90 min后拔出栓线,再灌注24 h。
1.5 神经体征评分标准 根据 Sydserff等[6]神经体征评分:无明显体征(0分);将大鼠悬空观察,其损伤对侧前肢屈曲(1分);损伤对侧据抗推力下降(2分);提尾向损伤的对侧转圈但自由行走时不转圈(3分);自发性向损伤对侧转圈(4分)。
1.6 TTC染色后脑梗死体积的测定 将大鼠断头后,立即取出大脑,置-20℃约15 min,大脑作连续冠状切片(片厚2 mm)。脑片置于1%TTC(pH 7.2)37℃孵育10 min染色,10%甲醛溶液固定。数码相机拍照,测定脑梗死体积。
1.7 逆转录-多聚酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR) 采用RT-PCR技术对mRNA表达进行定量。再灌注24 h后分离皮层、海马和纹状体。TRIzol提取总RNA,逆转录反应液中如下:3 μl(1 μg)总RNA提取液,2 μl 10 mmol·L-1dNTPs,1 μl(1.6 μg)Oligo(dT)18作为引物,1 μl(20 U)RNase抑制剂(Promega,USA),1 μl(20 U)M-MuLA 反转录酶及 4 μl 5 ×buffer。反应条件为:变性(94℃,30 s),退火(68℃,30 s),延伸(72℃,45 s),共35个循环。以2%琼脂糖电泳分离,溴乙啶染色后用凝胶分析仪观察,以看家基因β-actin作为内参,计算相对光密度值。
2 结果
2.1 PAE对脑梗死体积及神经功能缺陷的影响
PAE对脑缺血/再灌注损伤(I/R)的治疗学作用如Fig 1 所示,PAE 在2.5、5 和10 mg·kg-1剂量14 d 治疗后,脑梗死体积分别降低为模型组的0.64倍、0.5倍及0.48倍(P<0.01);神经功能评分分别降低为模型组的0.35倍、0.3倍和0.3倍(P<0.01)。提示PAE对脑缺血/再灌注损伤具有良好治疗学作用。
2.2 对M受体基因表达的影响 PAE对不同脑区I/R后M受体基因表达的影响如Fig 2所示。在皮层、海马和纹状体,PAE治疗性给药14 d后与模型组相比,使M1受体基因表达分别增加1.78倍、1.87倍和1.58倍(P<0.01);使M3受体基因表达分别增加3.5倍、3.2倍和3.07倍(P<0.01);使M5受体基因表达分别增加3.9倍、1.6倍和1.38倍(P<0.01)。

Fig 1 Effects of PAE on the size of cerebral infarct measured by 2,3,5-triphenyltetrazolium chloride(TTC)staining after transient MCAO followed by reperfusion(±s,n=8)
进一步研究了PAE对突触前M2和M4基因表达的影响。在皮层和海马,PAE治疗性给药14 d后与模型组相比,使M2受体基因表达分别降低3.38倍和1.28倍(P<0.01);在皮层、海马和纹状体,使M4受体基因表达分别增加2.05倍、1.55倍和1.23倍(P<0.01)。
2.3 对G蛋白基因表达的影响 进一步研究了I/R及PAE治疗对与不同亚型M受体相偶联的G蛋白基因表达影响(Fig 3)。在3个脑区,I/R可诱导与M2和M4相偶联的Gi蛋白基因表达增高,PAE治疗给药14 d后抑制该病理性改变(P<0.01);I/R和PAE对与M1、M3和M5相偶联的Gαq/11基因表达的影响与此相反。
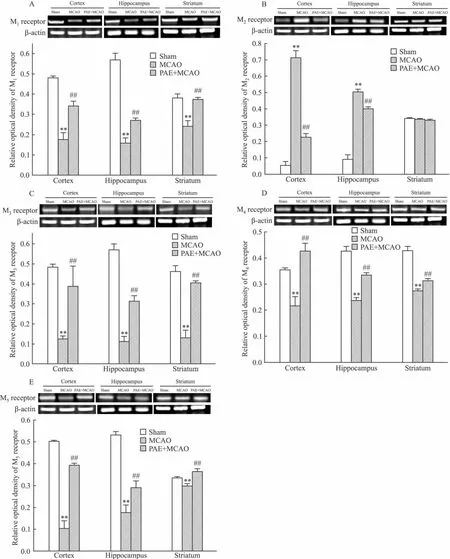
Fig 2 Effects of PAE on M1~M5(A~E)muscarinic receptors gene expression after transient MCAO in cortex,hippocampus and striatum of rats(±s,n=4)
2.4 对ATP敏感性钾通道基因表达的影响 I/R可诱导Kir6.1基因表达上调及Kir6.2表达下调,导致Kir6.2/Kir6.1比值在脑缺血时下调,PAE逆转该病理改变(P <0.01,Fig 4)。
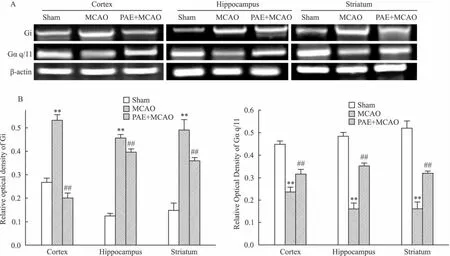
Fig 3Effects of PAE on Giα and Gq/11α gene expression after transient MCAO in cortex,hippocampus and striatum of rats(±s,n=4)
3 讨论
3.1 调节M受体基因表达,促进兴奋性突触传递为其抗脑缺血新机制 根据M受体i3环结构、信号转导途径和生物效应的差异,M受体被分为2类。M1、M3和M5主要通过G蛋白-磷脂酶C-二酰基甘油/三磷酸肌醇(Gq-PLC-DAG/IP3)通路起作用,为M1组;M2和 M4激活 Gi/o-腺苷酸环化酶(AC)-cAMP信号通路,为M2组。中枢M1大量表达于皮层、海马和纹状体,通过影响皮层和海马之间的交互活动发挥调节记忆、学习等高级认知功能;M2主要分布在海马、脑干、丘脑等区域胆碱能神经元突触末梢,调控中枢乙酰胆碱(acetylcholine,ACh)释放;M4主要表达于纹状体内,与多巴胺(DA)受体共存,抑制纹状体内DA释放、调控ACh介导的运动能力;M5全脑表达量不足2%,主要在海马及黑质DA能神经元表达[7],脑微血管内皮细胞M5的激活介导大脑中动脉血管舒张反应,增加脑血流供应,M5基因敲除小鼠丧失脑血管舒张功能,对脑缺血损伤易感性增高[8]。
有报道,脑缺血1~3周后,脑血流明显降低,缺血的皮层M1受体数目降低,M受体结合力减弱[9];双侧颈动脉结扎诱导的脑缺血小鼠,皮层M3、M5受体及胆碱乙酰基转移酶(ChAT)的mRNA表达降低[10]。但有关M受体及其信号转导系统与脑缺血的关系尚无系统报道。本文基于已有报道,系统研究了不同M受体亚型及其信号通路在脑缺血中的改变,并进一步探讨PAE的神经保护机制。
M1、M3和M5受体调节兴奋性突触传递,而M2和M4调节抑制性突触传递。PAE可上调脑缺血/再灌注损伤诱导的M1组受体-M1、M3和M5基因表达,逆转脑缺血诱导的与M1组受体偶联的Gα/11基因表达的降低,从而促进PLC生成,激活 IP3/Ca2+,升高胞内Ca2+浓度产生神经保护作用。与此相反,PAE下调脑缺血诱导的突触前M2受体基因表达,抑制其负反馈调节,从而促进ACh的释放,产生兴奋性突触效应,发挥神经保护作用;有报道M4受体位于海马的兴奋性突触末梢,海马脑片缺氧再灌注24 h后,CA1区M4受体的mRNA表达消失,谷氨酸能突触传递功能降低,与此同时观测到的M受体介导的兴奋性神经递质释放减弱相一致[11](海马脑片再灌注20 h后,氨甲酰胆碱可抑制CA1区EPSP的生成),因此,PAE对M4亚型的调节与M2相反,可明显抑制脑缺血诱导的M4受体基因表达的降低。
由此可见,PAE对M受体及其信号通路调节,最终产生共同效应,即促进兴奋性突触传递而发挥神经保护作用。

Fig 4 Effects of PAE on ATP-sensitive potassium(KATP)channel:Kir6.1,Kir6.2 gene expression and Kir6.2/Kir6.1 ratio after transient MCAO in cortex,hippocampus and striatum of rats(±s,n=4)
3.2 增加Kir6.2/Kir6.1比值为其发挥神经保护作用新途径 ATP敏感性钾通道(ATP-sensitive potassium channel,KATP)由内向整流 K+通道家族(Kir6.1和 Kir6.2)及硫脲受体异构体(SUR1、SUR2A和SUR2B)组成,其开放是缺血预适应重要神经保护机制。大量研究表明KATP开放剂可明显减轻脑缺血后神经功能缺损,减少脑梗死体积,并通过抑制线粒体和死亡受体信号通路减少神经元凋亡,对脑缺血/再灌注损伤发挥保护作用[12]。海马CAl区对缺氧极为敏感,缺氧激活K+内流使细胞膜超极化,阻止Na+、Ca2+超载,细胞膜去极化和胞膜降解,而KATP有助于K+内流的激活。Kir6.2基因敲除小鼠在发生脑缺血15 min后即出现严重神经功能缺失症状,梗死体积明显大于Kir6.2(+/+)野生型小鼠,体外细胞试验也证实了这一点[13];心肌缺血60 min/再灌注24 h的犬,心肌线粒体中Kir6.1蛋白表达水平上调[14];离体培养的胎鼠前脑皮层神经元,以 Aβ1-42处理24 h后,免疫组化和Western blot研究均证明Kir6.1表达明显增加,而KATP开放剂二氮嗪则抑制其蛋白表达[15]。本研究也证实脑缺血可诱导Kir6.2基因表达下调及Kir6.1基因表达的上调,故Kir6.2/Kir6.1比值降低;PAE逆转上述病理改变,增加Kir6.2/Kir6.1比值,激活KATP通道发挥神经保护功能。
综上所述,芍药苷通过调节M受体—G蛋白—KATP通道发挥神经保护作用,具有发展为安全、有效、机制新颖的抗脑缺血候选药物应用前景。
[1]Mao Q Q,Zhong X M,Li Z Y,et al.Paeoniflorin protects against NMDA-induced neurotoxicity in PC12 cells via Ca2+antagonism[J].Phytother Res,2011,25(5):681-5.
[2]Mao Q Q,Zhong X M,Feng C R,et al.Protective effects of paeoniflorin against glutamate-induced neurotoxicity in PC12 cells via antioxidant mechanisms and Ca(2+)antagonism[J].Cell Mol Neurobiol,2010,30(7):1059-66.
[3]Tang N Y,Liu C H,Hsieh C T,et al.The anti-inflammatory effect of paeoniflorin on cerebral infarction induced by ischemia-reperfusion injury in Sprague-Dawley rats[J].Am J Chin Med,2010,38(1):51-64.
[4]Chen D M,Xiao L,Zhu X Z,et al.Involvement of multitargets in paeoniflorin-induced preconditioning[J].J Pharmacol Exp Ther,2006,319(1):165-80.
[5]Takano K,Tatlisumak T,Bergmann A G,et al.Reproducibility and reliability of middle cerebral artery occlusion using a silicone-coated suture(Koizumi)in rats[J].J Neurol Sci,1997,153:8- 11.
[6]Sydserff S G,Borelli A R,Green A R,et al.Effect of NXY-059 on infarct volume after transient or permanent middle cerebral artery occlusion in the rat:studies on dose,plasma concentration and therapeutic time window[J].Br J Pharmacol,2002,135:103-12.
[7]Bendor J,Lizardi-Ortiz J E,Westphalen R I,et al.AGAP1/AP-3-dependent endocytic recycling of M5 muscarinic receptors promotes dopamine release[J].EMBO J,2010,29(16):2813-26.
[8]Gericke A,Sniatecki J J,Mayer V G,et al.Role of M1,M3and M5muscarinic acetylcholine receptors in cholinergic dilation of small arteries studied with gene-targeted mice[J].Am J Physiol Heart Circ Physiol,2011,300(5):H1602- 8.
[9]Hoff E I,Steinbusch H W,van Oostenbrugge R J,et al.Alterations in the cholinergic system after frontal cortical infarction in rat brain:Pharmacological magnetic resonance imaging of muscarinic receptor responsiveness and stereological analysis of cholinergic forebrain neurons[J].Neurobiol Dis,2011,43(3):625- 34.
[10]Zhao Q,Murakami Y,Tohda M,et al.Chotosan,a kampo formula,ameliorates chronic cerebral hypoperfusion-induced deficits in object recognition behaviors and central cholinergic systems in mice[J].J Pharmacol Sci,2007,103(4):360-73.
[11]Zhang G,Zhang L,Logan R,et al.Decreased expression and impaired function of muscarinic acetylcholine receptors in the rat hippocampus following transient forebrain ischemia[J].Neurobiol Dis,2005,20(3):805-13.
[12]Ye Z,Guo Q,Wang N,et al.Delayed neuroprotection induced by sevoflurane via opening mitochondrial ATP-sensitive potassium channels and p38 MAPK phosphorylation[J].Neurol Sci,2011,Jul 1[Epub ahead of print].
[13]Sun H S,Feng Z P,Barber P A,et al.Kir6.2-containing ATP-sensitive potassium channels protect cortical neurons from ischemic/anoxic injuryin vitroandin vivo[J].Neuroscience,2007,144(4):1509-15.
[14]Mykytenko J,Reeves J G,Kin H,et al.Persistent beneficial effect of postconditioning against infarct size:role of mitochondrial K(ATP)channels during reperfusion[J].Basic Res Cardiol,2008,103(5):472-84.
[15]Ma G,Gao J,Fu Q,et al.Diazoxide reverses the enhanced expression of KATP subunits in cholinergic neurons caused by exposure to Aβ1-42[J].Neurochem Res,2009,34(12):2133-40.

