大黄素对P2X2/3受体介导的三叉神经痛的作用研究
吴饶平,熊 伟,欧晓艳,刘 晗,邱淑怡,李桂林,徐昌水,刘双梅,梁尚栋,高 云
(南昌大学1.基础医学院生理学教研室、2.附属口腔医院预防科,江西南昌 330006)
三叉神经痛(trigeminal neuralgia,TN)是一种病因不明,单侧撕裂性或电击性阵痛的慢性疼痛综合症,临床上发病率较高,但治疗困难,对患者及家属的生活造成极大的痛苦[1-2]。目前虽然治疗药物较多,但有效而副作用小的药很少,而且容易发生耐药[3-4]。因此我们有必要寻找TN治疗新的更有效的方法。目前大量研究证实,ATP及其类似物作用的P2X嘌呤受体在伤害性感受信号传递过程中起着重要作用[5-8],其中 P2X2/3受体和痛觉传递关系最为密切,且可能参与三叉神经痛的发生。大黄素(emodin)是中药大黄的主要有效成分,化学名为1,3,8-三羟基-6 甲基蒽醌(1,3,8-trihydroxy-6methy lanthraquinone),分子式为 C15H10O5,分子量为270.23,化学结构属于羟基蒽醌类,其药理作用主要集中在抑制细胞增殖、抗炎、抑制肝脏和肾脏纤维化等方面。有实验结果显示大黄素通过多种途径产生抗炎作用[9]。永久性的神经病理痛有神经炎性及神经免疫性作用[10]。所以大黄素可能通过其抗炎及免疫抑制作用缓解外周神经疼痛[11]。目前还不清楚大黄素是否影响慢性疼痛的信息传递。ATP是神经调质,P2X2/3参与神经病理痛中的伤害感受传导,本研究试图阐明在P2X2/3受体介导的三叉神经痛中,大黄素对痛觉传递的作用。
1 材料与方法
1.1 动物和分组 ♂ SD大鼠,220~250 g,40只,江西中医学院实验动物科学部提供,合格证号:JZDWN2:2011-0316。将大鼠随机分为4组,每组10只。Ⅰ组为0.5%羧甲基纤维素钠溶液注射对照组(Control)、Ⅱ组为假手术组(Sham)、Ⅲ组为三叉神经痛模型组(TN)、Ⅳ组为TN模型+大黄素干预组(TN+E)。Ⅰ组每天按5 ml·kg-1剂量腹腔注射0.5%的羧甲基纤维素钠至实验结束;Ⅱ组切开皮肤暴露眶下神经,不结扎神经,即缝合皮肤;Ⅳ组术后d 1开始每天每只大鼠腹腔注射50 mg·kg-1大黄素至实验结束,大黄素用0.5%的羧甲基纤维素钠溶解。
1.2 药品和试剂 大黄素(南京泽朗医药科技有限公司),10%水合氯醛(上海新亚药业有限公司),DAB显色试剂盒(北京中山生物技术有限公司),免疫组化SP-9001试剂盒(北京中山生物技术有限公司),P2X2、P2X3原位杂交试剂盒(武汉博士德生物工程有限公司),P2X2、P2X3抗体(Millipore公司),β-actin、P2X2、P2X3引物(北京生物工程有限公司)。
1.3 三叉神经痛模型的建立 参照文献[12]10%水合氯醛按4 ml·kg-1剂量对大鼠进行腹腔内注射麻醉。大鼠麻醉后取俯卧位,头部及四肢固定。备皮、消毒、铺巾。在手术显微镜下做眉弓上弧形切口,显露颅骨额骨和鼻骨,暴露眼眶,沿眶上缘将眶内容物用神经剥离子拨开,暴露位于眶底部内侧的眶下神经,在眶内从近端仔细分离眶下神经至远端的眶下孔。用两根铬肠线(5-0)间距约2 mm结扎眶下神经,力度适中。压迫标准:在显微镜下可见结扎线使神经的直径略微变细,但不能完全阻断其传导且神经外膜的血液循环必须通畅。缝合创口,待动物清醒后给予一般饲养。
1.4 三叉神经痛大鼠机械痛敏测定 将各组大鼠分别于手术前 1 d,术后 1、3、5、7、9、11、13 d 行机械痛敏阈值测试(测定时间恒定于每日10:00~14:00,室温维持在22℃ ±0.5℃)。机械痛敏阈值是由BME-403 Von Frey细丝(购自中国医学科学院生物医学工程研究所)来测定,折力分别为:0.13、0.20、0.33、0.60、1.30、3.60、5.00、7.30、9.90、20.1 g,从最小折力开始,刺激部位为眶下神经在面部感觉支配区域—围绕鼻区中央的触须部位及周围有毛皮肤。手持刺激棒缓慢接近大鼠,先在手术的对侧刺激3下,使细丝弯曲,再在手术侧刺激3下,每一强度的细丝共刺激6次。在此过程中,细丝的强度由低到高依次递增。动物的阳性反应包括:①经刺激即表现为快速的后退动作,大鼠为避免面部进一步被接触,倦缩身子向笼壁靠拢,或将头面部藏在身下,躲避刺激物。② 攻击行为,大鼠亦可表现出快速抓咬刺激物,做出攻击动作。③非对称性的面部搔抓,表现为至少连续3次搔抓面部刺激区域的动作,通常合并后退动作。出现以上3种反应中任意1项或l项以上即认为是刺激实验阳性,使大鼠产生阳性反应细丝强度最小值即为疼痛反应阈值。④如果刺激强度为20.1 g时,大鼠未出现以上任何一种反应,疼痛阈值定为20.1 g。观察各组大鼠手术前后对于不同强度细丝刺激产生痛觉反应阚值的变化,与对照组比较,进行统计学分析。
1.5 大鼠三叉神经节P2X2/3受体的表达测定
1.5.1 原位杂交 大鼠迅速断头,取手术侧TG,原位杂交用PBS冲洗后用原位杂交用4%多聚甲醛固定24 h,然后浸入原位杂交用30%蔗糖脱水24 h,期间换糖水3次,4℃冰箱过夜。恒冷切片机将TG切成15 μm厚的薄片,烤片37℃,2 h,-20℃保存。原位杂交过程按说明书完成。显微镜下拍照,实验结果用Image tool图像分析系统观察分析光密度。
1.5.2 RT-PCR 按说明书完成总RNA的提取和cDNA的合成。本研究选用β-actin作为内参,引物序列如下:
Primer P2X2(产物长度为273 bp),S:5'-CTGCCTCCTCAGGCTACAACTTCA-3';A:5'-GAGTACGCACCTTGTCGAACTTCT-3'。Primer P2X3(产物长度为 519 bp),S:5'-CAACTTCAGGTTTGCCAAA-3';A:5'-TGAACAGTGAGGGCCTAGAT-3'。Primer β-actin(产物长度为240 bp),S:5'-TAAAGACCTCTATGCCAACACAGT-3';A:5'-CACGATGGAGGGGCCGGACTCATC-3'。
P2X2、P2X3和 β-actin扩增体系分别如下:DEPC 水 9.5 μl,cDNA 1 μl,上下游引物各 1 μl,2 ×Taq酶12.5 μl。PCR 反应条件:94℃ 3 min;94℃ 45 s,56℃ 45 s,72℃ 45 s,共 35 个循环;72℃ 5 min。各组取5 μl扩增产物进行1%琼脂糖凝胶电泳,紫外灯下观察结果、拍照,采用凝胶成像系统读取分析目的电泳条带,以各组β-actin为内参将其相应组P2X2、P2X3的灰度值标化后进行比较。
1.5.3 免疫组织化学 大鼠迅速断头,取手术侧TG,用PBS冲洗后,4%多聚甲醛固定24 h,然后将组织浸入30%蔗糖脱水24 h,中途换糖水3次,4℃冰箱过夜。恒冷切片机将TG切成15 μm厚的薄片,烤片37℃,2 h,-20℃保存。二步法免疫组织化学染色,DAB显色。显微镜下拍照,用Image tool图像分析系统观察分析光密度。
1.5.4 免疫荧光 前期准备同免疫组化,免疫荧光过程按说明书完成。荧光显微镜下拍照,实验结果用Image tool图像分析系统观察分析光密度。
1.5.5 Western blot 将手术侧大鼠TG置于2 ml匀浆器中球状部位,加300 μl去污剂裂解液(含10%PMSF)于匀浆器中进行冰上匀浆,充分裂解后移至1.5 ml离心管中,以12 000 r·min-1于 4℃ 离心5 min,取上清分装于0.5 ml离心管中并置于-20℃保存。SDS-PAGE电泳,转膜,免疫学检测,光密度分析。通过Image tool图像分析软件读取目的条带在X光胶片上测得的光密度扫描值,以各组β-actin条带的扫描值标化其相应组P2X2、P2X3的蛋白表达量。
1.6 统计学分析 实验数据用SPSS11.5统计软件进行统计分析,各实验组数据均以±s表示,各组数据间的统计采用方差分析。
2 结果
2.1 大鼠机械痛敏阈值测定 手术前Ⅰ组(Control组)、Ⅱ组(Sham组)、Ⅲ组(TN组)、Ⅳ组(TN+E)之间相比大鼠手术侧眶下神经面部感觉区域机械痛阈值差异没有显著性(P>0.05)。术后2周内,Ⅲ组(TN模型组)的机械痛反射阈值在双侧都有所下降,手术侧下降更为明显。术后d 1开始,Ⅲ组的手术侧机械痛反射阈值与Ⅰ组、Ⅱ组、Ⅳ组比较降低(P<0.01),并从术后d 3开始明显并一直持续到14 d(P<0.01)。从术后d 1开始,Ⅳ组的手术侧机械痛反射阈值和Ⅰ、Ⅱ组比较有所降低(P<0.01),从d 11开始无差异,但从术后d 5开始与Ⅲ组比较明显增加(P<0.05),见Fig 1。
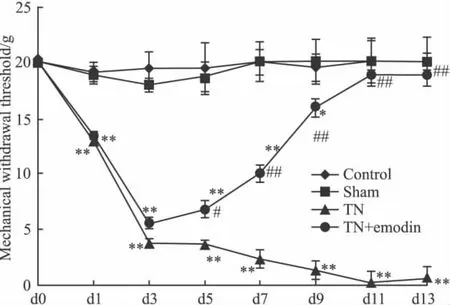
Fig 1 Effect of emodin on the mechanical withdrawal threshold of TN rats(n=10)

Average optical density of P2X3mRNA in the four groups(n=10).##P <0.01 vs TN.(arrows indicated the immunostaining neurons;scale bars,100 μm)
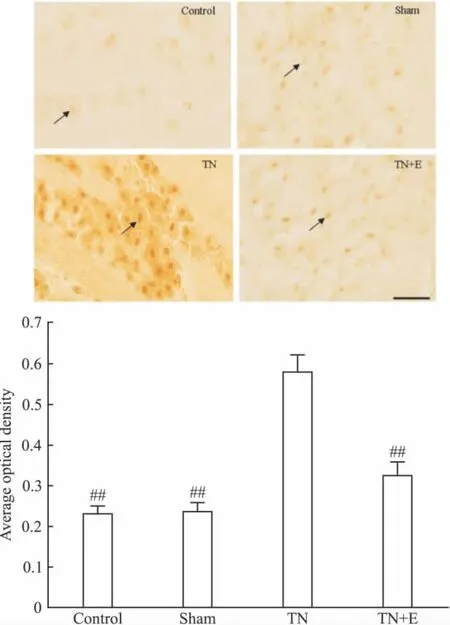
Fig 2B Effects of emodin on the expression of P2X2receptor mRNA in trigeminal ganglion of each group by in situ hybridization on postoperative d 14
2.2 大鼠TG中P2X2/3受体表达的测定
2.2.1 原位杂交 术后14 d,原位杂交测定大鼠TG切片中P2X2/3受体mRNA的表达。于每只大鼠TG切片中隔5张取1张切片,用图像分析系统软件分析P2X2/3阳性神经元的光密度变化。Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组P2X3阳性神经元的平均光密度分别为:0.2311±0.0204、0.2355 ±0.0216、0.5801 ±0.0422、0.3233±0.035。Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组P2X2阳性神经元的平均光密度分别为:0.2551±0.0236、0.2678 ± 0.0253、0.5676 ± 0.0463、0.2933±0.0315。Ⅰ组、Ⅱ组、Ⅳ组之间P2X2/3受体表达差异无显著性(P>0.05);Ⅲ组TG中P2X2/3受体的表达较Ⅰ组、Ⅱ组明显增加(P<0.01);Ⅳ组TG中P2X2/3受体的表达较Ⅲ组低(P<0.01),见Fig 2。
2.2.2 RT-PCR 术后14 d,PCR方法测定各组三叉神经节中P2X2/3受体mRNA的表达。经凝胶成像系统软件分析后,以β-actin为内参将P2X3的灰度值进行标化,结果如下:Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组分别为:0.3081 ±0.0162、0.3111 ±0.0110、0.4979 ±0.0271、0.3359 ±0.0125。以β-actin为内参将P2X2的灰度值进行标化,结果如下:0.3055±0.0167、0.3150±0.0132、0.6266 ±0.0199、0.3445 ±0.0131。Ⅰ组、Ⅱ组、Ⅳ组之间P2X2/3受体表达差异无显著性(P>0.05);Ⅲ组TG中P2X2/3受体的表达较Ⅰ组、Ⅱ组明显增加(P<0.01);Ⅳ组 TG中P2X2/3受体的表达较Ⅲ组低(P<0.01),见Fig 3。
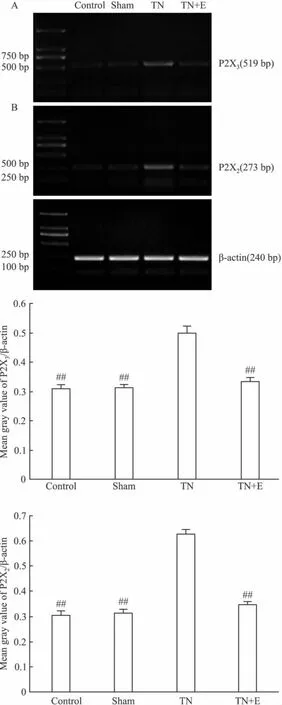
Fig 3 Effects of emodin on the expression of P2X3receptor mRNA in TG of each group by RT-PCR on postoperative d 14(n=10)
2.2.3 免疫组织化学 术后14 d,免疫组化测定大鼠TG切片中P2X2/3受体的表达。于每只大鼠TG切片中隔5张取1张切片,用图像分析系统软件分析P2X2/3阳性神经元的光密度变化。Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组P2X3阳性神经元的平均光密度分别为:0.1668±0.0246、0.1702 ±0.0197、0.3290 ±0.0283、0.1847±0.0210。Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组P2X2阳性神经元的平均光密度分别为:0.1549±0.0183、0.1657 ± 0.0143、0.3548 ± 0.0243、0.1808±0.0228。Ⅰ组、Ⅱ组、Ⅳ组之间P2X2/3受体表达差异无显著性(P>0.05);Ⅲ组TG中P2X2/3受体的表达较Ⅰ组、Ⅱ组明显增加(P<0.01);Ⅳ组TG中P2X2/3受体的表达较Ⅲ组低(P<0.01),见Fig 4。
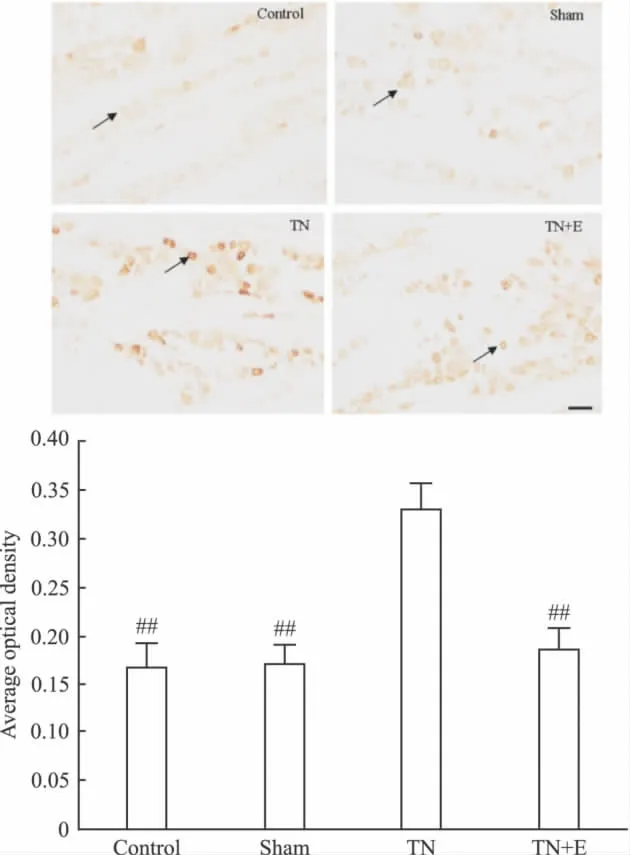
Fig 4A Effects of emodin on the expression of P2X3receptor protein in TG of each group by immunohistochemistry on postoperative d 14(n=10)
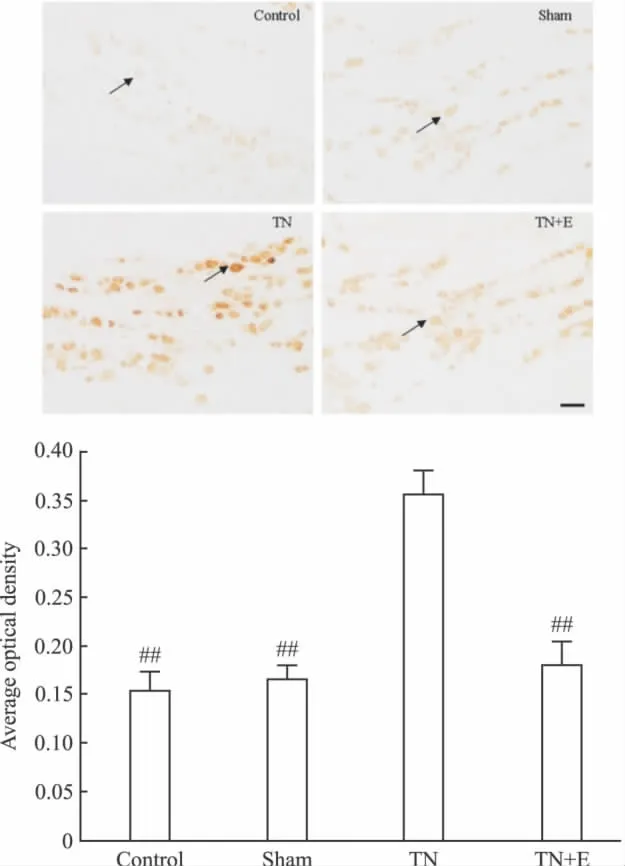
Fig 4B Effects of emodin on the expression of P2X2receptor protein in trigeminal ganglion of each group by immunohistochemistry on postoperative d 14(n=10)
2.2.4 免疫荧光 术后14 d,免疫荧光双标测定大鼠TG切片中P2X3、P2X2受体的表达。结果显示,P2X3和P2X2共同表达于三叉神经节神经元细胞上,且Ⅲ组TG中P2X2/3受体的表达较Ⅰ组、Ⅱ组、Ⅳ组增加,见Fig 5。
2.2.5 蛋白印迹 术后14 d,Western blot方法测定各组三叉神经节中P2X2/3受体蛋白的表达。经凝胶成像系统软件分析后,以β-actin为内参将P2X3的光密度值进行标化,结果如下:Ⅰ组、Ⅱ组、Ⅲ组、Ⅳ组分别为:0.1523±0.0163、0.1632±0.0184、0.6666±0.0482、0.2319±0.0284。以 β-actin为内参将P2X2的光密度值进行标化,结果如下:0.1879± 0.0174、0.1893 ± 0.0187、0.5362 ± 0.0429、0.3246±0.0262。Ⅰ组、Ⅱ组、Ⅳ组之间P2X2/3受体表达差异无显著性(P>0.05);Ⅲ组TG中P2X2/3受体的表达较Ⅰ组、Ⅱ组明显增加(P<0.01);Ⅳ组TG中P2X2/3受体的表达较Ⅲ组低(P<0.01),见Fig 6。
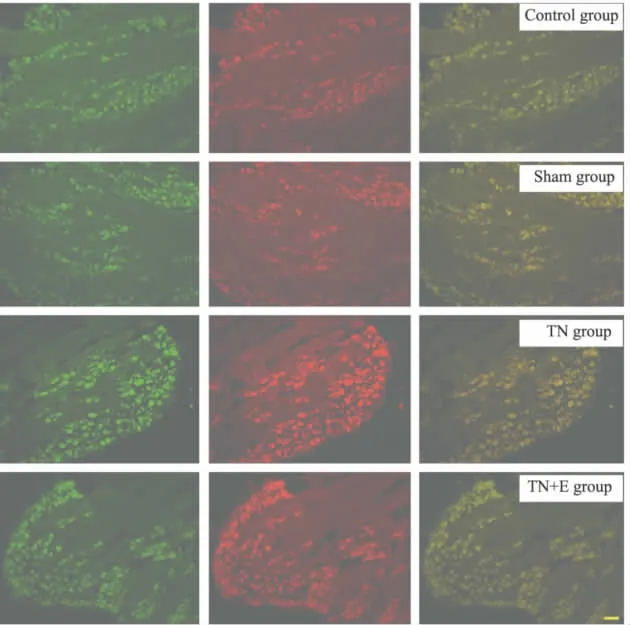
Fig 5 Colocation of P2X2and P2X3in TG by double-label immunofluorescence on postoperative d 14
3 讨论
嘌呤受体分为P1和P2受体,ATP及其类似物作用于P2受体。P2受体分为配体门控性离子通道型受体(P2X受体)和G蛋白偶联型受体(P2Y受体)[13]。大量研究显示嘌呤受体中的P2X2/3受体参与疼痛的发病过程[14-16]。三叉神经节中含有大量与外周痛觉传导有关的中小型神经细胞,并有P2X2/3受体的表达[17],但目前 P2X2/3受体在三叉神经痛的痛觉传导过程中所起的作用还不是很清楚。
本实验应用大鼠三叉神经痛模型研究发现,术后d 1开始,TN模型组的机械痛敏阈值降低,并从术后d 3开始更为明显并一直持续到d 14。应用RT-PCR和原位杂交技术检测TN大鼠手术侧TG中P2X2/3受体mRNA的表达,结果显示TN模型大鼠TG中P2X2/3受体mRNA的表达明显升高,免疫组化和蛋白印迹技术检测大鼠手术侧TG中P2X2/3受体蛋白的表达,结果与其在mRNA水平的表达也基本一致。这些结果提示,P2X2/3受体蛋白和 mRNA的表达异常与三叉神经痛密切相关。我们推测与外周痛觉传递有关的TG神经元可能是通过激动P2X2/3受体,参与痛觉的调制。慢性压迫损伤眶下神经造成的三叉神经节P2X2/3受体免疫反应阳性数量增加,有可能是由于在神经损伤位点,异位嘌呤能神经敏感性增强,从而导致P2X受体上调所致。
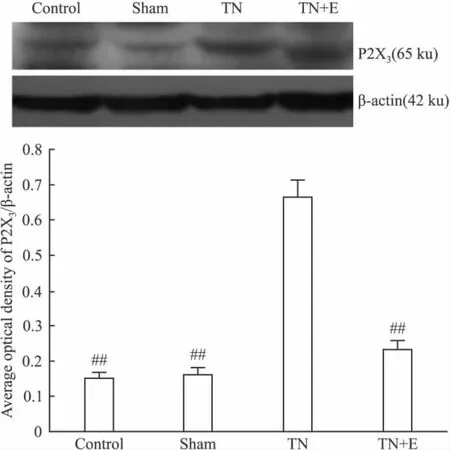
Fig 6A Effects of emodin on the expression of P2X3receptor protein in TG of each group by Western blot on postoperative d 14(n=10)
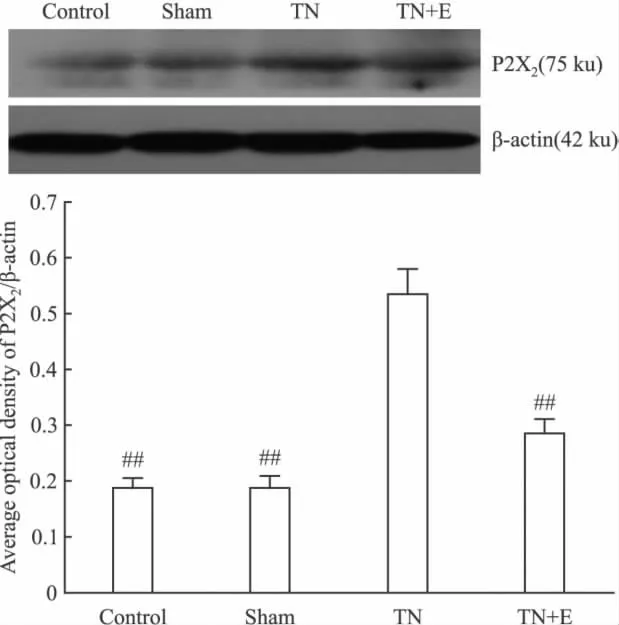
Fig 6B Effects of emodin on the expression of P2X2receptor protein in trigeminal ganglion of each group by Western blot on postoperative d 14(n=10)
近年大量研究显示嘌呤受体中的P2受体是参与痛觉传递的重要受体[18-19],嘌呤受体可能成为疼痛治疗的新靶点[20]。我们实验室以往的实验也显示能特异性拮抗P2X3受体的川芎嗪、阿魏酸钠等药物对坐骨神经压迫损伤神经病理痛大鼠的机械性痛觉异常和热痛觉过敏有一定的缓解作用[21-22]。本实验我们采用大黄素进行干预治疗后发现,大黄素能明显提高TN大鼠的机械痛敏阈值,而且从术后d 5开始明显增加,于术后d 11开始和对照组差异无显著性。这些结果表明大黄素对TN大鼠的机械痛敏具有一定的抑制作用,可以缓解TN大鼠神经病理痛的行为学表现。用大黄素对TN大鼠进行治疗后,RT-PCR和原位杂交技术检测结果表明TN大鼠手术侧TG中升高的P2X2/3受体mRNA表达有明显下降,免疫组化和蛋白印迹技术检测结果也表明大鼠手术侧TG中P2X2/3受体蛋白的表达也有明显下降。因此提示大黄素可能是通过抑制P2X2/3受体表达上调而对三叉神经痛大鼠的机械痛敏发挥抑制作用,大黄素对P2X2/3受体介导的三叉神经痛具有一定抑制作用。
总之,TN是一个非常复杂的病理过程,对原发性三叉神经痛迄今为止还没有一个确切的病因解释,也没有特别有效且副作用比较小的药物治疗,有必要进一步研究该病的分子机制,以便寻找新的治疗方法。本研究表明P2X2/3受体涉及到TN大鼠的疼痛传递过程,大黄素可以降低TN大鼠 TG中P2X2/3受体的表达,抑制TN大鼠的机械痛敏,提示大黄素有可能成为TN治疗的新的靶点药物,促进TN的治疗发展。
[1]Obermann M,Katsarava Z.Update on trigeminal neuralgia[J].Expert Rev Neurother,2009,9(3):323-9.
[2]Boto G R.Trigeminal neuralgia[J].Neurocirugía,2010,21(5):361-72.
[3]Zakrzewska J M.Medical management of trigeminal neuropathic pains[J].Expert Opin Pharmacotherapy,2010,11(8):1239-54.
[4]Yang M,Zhou M,He L,et al.Non-antiepileptic drugs for trigeminal neuralgia[J].Cochrane Database Syst Rev,2011,19(1):CD004029.
[5]张 君,李 欣,刘 晗,等.嘌呤信号转导研究的新方法[J].
中国药理学通报,2010,26(7):858-61.
[5]Zhang J,Li X,Liu H,et al.The new methods of purinergic signalling research[J].Chin Pharmacol Bull,2010,26(7):858-61.
[6]高 云,梁尚栋,邵立建,等.川芎嗪对 P2X3受体介导的神经病理痛的作用研究[J].中国药理学通报,2007,23(4):458-62.
[6]Gao Y,Liang S D,Shao L J,et al.Effect of TMP on neuropathic pain mediated by P2X3receptor[J].Chin Pharmacol Bull,2007,23(4):458-62.
[7]Jarvis M F.The neural-glial purinergic receptor ensemble in chronic pain states[J].Trends Neurosci,2010,33(1):48- 57.
[8]Gunosewoyo H,Kassiou M.P2X purinergic receptor ligands:recently patented compounds[J].Expert Opin Ther Pat,2010,20(5):625-46.
[9]Myers R R,Campana W M,Shubayev V I.The role of neuroinflammation in neuropathic pain:mechanisms and therapeutic targets[J].Drug Disov Today,2006,11(1-2):8-20.
[10]Wang C,Zhang D,Ma H,et al.Neuroprotective effects of emodin-8-O-beta-D-glucosidein vivoandin vitro[J].Eur J Pharmacol,2007,577(1-3):58-63.
[11]Erlinge D,Burnstock G.P2 receptors in cardiovascular regulation and disease[J].Purin Ergic Signal,2008,4(1):1- 20.
[12]Vos B P,Strassman A M,Maciewicz R J.Behavioral evidence of trigeminal neuropathic pain following chronic constriction injury to the rat’s infraorbital nerve[J].J Neurosci,1994,14(5 Pt 1):2708-23.
[13]Jarvis M F,Burgard E C,McGaranghty S,et al.A-317491,a novel potent and selective non nucleotide antagonist of P2X3and P2X2/3receptors,reduces chronic inflammatory and neuropathic pain in the rat[J].Proc Natl Acad Sci USA,2002,99(26):17179-84.
[14]Wan F,Li G,Liu S,et al.P2X2/3receptor activity of rat nodose ganglion neurons contributing to myocardial ischemic nociceptive signaling[J].Auton Neurosci,2010,158(1-2):58-64.
[15]Gao Y,Liu H,Deng L,et al.Effect of emodin on neuropathic pain transmission mediated by P2X2/3receptor of primary sensory neurons[J].Brain Res Bull,2011,84(6):406-13.
[16]Ballini E,Virginio C,Medhurst S J,et al.Characterization of three diaminopyrimidines as potent and selective antagonists of P2X3and P2X2/3receptors within vivoefficacy in a pain model[J].Br J Pharmacol,2011,163(6):1315-25.
[17]Gu Y Z,Yin G F,Guan B C,et al.Characteristics of P2X purinoceptors in the membrane of rat trigeminal ganglion neurons[J].Sheng Li Xue Bao,2006,58(2):164-70.
[18]雷 洁,王元银,刘安东,等.ATP对大鼠三叉神经节小直径神经元胞内钙浓度的调制作用及其机制[J].中国药理学通报,2010,26(11):1450-4.
[18]Lei J,Wang Y Y,Liu A D,et al.ATP-induced intracellular calcium signal transduction mechanism in the small trigeminale ganglion neurons of rat[J].Chin Pharmacol Bull,2010,26(11):1450- 4.
[19]Shinoda M,Kawashima K,Ozaki N,et al.P2X3receptor mediates heat hyperalgesia in a rat model of trigeminal neuropathic pain[J].J Pain,2007,8(7):588-97.
[20]Burnstock G.Purinergic P2 receptors as targets for novel analgesics[J].Pharmacol Ther,2006,110(3):433-54.
[21]Gao Y,Xu C,Liang S,et al.Effect of tetramethylpyrazine on primary afferent transmission mediated by P2X3receptor in neuropathic pain states[J].Brain Res Bull,2008,77(1):27-32.
[22]Zhang A,Gao Y,Zhong X,et al.Effect of sodium ferulate on the hyperalgesia mediated by P2X3receptor in the neuropathic pain rats[J].Brain Res,2010,1313(2):215-21.

