鞘内注射甘珀酸对腰5脊神经切断大鼠痛觉高敏的影响
李雪飞,许 倩,许佩龙,谢文强,王洪超,李伟伟,刘 健,李伟彦
(1.南方医科大学南京临床医学院,2.南京军区总医院麻醉科,江苏 南京 210002)
越来越多的研究发现星形胶质细胞的活化在神经病理性疼痛的维持起着重要的作用[1],但星形胶质细胞的活化机制目前仍不清楚。缝隙连接是细胞间直接进行物质和信息交换的唯一通道,星形胶质细胞之间存在广泛的缝隙连接[2],因此有学者提出缝隙连接可能参与了神经病理性疼痛时星形胶质细胞的活化[3]。甘珀酸(carbenoxolone,CBX)是常用的缝隙连接阻滞剂,本实验通过单次鞘内注射大剂量CBX,观察其对SNT大鼠损伤侧机械痛敏,以及损伤侧脊髓背角 GFAP和 TNF-α、IL-1β表达的影响,来探讨缝隙连接是否参与了神经病理性疼痛时星形胶质细胞活化。
1 材料与方法
1.1 动物模型 体质量160~180 g的成年♂Sprague-Dawley大鼠36只(由南京军区总医院比较医学科提供,清洁级),单笼饲养。动物饲养室温为 (23±3)℃,周期光照8:00~20:00,大鼠自由进食,饮水。所有实验均在光照期间完成。以2%的戊巴比妥(Sigma公司,美国)50 mg·kg-1腹腔注射麻醉,根据Kim等的方法[4]创建模型。
1.2 药物及分组 甘珀酸(Sigma,美国);兔抗大鼠胶原纤维酸性蛋白(anti-glial fibrillary acidic protein,GFAP)抗体(Sigma,美国);ELISA试剂盒。所有动物随机分成3组:假手术组(Sham组)、生理盐水组(NS组)、SNT+CBX 5 μg组(CBX 组)。
1.3 鞘内注射 参照Mestre等[5]所建立的方法。大鼠麻醉后用连有PE-10导管的稍钝针头经腰5(L5)和腰4(L4)锥间隙行椎管穿刺,以动物出现突然地侧向甩尾运动作为穿刺成功的标志,鞘内注射采用微量进样器进行。术后10 d,Sham组和NS组鞘内注射 10 μl NS,CBX 组大鼠鞘内注射 10 μl CBX,浓度0.5 g·L-1甘珀酸的剂量选择参考既往文献。
1.4 机械痛阈的测定 3组大鼠随机取6只于术前1 d,术后 1、3、5、7 d 及术后 10 d 给药前,给药后1、2、4、6 h 测定损伤侧后肢机械痛阈(MWT)。MWT测定:将大鼠分别放置于金属筛网上的有机玻璃箱里,安静15 min,以Von Frey纤维垂直刺其左右后肢足底中部皮肤,持续≤4 s,大鼠出现抬足,舔足,躲避等反应时,记录Electrovon Frey读数器上显示的最大值(g),每只老鼠重复测量5次,间隔5 min,去除最大和最小值计算3次的平均值即为大鼠的MWT值。
1.5 免疫组织化学染色 3组大鼠术后10 d鞘内注射CBX 2 h后,分别取3只按以下方法取材检测。2%的戊巴比妥钠50 mg·kg-1经腹腔注射麻醉,开胸后经左心室插管至升主动脉,依次灌注生理盐水250 ml、4% 多聚甲醛(pH 7.4)400 ml、PBS 缓冲液250 ml约1 h后取大鼠腰膨大脊髓,于上述固定液中固定24 h。经梯度乙醇脱水,二甲苯透明石蜡包埋,进行连续切片,片厚40 μm,每个蜡块连续切5片。以ABC法作GFAP免疫组化染色。染片用半自动图像分析仪进行图像分析,计算各切片损伤侧GFAP阳性细胞数表示星形胶质细胞表达的强度。胞质出现棕黄色颗粒沉积为GFAP免疫组化阳性反应细胞。
1.6 TNF-α和IL-1β水平检测 ELISA测定损伤侧脊髓TNF-α和IL-1β浓度。按照试剂盒中说明书操作,并在波长为450 nm,参考波长为620 nm处,用酶标仪(美国Bio-Rad公司)测定光密度,根据标准曲线算出TNF-α和IL-1β浓度。
2 结果
2.1 MWT测定结果 术前1 d,3组大鼠MWT差异均无显著性(P>0.05)。与术前相比,Sham组各时间点损伤侧MWT差异无显著性(P>0.05)。与Sham 组相比,NS 组和 CBX 组术后1、3、5、7、10 d 痛阈下降(P<0.05)。与术后10 d给药前1 h相比,NS组给药后1、2、4、6 h的MWT值差异无显著性(P>0.05)。与 NS 组相比,CBX 组术后1、3、5、7 d 及10 d给药前MWT与其差异无显著性(P>0.05),但给药后1、2、4 h损伤侧MWT较给药前明显提高(P<0.05),但6 h时差异无显著性(P>0.05),见Fig 1。
2.2 GFAP测定结果 NS组损伤侧脊髓背角GFAP染色较Sham组有明显的增强,CBX组损伤侧脊髓背角GFAP染色较Sham组略有增强,但较NS组染色明显减弱(Fig 2)。NS组损伤侧脊髓背角GFAP阳性细胞数较Sham组均明显升高(P<0.05),CBX组损伤侧脊髓背角GFAP阳性细胞数较NS组明显降低(P<0.05),见Fig 3。

Fig 1 Intrathecal administration of CBX affects SNT-induced mechanical allodynia
2.3 TNF-α和IL-1β测定结果 NS组损伤侧脊髓背角TNF-α和IL-1β的水平较Sham组均明显上升(P<0.05);CBX组损伤侧脊髓背角TNF-α和IL-1β的水平较NS组明显下降(P<0.05)。见Tab 1。
Tab 1 The changes of TNF-α and IL-1β in the spinaldorsal horn in the three groups(±s,ng·g-1)

Tab 1 The changes of TNF-α and IL-1β in the spinaldorsal horn in the three groups(±s,ng·g-1)
2 h after intrathecal injection NS and CBX,the expression of TNF-α and IL-1β in the ipsilateral spinal dorsal horn in NS group were significantly increased compared with those in group sham(*P <0.05).Compared with group NS,the expression of TNF-α and IL-1β in the spinal dorsal horn in CBX group was significantly decreased(#P <0.05).
Group TNF-α IL-1β Sham 9.68 ±2.91 25.73 ±2.73 NS 148.43 ±9.92* 317.30 ±22.97*CBX 69.15 ±9.27*# 140.06 ±19.84*#
3 讨论
越来越多的研究证实,神经损伤或炎症后脊髓的小胶质细胞、星形胶质细胞相继活化,通过释放促炎细胞因子、趋化因子、前列腺素、一氧化氮,或者影响脊髓内重要神经递质谷氨酸的转运平衡[6-7],导致了痛觉传递通路神经元的高兴奋性,从而诱导和维持了慢性神经病理性疼痛,其中星形胶质细胞在疼痛的维持中发挥重要作用。采用非特异性的胶质细胞抑制剂如:氟代柠檬酸、丙戊茶碱、米诺环素、己酮可可碱等,可明显地缓解神经病理性疼痛动物模型的痛觉高敏[8-10],因此调控神经胶质细胞,尤其是星形胶质细胞的活性是神经病理性疼痛研究的一个重要方向。

Fig 2 GFAP expression in the dorsal horn of the spinal cord in rats
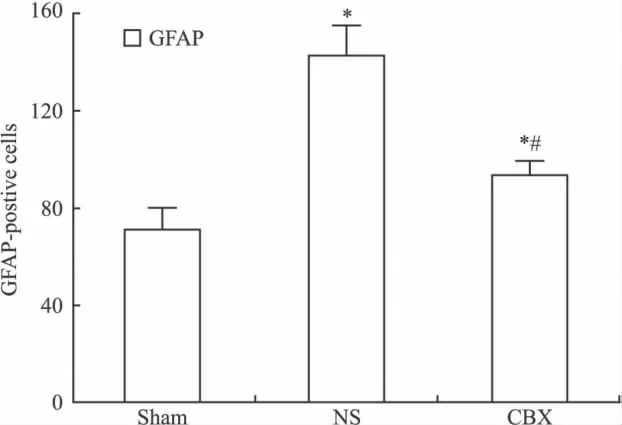
Fig 3 Changes of number for astrocytic activation marker GFAP in the rats spinal cord of each group
缝隙连接在星形胶质细胞活化中的作用最近被认识。缝隙连接是相邻细胞膜之间的连接通道,允许离子和小分子例如cAMP、IP3、ATP和小分子肽类在细胞间自由通过[11]。在生理状态下,几乎所有的星形胶质细胞都表达缝隙连接蛋白,通过缝隙连接的广泛偶联,众多的星形胶质细胞形成了一种细胞网络。有研究发现星形胶质细胞可对激活的神经元细胞做出快速电反应,具体表现为沿缝隙连接传播的Ca2+波[11]。这是否意味慢性疼痛时,兴奋的神经元周围的星型胶质细胞通过缝隙连接形成的网络,使星形胶质细胞活化扩散,从而促进了神经病理性疼痛的维持。采用缝隙连接的阻滞剂甘珀酸,既往研究探讨了缝隙连接在慢性疼痛模型时星形胶质细胞活化的作用。Spataro等[12]发现鞘内注射CBX(CCI)敏,同时还能逆转人类免疫缺陷病毒Ⅰ型 gp120(gp120)诱导产生的机械痛敏和细胞因子的释放。Seo等[13]也发现在FeCl2诱导的缺血性疼痛模型中大鼠脊髓背角GFAP的表达明显升高,而鞘内注射CBX能够明显抑制大鼠的机械痛敏。在本实验中也发现SNT大鼠术后10 d机械痛阈明显降低,损伤侧脊髓背角GFAP的表达和细胞因子TNF-α、IL-1β的水平也明显增加,而鞘内注射CBX后机械痛阈明显提高,同时GFAP的表达和细胞因子TNF-α、IL-1β的表达也降低,因此我们推测缝隙连接可能是星形胶质细胞活化的一种机制,阻断缝隙连接可抑制星形胶质细胞活化,减少促炎细胞因子TNF-α和IL-1β的释放,从而缓解了痛觉高敏。
综上所述,鞘内单次注射5 μg甘珀酸可能明显缓解SNT大鼠的机械痛觉高敏,该效应可能与甘珀酸阻断脊髓后角星形胶质细胞的缝隙连接,从而抑制了星形胶质细胞活化,减少了促炎细胞因子TNF-α和IL-1β的释放有关,本研究提示缝隙连接可能是慢性神经病理性疼痛时脊髓后角星形胶质细胞活化的一个重要通路。
[1]Nakaqawa T,Kaneko S.Spinal astrocytes as therapeutic targets for pathological pain[J].Pharmacol Sci,2010,114(4):347-53.
[2]侯永恒,杨建平,张慧娟,等.缝隙连接蛋白Cx43在炎性镜像痛大鼠脊髓背角的表达[J].中国疼痛学杂志,2009,15(5):287-91.
[2]Hou Y H,Yang J P,Zhang H J,et al.Gap junction connexion 43 expression at spinal dorsal horn in a rat model of inflammatory mirror-image pain[J].Chin J Pain Med,2009,15(5):287- 91.
[3]Hansson E.Could chronic pain and spread of pain sensation be induced and maintained by glial activation[J].Acta Physiol,2006,187(1-2):321-7.
[4]Kim S H,Chung J M.An experiental model for peripheral neuropathy produced by segment spinal nerve ligation in rat[J].Pain,1992
[5]Mata M,Hao S L,Fink D J.Applications of gene therapy to the treatment of chronic pain[J].Current Gene Therapy,2008,8(1):42-8.
[6]Abbadie C,Bhangoo S,De Koninck Y,et al.Chemokines and pain mechanisms[J].Brain Res Rev,2009,60(1):125-34.
[7]Gao Y J,Ji R R.Chemokines,neuronal-glial interactions,and central processing of neuropathic pain[J].Pharmacol Ther,2010,126(1):56-68.
[8]张艳兵,王丽娜,成 浩,等.丙戊茶碱预处理削弱大鼠关节炎痛觉过敏的脊髓机制[J].中国药理学通报,2007,23(10):1384-8.
[8]Zhang Y B,Wang L N,Cheng H,et al.Effect of mechanism of pretreating propentofylline on attenuation of arthritis thermal hyperalgesia[J].Chin Pharmacol Bull,2007,23(10):1384- 8.
[9]Obata H,Sakurazawa S,Kimura M,et al.Activation of astrocytes in the spinal cord contributes to the development of bilateral allodynia after peripheral nerve injury in rats[J].Brain Res,2010,1363(11):72-80.
[10]冯继英,杨建平,王丽娜,等.鞘内注射氟代柠檬酸对炎性痛敏大鼠的镇痛作用[J].中国药理学通报,2010,20(2):195-8.
[10]Feng J Y,Yang J P,Wang L N,et al.The antinociceptive effect of intrathecal administration of fluorocitrate in a rat model of inflammatory pain[J].Chin Pharmacol Bull,2010,20(2):195- 8.
[11]Roh D H,Yoon S Y,Seo H S,et al.Intrathecal injection of carbenoxolone,a gap junction decoupler,attenuates the induction of below-level neuropathic pain after spinal cord injury in rats[J].Exp Neurol,2010,224(1):123-32.
[12]Spataro L E,Sloane E M,Milliqan E D,et al.Spinal gap junctions:Potential involvement in pain facilitation[J].J Pain,2004,5(7):392-405.
[13]Seo H S,Kim H W,Roh D H,et al.A new rat model for thrombusinduced ischemic pain(TIIP);development of bilateral mechanical allodynia[J].Pain,2008,39(3):520-32.

