表皮生长因子受体靶向治疗在头颈部鳞癌中的研究现状
冯守昊 综述 嵇庆海 王玉龙 审校
复旦大学附属肿瘤医院头颈外科,复旦大学上海医学院肿瘤学系,上海200032
头颈部癌是人类常见的恶性肿瘤之一,其中大部分为鳞状细胞癌,每年新发病例超过50万[1]。早期的头颈部鳞癌(head neck squamous cell carcinoma, SCCHN)经过手术或者放射治疗后均可获得较好的治疗效果,但由于病变部位隐蔽,难以早期发现,故多数患者就诊时已为Ⅲ、Ⅳ期,此时单一的治疗手段已不能保证疗效,尤其是对复发和转移性患者,同步联合放化疗虽能延长生存期,但严重的不良反应也随之而来[2]。因此为了进一步提高SCCHN的诊治水平,必须探索新的治疗手段。近年来,表皮生长因子受体(epidermal growth factor receptor,EGFR)因在多种恶性肿瘤细胞中呈现高表达,又与肿瘤细胞的增殖、转移有密切关系,受到了研究者的广泛关注。本文着重论述EGFR在SCCHN靶向治疗方面的研究进展。
1 EGFR靶向治疗在恶性肿瘤中的最初应用
EGFR与肿瘤细胞的增殖、侵袭和转移关系密切,并且在全身多种肿瘤细胞中呈现过表达,其中在SCCHN、结直肠癌(colorectal cancer,CRC)和非小细胞性肺癌(non-small cell lung cancer,NSCLC)中的表达率最高。故人们设想使用可与EGFR特异性结合的药物,既能阻断EGFR对肿瘤生长的促进作用,又能靶向作用于肿瘤组织,减少全身不良反应。EGFR靶向治疗药物最早应用于转移性结直肠癌(metastatic colorectal cancer,mCRC)和NSCLC。基于多项Ⅱ、Ⅲ期临床试验结果,EGFR单克隆抗体西妥昔单抗(Cetuximab)于2004年2月被FDA批准与伊立替康联合应用于mCRC,而酪氨酸激酶抑制剂吉非替尼(Gefi tinib)则于2003年5月被FDA批准应用于铂类和紫杉醇类化疗无效的NSCLC[3]。但是不久研究者们发现这类药物的疗效却不如理论中那么完美,大部分患者对其并不敏感。吉非替尼甚至在一项随机安慰剂对照Ⅲ期临床试验中未能改善患者的生存期[4],FDA也因此在2005年限制了吉非替尼的临床应用。事实证明只有某些患者才能从靶向治疗药物中获益,而如何在治疗前识别出这些患者则成为了目前EGFR研究的热点。Karapetis等[5]分析了一项大型多中心随机临床试验的病理样本结果,提出携带突变型K-ras蛋白的患者对西妥昔单抗显著不敏感,故其可作为西妥昔单抗疗效的阴性预测标志物。这项研究结果标志着EGFR靶向治疗在经历了希望与失望后,开始进入了生化标志物指导药物应用的时代,接着将是针对每例患者的个体化治疗。
由于EGFR靶向治疗在CRC和NSCLC中的成功应用,研究者们开始把研究方向投向同样存在着EGFR高表达率的SCCHN。
2 EGFR在SCCHN中的表达
EGFR已被证实在多种上皮来源恶性肿瘤中存在过度高表达[6]。在SCCHN中的表达率达88.4%,过表达率为57%,并且与年龄、种族、肿瘤发生部位无关,而随肿瘤的临床分期上升而增高,提示EGFR可能对SCCHN预后有预测作用[7]。EGFR在癌细胞中的异常表达原因可能包括:①突变型p53及其表达失调;②EGFR基因第一内含子微卫星重复序列的多态性:其CA序列重复次数的增加伴随EGFR mRNA含量的降低;③EGFR激活后降解减少:cortactin蛋白过表达被发现可抑制配体诱导的EGFR下调过程[8-10]。
3 EGFR靶向治疗SCCHN的靶点选择
根据EGFR的结构、信号转导通路和表达特征,可能的靶点如下。
⑴阻断信号转导通路:①减少EGFR配体的表达;②靶向阻断EGFR与其配体结合;③抑制酪氨酸蛋白激酶活化;④阻断优势转导通路上主要的信号分子(如Ras-MAPK、PI-3K/Akt、STATs);⑤阻断其他酪氨酸激酶受体对EGFR的交叉激活作用(如Src、MMPs、ADAMs)。
⑵减少EGFR的表达水平:①反义寡核苷酸技术阻断mRNA翻译(基因水平);②阻断某些蛋白质分子对EGFR基因转录与翻译过程的正相关作用(如p53,分子水平);③加速EGFR降解(如cortactin蛋白)。
针对上述靶点研究较多的有单克隆抗体和酪氨酸蛋白激酶抑制剂(TKIs),目前均已进入Ⅲ期临床试验阶段。EGFR靶向治疗药物的应用情况总结见表1。
4 靶向药物治疗SCCHN的临床研究进展
4.1 单克隆抗体
西妥昔单抗是EGFR单克隆抗体中研究最多的药物,可与EGFR胞外区特异性结合,使其构象发生变化,从而阻断配体诱导的自身磷酸化作用,终止信号向胞内转导。目前多项临床试验已证实,西妥昔单抗无论单药或是与放化疗联合应用都对SCCHN有治疗作用[11-14]。2006年2月,FDA批准西妥昔单抗联合化疗治疗局部晚期不能切除的SCCHN,同年3月EMEA批准其与放疗联合治疗局部晚期SCCHN。
根治性放疗曾是进展期SCCHN的标准治疗方法。Bonner等[11]的一项样本量为424例的Ⅲ期临床试验结果表明,与单独放疗相比,西妥昔单抗联合高剂量放疗可显著提高局部进展期SCCHN的疗效。联合治疗组和单独放疗组的中位无进展生存期(median progression free survival,mPFS)分别为17.1个月和12.4个月(P=0.006),中位总生存期(median overall survival,mOS)为49个月和29.3个月(P=0.005),并且西妥昔单抗不增加放疗的不良反应。这项临床试验在使用靶向药物治疗SCCHN的探索中具有里程碑式的意义。2010年,Bonner等[12]对这项临床试验公布了5年生存率的数据,升级后的数据显示:联合治疗组和单独放疗组的5年总生存率分别为45.6%和36.4%(P=0.018)。同时还观察到一个有趣的现象,对于西妥昔单抗有G≥2皮疹反应的患者,其总生存率比G=1皮疹反应或者无皮疹的患者明显提高(HR=0.49,95%CI:0.34~0.72,P=0.002)。原因可能是有皮疹反应的患者,其体内肿瘤的EGFR表达更高,对西妥昔单抗更加敏感。在将来,皮疹反应也许可以作为一项SCCHN患者是否需要使用靶向药物的检测指标,具体的判断标准需进一步研究。
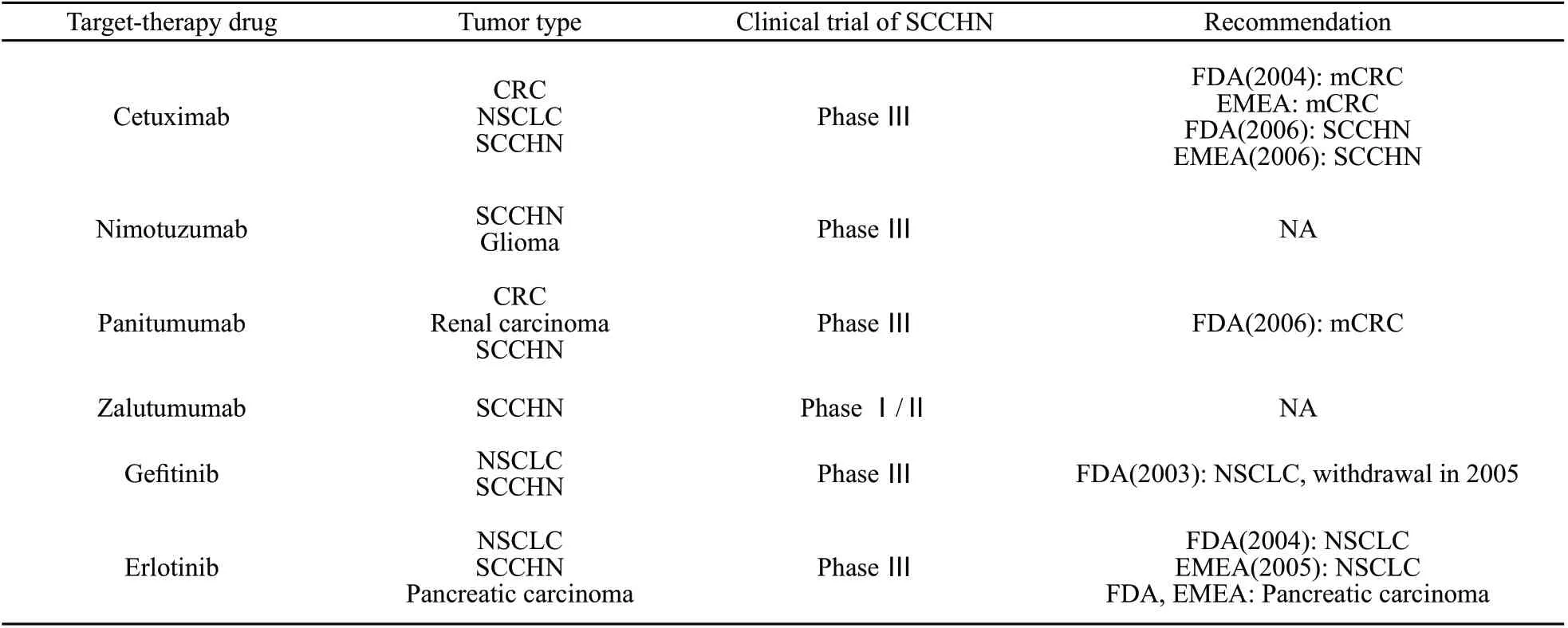
表1 EGFR靶向治疗药物的应用现状Tab.1 The application status of EGFR target-therapy drugs
对于放疗无效或不能耐受放疗,且失去手术机会的复发、转移、难治性SCCHN患者则必须求助于化疗。在单独化疗的疗效比较有限的情况下,加入西妥昔单抗可在一定程度上改善患者对化疗的敏感性,更有效地控制疾病进展。一项多中心随机双盲安慰剂对照Ⅲ期临床试验(ECOG),比较了西妥昔单抗联合化疗与单纯化疗治疗复发或转移性SCCHN的疗效。结果西妥昔单抗可提高客观缓解率(26% vs 10%,P=0.03),但mPFS分别为4.2个月 vs 2.7个月(P=0.09),mOS为9.2个月vs 8.0个月(P=0.21)[13]。另一项大样本量临床试验共入组了442例局部治疗无效的复发或转移性SCCHN患者,治疗方案为实验组:西妥昔单抗+顺铂/卡铂+5-FU,对照组:顺铂/卡铂+5-FU,结果加入西妥昔单抗将mOS从7.4个月延长至10.1个月(P=0.04),mPFS从3.3个月延长到5.6个月(P<0.001)[14],客观缓解率也从20%上升至36%(P<0.001)。需要注意的是,西妥昔单抗可能会增加败血症发生的危险:联合治疗组有9例发生了败血症,而单独化疗组只有1例发生(P=0.02)。
以上一系列研究为西妥昔单抗联合放疗或者化疗的耐受剂量、临床效果、不良反应提供了可靠的循证医学证据,但均存在一个重要的缺陷:只比较了联合治疗对单独放化疗的优势,而没有将目前进展期SCCHN的标准疗法——同步放化疗作为对照组。使得西妥昔单抗是否能真正进入一线临床仍然存疑。Pfister等[15]曾在一项Ⅱ期临床试验中试图回答这个疑问,却因为严重不良反应的发生,使研究者不得不停止研究。尽管如此,这项试验还是给出了令人鼓舞的结果。在平均进行了52个月的随访后,3年总生存率为76%,无进展3年生存率为56%,3年疾病局部控制率为71%,高于Wendt等[16]的报道。因此,研究者肯定了西妥昔单抗联合放化疗的疗效,同时也指出联合治疗的安全剂量和治疗方案仍需进一步探讨。
K a o 等[17]对联合治疗的方案进行了尝试,对3 3 例ⅣA期、ⅣB期以及高危Ⅲ期的SCCHN患者给予同期整合补量调强放疗(simultaneous integrated boost- intensity modulated radiation therapy,SIB-IMRT),同时给予5-FU(600 mg/m2),羟基脲(500 mg每天2次) 以及西妥昔单抗(250 mg/m2)。其2年的局部控制率,远处控制率,无肿瘤生存率以及总生存率分别为83%、79%、69%和86%。令人欣喜的是无严重的急慢性G≥4的不良反应发生。
因为上述严重不良反应的存在,Na等[18]选择在体外实验中研究西妥昔单抗联合顺铂和放疗对SCCHN细胞株的杀伤效果。结果证实加入西妥昔单抗后,7株癌细胞株中5株表现出协同效应,2株表现强协同效应,且疗效与西妥昔单抗的浓度呈剂量-效应关系,即联合治疗在体外对SCCHN细胞株有显著的杀伤效果。Merlano等[19]对快速交替放化疗治疗进展期头颈部肿瘤的研究在另一方面为联合治疗指出了一条可行之路,其结果表明在获得相似的3年生存率的同时,交替化疗和放疗(alternating chemotherapy and radiotherapy,ACR)的不良反应要小于同步放化疗,从而可能取代同步放化疗联合西妥昔单抗。
目前放射治疗肿瘤组(RTOG)已启动一项Ⅲ期临床试验比较同步放化疗联合西妥昔单抗与单纯同步放化疗治疗SCCHN的效果(RTOG 0522),共有895例Ⅲ、Ⅳ期SCCHN患者参与,但初步结果显示西妥昔单抗联合同步放化疗并没有使患者受益,且增加了黏膜炎和皮疹的发生率。长期的随访仍在进行中[20]。
E G F R 单克隆抗体还包括帕尼单抗(panitumumab)、尼妥珠单抗(nimotuzumab)和zalutumumab。
帕尼单抗是完全人源化的抗EGFR单克隆抗体,在一项Ⅰ期临床试验中(n=19),研究者使用帕尼单抗联合卡铂、紫杉醇和IMRT治疗局部进展期SCCHN患者,研究显示化疗的不良反应患者能够耐受,并且显示了很好的疗效:所有的患者至少都达到了部分缓解(partial response,PR),在21个月的中位随访期中,19例患者中有18例(95%)仍然保持无瘤生存[21]。一项Ⅱ期临床试验(PRISM)评估了化疗后给予帕尼单抗对转移性或复发性SCCHN患者的治疗效果(n=52),中期的安全分析提示:最常见的不良反应是皮疹、乏力、低镁血症、恶心(超过10%的患者发生)[22]。帕尼单抗治疗SCCHN的Ⅲ期临床试验,已完成的目前只有1项。顺铂+5-FU+/-帕尼单抗用于治疗复发或转移性SCCHN(n=657)。与单纯化疗相比,联合帕尼单抗并没有明显增加mOS(11.1个月 vs 9.0个月,P=0.14),但是mPFS有所延长(5.8个月 vs 4.6个月,P=0.004)[23]。更多的帕尼单抗联合放化疗治疗进展期SCCHN患者的Ⅱ、Ⅲ期试验正在进行中,其结果令人期待。
尼妥珠单抗的抗肿瘤作用在鼻咽癌、SCCHN、胶质瘤等已被广泛研究,一项药效动力学试验证实尼妥珠单抗联合放疗能被无法切除的SCCHN患者很好地耐受,且在不产生皮疹反应的情况下,10例患者中的9例达到了客观缓解[24]。 最近一项随机双盲对照试验结果表明其联合放疗对进展期SCCHN患者有效,且延长了生存期:接受尼妥珠单抗+放疗的一组患者,完全缓解率为59.5%,而接受安慰剂+放疗的一组为34.2%(P=0.038);mOS分别为12.5月vs 9.5个月(P=0.049)[25]。本院将尼妥珠单抗联合5-FU/顺铂用于可切除SCCHN患者术前或放疗前的诱导化疗,能有效地降低肿瘤分期,更有利于保存患者的器官,并且药物不良反应患者也能耐受[26]。
进展期SCCHN是Zalutumumab的主要研究方向,并在Ⅱ期临床试验中显示了良好的前景。而在一项对铂类不敏感的SCCHN患者的Ⅲ期临床研究中(n=286),接受Zalutumumab+甲氨蝶呤的实验组与只接受甲氨蝶呤的对照组相比,其PFS延长(HR=0.63,95%CI:0.47-0.84,P=0.001 2),但mOS未延长。且靶向药物导致的不良反应也增加[27]。
4.2 TKIs
TKIs可选择性与EGFR的胞内区结合并使其异构,失去原有的酪氨酸激酶活性,从而抑制肿瘤生长。在SCCHN的治疗方面,吉非替尼(Gefitinib)和厄洛替尼(Erlotinib)是目前研究较多的TKIs。
Cohen等[28-29]在2003年与2005年进行了两项Ⅱ期临床试验,分别比较了500 mg/d(n=52)和250 mg/d(n=70)吉非替尼单药治疗手术及放疗无效的复发转移性SCCHN患者的疗效,结果客观缓解率为10.6% vs 1.4%,DCR为53% vs 33%,mOS为8.1个月vs 5.5个月,两者差异有统计学意义(P<0.05)。由此推测吉非替尼对SCCHN有治疗作用,且其抗肿瘤活性为剂量-效应相关。Hainsworth等[30]用诱导化疗+吉非替尼联合同步放化疗治疗了62例进展期SCCHN患者,经过平均33个月的随访,无进展3年生存率和3年疾病控制率与不加入吉非替尼的诱导化疗联合同步放化疗相比无显著提高,且同时伴有不良反应的发生率上升。而Gregoire等[31]的结果也令人失望。他们采用250 mg/d或500 mg/d的吉非替尼联合同步放化疗治疗未转移的、不能手术切除的且之前未接受治疗的Ⅲ、Ⅳ期SCCHN患者,发现虽然大多数患者能够耐受吉非替尼,但2年局部疾病生存率没有明显差异。综合考虑治疗收益和不良反应,吉非替尼在进展期SCCHN中的应用仍存在争议,需要进一步多中心大样本的随机对照临床试验加以验证。
厄洛替尼是另一种可应用于进展期SCCHN的TKIs。Ⅰ、Ⅱ期临床试验结果表明,厄洛替尼单药应用或联合铂类化疗药物可提高疾病的控制率及延长患者生存期,不良反应可被耐受[32]。Herchenhorn等[33]的一项Ⅰ、Ⅱ期临床试验则肯定了厄洛替尼联合放化疗治疗进展期SCCHN的疗效和安全性,最常见的不良反应为恶心(27%)、呕吐(20%),为Ⅲ期临床试验建立了良好基础。Kao等[34]对厄洛替尼的最大耐受剂量方面进行了有益的探究,认为每日150 mg厄洛替尼联合塞来昔布和放疗,对于SCCHN患者是一个可行的并有临床效果的治疗方法。Gilbert等[35]采用每日150 mg厄洛替尼联合每日低剂量的放化疗,同样证实该剂量是有效的并可以被患者很好的耐受。
4.3 其他可能的靶点研究进展
4.3.1 下游信号分子
尽管下游信号转导系统通路繁多而复杂,但研究者发现某些信号分子在肿瘤细胞中呈异常活化或者高表达。因此以这些信号分子为靶点的抗肿瘤药物研究也开始展开。目前进入临床试验阶段的有:抗Ras化合物,包括SCH-66336、L-778123和R115777等,MEK抑制剂PDI84352。尚处在基础研究阶段的有:Raf抑制剂KF25706、KF58333,PKC抑制剂UCN-101等。
4.3.2 反义寡核苷酸技术
反义寡核苷酸技术是利用反义寡核苷酸在mRNA水平抑制信号分子的表达,目前主要的目标分子为STAT-3和STAT-5b。动物实验研究发现在异种皮移植模型的瘤体中,用反义寡核苷酸下调STAT-3和STAT-5b水平均可使肿瘤生长受抑制[36-37]。
5 EGFR靶向治疗的耐药机制
尽管EGFR在大多数SCCHN细胞中呈过度表达,但是临床上却发现一部分患者对EGFR靶向治疗不敏感。这种耐药现象的存在阻碍了靶向治疗药物的广泛应用,因此获得了研究者们的关注。目前认为可能的耐药机制包括:①突变型EGFR的表达:这些与EGFR结构相似的突变体与单克隆抗体的结合能力较低,且可以不依赖配体结合持续进行自体磷酸化,因此这些受体的表达水平上升往往意味着肿瘤细胞对单克隆抗体类药物的耐药性增加。研究较多的此类受体有EGFRvⅢ和T790M。这是EGFR靶向治疗获得性耐药的主要机制。②非EGFR依赖的下游信号分子激活:其主要原因为其他受体交叉激活(G蛋白偶联受体、胰岛素样生长因子受体-1、HER-2/HER-3)和基因突变导致下游信号分子组成性表达(KRAS突变、Akt分子、STAT-3/5分子),这是EGFR靶向治疗原发性耐药的主要机制。③EGFR配体的过表达:在与单克隆抗体的竞争中占据优势,虽然增加药量可能逆转这种作用,但同时带来的不良反应也将上升。④激活后EGFR降解减少:cortactin蛋白可通过影响细胞骨架的组成和解聚,下调EGFR激活后的内吞和降解。靶向治疗药物对此没有作用[8,38]。
6 EGFR靶向治疗的疗效预测与患者选择
如何用分子手段标志出对EGFR靶向治疗敏感的患者群体,目前其在CRC和NSCLC中的研究已取得了一些进展。
K-ras是目前EGFR靶向治疗CRC中最重要的分子标志,研究表明突变型K-ras携带者在CRC患者中约占42.3%,这部分患者对西妥昔单抗的敏感性很低,在最佳支持疗法中加入西妥昔单抗并不能延长此类患者的mPFS(1.8个月vs 1.8个月)和mOSR(4.5个月vs 4.6个月)[5]。故EMA不推荐在携带突变型K-ras的CRC患者中使用西妥昔单抗。而野生型K-ras患者中可能的分子标志物包括:① Ras-MAPK通路中的效应分子,如BRAF、NRAS。② PI3K–AKT 通路中的PTEN、mTOR;③EGFR配体标志物EREG和AREG等[39]。在接受TKIs治疗的NSCLC患者中突变型EGFR是主要的阳性疗效预测分子,75%突变型EGFR携带者对吉非替尼或厄洛替尼敏感。NSCLC患者的其他分子标志物包括:EGFR基因扩增、MET基因扩增和K-ras[40]。
尽管许多分子标志物在CRC和NSCLC中积累了许多研究成果,其中一些也已经为临床所常用,但并不意味着其在SCCHN中同样适用。例如突变型EGFR在NSCLC患者疗效预测中十分重要,但突变型EGFR在SCCHN患者中十分罕见,故无法作为有效的预测分子。SCCHN中可能的分子标志物如表2[38,41-43]。

表2 EGFR靶向治疗SCCHN可能的疗效预测分子Tab.2 The potential therapy-prediction molecules of EGFR target-therapy drugs for SCCHN
7 展望
尽管EGFR靶向治疗SCCHN显示出了诱人的前景,但是目前仍作为二、三线的辅助药物,在其得到广泛应用前需要解决如下问题:①特异性和有效性有待更多大规模设计严谨的临床试验证实,同时进一步降低联合治疗的不良反应。②探索新的联合用药方式。③通过检测分子标志物了解患者的耐药机制,针对性地多药联合克服肿瘤细胞的耐药性。④探索不同人群对不同靶向治疗方式的获益情况,从而建立个体化治疗体系。
[1]RICHARDO H, PATRICIA M, MANUEL H.Cetuximab in squamous cell carcinoma of the head and neck[J].Future Oncol, 2006, 2(4): 449-457.
[2]JACQUES B, CHRISTIAN D, MAHMUT O.Postoperative irradiation with or without concomitant chemotherapy for locally advanced head and neck cancer[J].N Engl J Med, 2004, 350(19): 1945-1953.
[3]FORTUNATO C, GIAMPAOLO T.EGFR antagonists in cancer treatment drug therapy[J].N Engl J Med, 2008, 358(11): 1160.
[4]THATCHER N, CHANG A, PARIKH P, et al.Gefitinib plus best supportive care in previously treated patients with refractory advanced non-small cell lung cancer: results from a randomised, placebo-controlled, multicentre study (Iressa Survival Evaluation in Lung Cancer) [J].Lancet, 2005, 366: 1527-1537.
[5]KARAPETIS C S, KHAMBATA F S, JONKER D J, et al.K-ras mutations and benefit from cetuximab in advanced colorectal cancer[J].N Engl J Med, 2008, 359: 1757-1765.
[6]薄爱华, 程琳, 李海峰, 等.表皮生长因子受体与肿瘤发生及治疗的相关性[J].医学综述, 2006, 12(20): 1238-1240.
[7]PUTTI T C, TO K F, HSU H C, et al.Expression of epidermal growth factor receptor in head and neck cancers correlates with clinical progression: a multicentre immunohistochemical study in the Asia-Pacific region[J].Histopathology, 2002, 41(2): 144-151.
[8]KALYANKRISHNA S, GRANDIS J R.Epidermal growth factor receptor biology in head and neck cancer[J].J Clin Oncol, 2006, 24(17): 2666-2672.
[9]ETIENNE-GRIMALDI M C, PEREIRA S, MAGNE N.Analysis of the dinucleotide repeat polymorphism in the epidermal growth factor receptor (EGFR) gene in head and neck cancer patients[J].Ann Oncol, 2005, 16: 934-941.
[10]TIMPSON P, LYNCH D K, SCHRAMEK D, et al.Cortactin overexpression inhibits ligand-induced down-regulation of the epidermal growth factor receptor[J].Cancer Res, 2005, 65: 3273-3280.
[11]BONNER J A, M HARARI P M, GIRALT J, et al.Radiotherapy plus cetuximab for squamous-cell carcinoma of the head and neck[J].N Engl J Med, 2006, 354(6): 567-579.
[12]BONNER J A, HARARI P M, GIRALT J, et al.Radiotherapy plus cetuximab for locoregionally advanced head and neck cancer: 5-year survival data from a phase 3 randomised trial, and relation between cetuximab-induced rash and survival[J].Lancet Oncol, 2010, 11(1): 21-28.
[13]BURTNESS B, GOLDWASSER M A, FLOOD W, et al.Phase Ⅲ randomized trial of cisplatin plus placebo compared with cisplatin plus cetuximab in metastatic/recurrent head and neck cancer: an Eastern Cooperative Oncology Group Study[J].J Clin Oncol, 2005, 23: 8646-8654.
[14]VERMORKEN J B, MESIA R, RIVERA F, et al.Platinumbased chemotherapy plus cetuximab in head and neck cancer[J].N Engl J Med, 2008, 359(11): 1116-1127.
[15]PFISTER D G, SU Y B, KRAUS D H, et al.Concurrent cetuximab, cisplatin, and concomitant boost radiotherapy for locoregionally advanced, squamous cell head and neck cancer: a pilot phase Ⅱ study of a new combined-modality paradigm[J].J Clin Oncol, 2006, 24: 1072-1078.
[16]WENDT T G, GRABENBAUER G G, RODEL C M, et al.Simultaneous radiochemotherapy versus radiotherapy alone in advanced head and neck cancer: a randomized multicenter study[J].J Clin Oncol, 1998, 16(4): 1318-1324.
[17]KAO J, GENDEN E M, GUPTA V I, et al.Phase 2 trial of concurrent 5-fluorouracil, hydroxyurea, cetuximab, and hyperfractionated intensity-modulated radiation therapy for locally advanced head and neck cancer[J].Cancer, 2011, 117(2): 318-326.
[18]NA Z, KAISA E, JARMO K, et al.Concurrent cetuximab, cisplatin, and radiation for squamous cell carcinoma of the head and neck in vitro[J].Radiother Oncol, 2009, 92(3): 388-392.
[19]MERLANO M.Alternating chemotherapy and radiotherapy in locally advanced head and neck cancer: an alternative? [J].Oncologist, 2006, 11(2): 146-151.
[20]ANG K K, ZHANG Q, ROSENTHAL D, et al.Initial results of RTOG clinical trial show no survival benefits by the addition of cetuximab to chemoradiation treatment for patients with locally advanced head and neck cancer [J].J Clin Oncol, 2011, 29 (suppl; abstr 5500).
[21]Wirth L J, ALLEN A M, POSNER M R, et al.Phase Ⅰ dosefinding study of paclitaxel with panitumumab, carboplatin and intensity-modulated radiotherapy in patients with locally advanced squamous cell cancer of the head and neck [J].Ann Oncol, 2010, 21: 342-347.
[22]RISCHIN D, SPIGEL D R, ADKINS D, et al.Panitumumab (pmab) regimen in second-line monotherapy (PRISM) in patients (pts) with recurrent (R) or metastatic (M) squamous cell carcinoma of the head and neck (SCCHN): interim safety analysis[J].Ann Oncol, 2010, 21: 323.
[23]VERMORKEN J B, STOHLMACHER J, DAVIDENKO I, et al.Primary efficacy and safety results of SPECTRUM, a phase 3 trial in patients (pts) with recurrent and/or metastatic (R/M) squamous cell carcinoma of the head and neck (SCCHN) receiving chemotherapy with or without panitumumab (pmab) [J].Ann Oncol, 2010, 21:viii12.Abstract LBA26.
[24]ROJO F, GRACIAS E, VILLENA N, et al.Pharmacodynamic trial of nimotuzumab in unresectable squamous cell carcinoma of the head and neck: A SENDO Foundation Study [J].Clin Cancer Res, 2010, 16(8): 2474-2482.
[25]RODRÍGUEZ M O, RIVERO T C, DEL-CASTILLO B R, et al.Nimotuzumab plus radiotherapy for unresectable squamous-cell carcinoma of the head and neck[J].Cancer Biol Ther, 2010, 9(5): 343-349.
[26]赵晓莹, 郭晔, 朱永学, 等.尼妥珠单抗联合顺铂和氟尿嘧啶方案诱导化疗治疗可切除的头颈部鳞癌初步临床分析 [J].中华耳鼻咽喉头颈外科杂志, 2012, 47(7): 536-539.
[27]MACHIELS J P, SUBRAMANIAN S,RUZSA A, et al.Zalutumumab plus best supportive care versus best supportive care alone in patients with recurrent or metastatic squamouscell carcinoma of the head and neck after failure of platinumbased chemotherapy: an open-label, randomised phase 3 trial[J].Lancet Oncol, 2011, 12(4): 333-343.
[28]COHEN E E W, ROSEN F, STADLER W M, et al.Phase Ⅱ trial of ZD1839 in recurrent or metastatic squamous cell carcinoma of the head and neck[J].J Clin Oncol, 2003, 21: 1980-1987.
[29]COHEN E E W, KANE M A, LIST M A, et al.Phase Ⅱ trial of gefitinib 250 mg daily in patients with recurrent and/or metastatic squamous cell carcinoma of the head and neck[J].Clin Cancer Res, 2005, 11(23): 8418-8424.
[30]HAINSWORTH J D, SPIGEL D R, A BURRIS H A, et al.Neoadjuvant chemotherapy/gefitinib followed by concurrent chemotherapy/radiation therapy/gefitinib for patients with locally advanced squamous carcinoma of the head and neck[J].Cancer, 2009, 115(10): 2138-2146.
[31]GREGOIRE V,HAMOIR M,CHEN C H.Gefitinib plus cisplatin and radiotherapy in previously untreated head and neck squamous cell carcinoma: A phase Ⅱ, randomized, double-blind, placebo-controlled study[J].Radiother Oncol, 2011, 100(1): 62-69.
[32]SIU L L, SOULIERES D, CHEN E X, et al.Phase Ⅰ/Ⅱ trial of erlotinib and cisplatin in patients with recurrent or metastatic squamous cell carcinoma of the head and neck: a princess margaret hospital phase Ⅱ consortium and national cancer institute of canada clinical trials group study[J].J Clin Oncol, 2007, 25: 2178-2183.
[33]HERCHENHORN D, DIAS F L, VIEGAS C M, et al.Phase Ⅰ/Ⅱ study of erlotinib combined with cisplatin and radiotherapy in patients with locally advanced squamous cell carcinoma of the head and neck[J].Int J Radiat Oncol Biol Phys, 2010, 78(3): 696-702.
[34]KAO J, GENDEN E M, CHEN C T, et al.Phase 1 trial of concurrent erlotinib, celecoxib, and reirradiation for recurrent head and neck cancer[J].Cancer, 2011, 117(14), 3173-3181.
[35]GILBERT J, RUDEK M A, HIGGINS M J, et al.A phase Ⅰ trial of erlotinib and concurrent chemoradiotherapy for stage Ⅲ and Ⅳ (M0) squamous cell carcinoma of the head and neck[J].Clin Cancer Res, 2012, 18(6): 1735-1742.
[36]GRANDIS J R, DRENNING S D, ZENG Q, et al.Constitutive activation of Stat3 signaling abrogates apoptosis in squamous cell carcinogenesis in vivo[J].Proc Natl Acad Sci USA, 2000, 97(8): 4227-4232.
[37]XI S C, ZHANG Q, GOODING W E, et al.Constitutive activation of Stat5b contributes to carcinogenesis in vivo[J].Cancer Res, 2003, 63(20): 6763-6771.
[38]COOPER J B, COHEN E E W.Mechanisms of resistance to EGFR inhibitors in head and neck cancer[J].Head Neck, 2009, 31(8): 1086-1094.
[39]SHANKRAN V, OBEL J, BENSON A B 3RD.Predicting response to EGFR inhibitors in metastatic colorectal cancer: current practice and future directions[J].Oncologist, 2010, 15: 157-167.
[40]ZHANG X Z, CHANG A.Molecular predictors of Egfr-tki sensitivity in advanced non-small cell lung cancer[J].Int J Med Sci, 2008, 5: 209-217.
[41]EGLOFF A M, GRANDIS F R.Improving response rates to EGFR-targeted therapies for head and neck squamous cell carcinoma: candidate predictive biomarkers and combination treatment with Src inhibitors[J].J Oncol, 2009: 896407.
[42]TIMPSON P, WILSON A S, LEHRBACH G M.Aberrant expression of cortactin in head and neck squamous cell carcinoma cells is associated with enhanced cell proliferation and resistance to the epidermal growth factor receptor inhibitor gefitinib[J].Cancer Res, 2007, 67(19): 9304-9314.
[43]SOK J C, COPPELLI F M, THOMAS S M.Mutant epidermal growth factor receptor (EGFRvⅢ) contributes to head and neck cancer growth and resistance to EGFR targeting[J].Clin Cancer Res, 2006, 12(17): 5064-5073.

