分子分型时代的肺癌治疗个体化趋势
陈海泉
复旦大学附属肿瘤医院胸外科,复旦大学肺癌防治中心,复旦大学上海艺学院肿瘤学系,上海 200032
肺癌是世界范围内病死率第一位的恶性肿瘤。根据《2010中国卫生统计年鉴》,我国2009年肺癌死亡率为30.83/10万人,高居所有恶性肿瘤之首。肺癌可以分为非小细胞肺癌和小细胞肺癌,其中非小细胞肺癌占所有肺癌的80%。非小细胞肺癌又可以分为腺癌、鳞癌和大细胞癌。近年来肺腺癌在非小细胞肺癌中所占的比例不断上升,已成为最常见的肺癌亚型。特别是在不吸烟的肺癌患者中,肺腺癌的比例高达70%,因为早期难以发现,且晚期治疗预后极差,给社会带来了极大的负担。
包括腺癌在内,肺癌是一系列由多种不同分子遗传学机制异常造成细胞分化、周期调控、衰老及凋亡等多种生物学行为失调,最终导致癌变的疾病的总和。“解码”肺癌,特别是肺腺癌的发病机制,从分子遗传和分子生物学层面对肿瘤自然病程的发生、发展机理进行探索是研究肺癌的基础,也是肺癌领域科研的前沿。由于肺腺癌分子生物学机制的复杂多样,以寻找“生物标志”为主要手段的一类转化型研究日益凸显出巨大的价值。该类研究通过在核酸、蛋白及微环境因子等多层面寻找肿瘤相关特异的生物标志,对具有不同易感因素、致病机制和治疗敏感性的人群加以区别,从而实现高危筛查、早期诊断、个体化治疗和预后判断等。因此该领域的转化型研究在肿瘤生物学、临床肿瘤学、公共卫生及卫生经济学方面都具有重要的科学、社会和经济价值。
癌症目前被认为是一个多基因累积突变的多步骤过程,基因突变是肿瘤产生、发展的根本原动力。基因突变包括驱动突变(driver mutation)和伴随突变(passenger mutation);驱动突变间相互排斥,即一种突变即可导致肿瘤的发生,成为了遗传水平的“肿瘤生物标志”最佳选择。目前根据已知的驱动突变的研究已经可以明确50%肺腺癌患者的突变类型、建立组织学类型下的分子亚型;并且已经直接对临床医学贡献出了巨大的社会和经济价值(一系列极具前景的靶向药物已经FDA批准上市,如对应EGFR突变的靶向药物厄罗替尼、吉非替尼和对应EML4-ALK融合基因的crizotinib等);基因突变的分析为药品研发、个体化治疗展开了广阔的蓝图。通过“分子诊断”,还可以将同一种病理类型的肺癌进一步划分为多种“分子亚型”,并通过选择相应的“分子靶向药物”使患者得到更加个体化的治疗。
复旦大学附属肿瘤医院展开了基于中国人群肺腺癌已知突变的广泛研究,通过收集 超过肿瘤组织和配对正常肺组织,经过核酸抽提、聚合酶链反应(polymerase chain reaction,PCR)直接测序、荧光原位杂交(FISH)、免疫组化、基因芯片和生物信息学分析等技术和手段对包括EGFR、KRAS、EML4-ALK、ER2/ERBB2等在内的已知突变进行综合分析,揭示了以中国人为代表的东亚肺腺癌人群,特别是不吸烟女性人群的基因突变规律,并进一步提示了突变基因作为“生物标志”在肿瘤诊断、分期以及个体化治疗等方面的直接或潜在价值。
1 肺癌分子分型研究进展
1.1 中国人群肺腺癌EGFR突变的分析
一般认为,肺腺癌表皮生长因子受体(epithelial growth factor receptor,EGFR)突变东方人群高于西方、非吸烟者高于吸烟者。有研究证实EGFR突变与戒烟时间、肿瘤分期和组织学类型等相关[1]。但对于东、西方人群间非吸烟腺癌患者EGFR突变情况的比较尚无定论,特别是非吸烟的男性和女性患者间EGFR突变是否存在差异一直缺乏有力结论。复旦大学附属肿瘤医院对224例中国肺腺癌患者(男性114例,女性110例)进行了EGFR突变的检测,通过总体和亚组分析发现:中国人肺腺癌样本中EGFR突变的特征与欧美人报道的有差异,我国肺腺癌患者中不吸烟患者发生EGFR突变的比例高,并且性别差异无统计学意义(P>0.05)[2]。进一步研究显示:中国女性不吸烟肺腺癌患者的突变类型与年龄及腺癌病理亚型相关(图1)[3]。
1.2 中国非吸烟人群肺腺癌已知突变的分析
在肺腺癌患者中,不吸烟的患者占有很大的比重。既往基础和IPASS等临床研究表明不吸烟患者的肺腺癌是一类具有特殊分子病理学特点的疾病,特别是东亚不吸烟女性对于靶向治疗具有较好的反应,因此东亚不吸烟肺腺癌人群的突变水平是世界关注的焦点。因此,复旦大学附属肿瘤医院通过分析52例中国不吸烟肺腺癌中的常见致癌基因突变结果,提出中国不吸烟肺腺癌患者大部分都具有已知驱动突变,并且目前多数突变位点都有相应的靶向药物治疗,这为癌症的“个体化治疗”奠定了理论依据(图2)[4]。
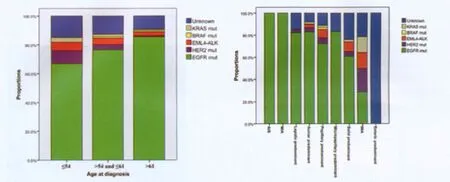
图1 中国 女性不吸烟肺腺癌患者的突变类型与年龄及腺癌病理亚型的相关性分析
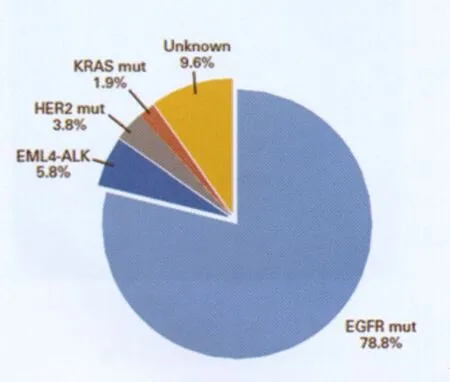
图2 中国不 吸烟肺腺癌患者突变分析
1.3 非小细胞肺癌新的分子亚型—RET融合基因
复旦大学附属肿瘤医院准确描述并定义了非小细胞肺癌中一项新的分子亚型—RET融合基因及其独特的临床病理特征,同时提出了一种高效、准确的RET融合基因检测方法[5],解决了国际上RET融合基因检测的难题。
复旦大学附属肿瘤医院对936例非小细胞肺癌进行了包括EGFR、KRAS、BRAF、HER-2、ALK和RET在内的全面的分子诊断和分型分析,发现RET融合基因存在于1.4%的非小细胞肺癌患者,并且这些患者表现出不吸烟者多见、低分化为主等一系列独特的临床和病理学特征;此外RET融合基因与其他已知的非小细胞肺癌分子亚型相互独立、不重叠,进而可以将RET融合基因定义为非小细胞肺癌中的一项新的分子亚型。
该研究提出一种高效、准确、低廉的RET融合基因检测方法:基于表达不平衡的RET融合基因检测法。目前国际上已有数种多靶点分子靶向药物可为具有RET融合基因的患者提供个体化治疗。该研究对RET融合基因患者临床病理特征的准确描述以及高效RET融合基因分子检测方法的发明,将为这些药物的后期临床试验的实现发挥价值。非小细胞肺癌中RET融合基因的发现令人兴奋,不但增添我们对这种恶性肿瘤背后机制的深入了解,还将可能为这一类型患者提供有效的治疗手段。这些分子检测方法的进步,将使得对患者的诊断更加便捷。
1.4 ALK融合基因检测新技术
作为肺癌分子亚型的一种,ALK融合基因存在于3%~7%的非小细胞肺癌中,以ALK融合基因为靶点的分子靶向药物Crizotinib显著提高了携带有该融合基因的肺癌患者的生存,并在2011年被美国FDA批准用于一线治疗ALK融合基因阳性的晚期非小细胞肺癌患者。目前ALK融合基因检测的主要方法包括荧光原位杂交(FISH),以及免疫组化和逆转录-聚合酶链技术(RT-PCR)等。FISH被认为是“金标准”,但其技术复杂,整个过程至少需要2 d,检测效率低下,并且价格不菲(约1500美元/例)。免疫组化方法敏感性较高但特异性过低,RT-PCR方法特异性较高但敏感性过低,因而都未能在临床中大规模应用。
复旦大学附属肿瘤医院对ALK融合基因的检测研究发现:ALK基因发生断裂后激酶域表达显著增高,而非激酶域不表达或低表达。进而发展出了“基于qPCR的ALK融合基因检测”的新技术,即采用实时定量PCR(qPCR)的方法检测断裂点前后ALK 基因的表达水平,通过其水平差异实现ALK融合基因快速准确的诊断。在一项对654例非小细胞肺癌标本的分析中,使用该检测手段检测发现40例ALK融合基因阳性标本,经过“金标准”—FISH验证,该技术的敏感性、特异性均达到100%(图3),显著优于免疫组化、RT-PCR等其他技术[6]。除此之外,该技术还具有高通量、低成本等其他技术难以比拟的优势:利用该技术在90 min内即可实现对48例样本的检测,而每例样本的检测成本不超过30元。
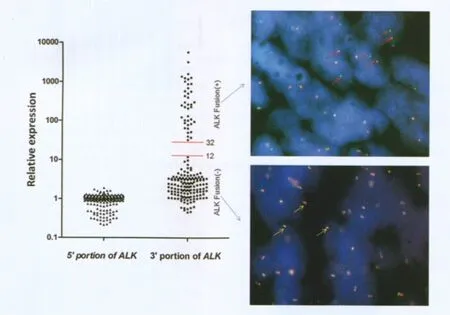
图3 基于qPCR的ALK融合基因检测与FISH结果完全吻合
在临床的实际应用中,该技术可以低价、快速地得到ALK融合基因初步检测结果,不但可以节省检测费用,更为“惜时如金”的晚期患者诊疗赢得更多时间;同时,该技术所需的仪器设备极为普通、简单,因此很易于在各级医疗科研单位中进行普及推广;此外,该技术高通量的特点为大规模临床试验的患者筛选、分子流行病调查提供了极其便利的手段。
该研究被授予阿尔弗雷德·索弗研究奖(Alfred Soffer Research Award);2012年9月1日,国际著名肿瘤学期刊《Cancer Research》将该研究誉为“突破性进展(breaking advances)”,并专门刊文进行报道。
1.5 肺腺癌EGFR突变与EGFR基因扩增的关联
一直以来EGFR TKI靶向药物的选择依据除EGFR突变外还包括EGFR基因扩增和免疫组化EGFR阳性。复旦大学附属肿瘤医院还对我国肺腺癌患者中EGFR突变阳性者的EGFR拷贝数变化进行了研究。通过FISH或者基因芯片SNP6.0检测肺腺癌中EGFR的拷贝数,发现EGFR的拷贝数明显与EGFR突变相关[7]。
1.6 肺腺癌HER-2突变与HER-2/EGFR基因扩增的关联
EGFR即HER-1,与HER-2同为驱动突变,并且在肺癌和乳腺癌中均有相应的靶向治疗药物对应;女性乳腺癌中HER-2阳性较多,而肺腺癌中EGFR阳性相对较多。作为肺腺癌的一个较少的突变亚型,复旦大学附属肿瘤医院在HER-2突变肺腺癌患者中分析了其突变与HER-2及EGFR基因扩增间的关联,发现HER-2阳性的肺腺癌伴有明显的HER-2或EGFR基因拷贝数增长,显示两者在发病机制间的关联,提示未来对于肺腺癌HER-2阳性的患者进行联合靶向治疗的可能[8]。
1.7 其他肺腺癌驱动突变的研究
有研究证明LKB1通过细胞外基质重塑等机制抑制肺癌进展[9],复旦大学附属肿瘤医院又进一步分析了肺腺癌中LKB1、EGFR和KRAS基因突变的特征,在国际上首次报道了中国人肺癌的LKB1突变分析结果[10]。ROS1融合基因的国际合作研究结果在世界范围内首次证实ROS1融合基因是肺癌中一项独立的突变亚型[11]。
上述研究在遗传分子水平进一步揭示了肺癌的发病机制,展示了东亚人群特别是不吸烟人群肺腺癌的分子遗传学轮廓,为针对这一大类患者的临床研究提供了理论依据,为临床靶向治疗提供选择依据,为寻找新的治疗靶点和新的靶向药物提供方向。
2 非小细胞肺癌患者淋巴结转移的预测
非小细胞肺癌患者淋巴结转移的状况是明确患者分期的重要关键点,对于患者个体化治疗方案的选择及预后判断具有重要意义。
CT上未显示淋巴结肿大的T1期非小细胞肺癌由于N2淋巴结累及的概率相对较低,是否常规使用纵隔镜或者PET检查尚存在争议。复旦大学附属肿瘤医院回顾性分析了530例CT诊断为T1N0的非小细胞肺癌患者接受手术切除与系统性淋巴结清扫的情况,使用单因素分析和多因素logistic回归来评估临床病理资料与N2淋巴结转移的联系。结果显示N2淋巴结累及率为16.8%。通过logistic回归发现了4个独立预测N2疾病的因素:较年轻的年龄(OR=0.974,95%CI,0.952~0.997)、较大的肿瘤直径(OR=2.769,95%CI:1.818~4.217)、中央型肿瘤(OR=3.204,95%CI:1.512~6.790)以及侵袭性腺癌的组织学类型(OR=3.537,95%CI:1.740~7.191)。这一预测模型具有较好的吻合度(Hosmer-Lemeshow检验:P=0.784)、较好的鉴别度(ROC曲线下面积为0.726,95%CI:0.669~0.784)以及经Bootstrapping检验证实的较低的“过拟合”。这一预测模型有助于预测纵隔淋巴结转移情况,进而协助临床决策[12]。
近年来,国内外许多 研究都致力于在原发灶直径较小的肺癌中找到可靠的预测淋巴结N0的因素,以明确系统性淋巴结清扫的必要性。对原发灶直径≤1 cm的患者是否需行系统性淋巴结清扫尚存在较大争议。
复旦大学附属肿瘤医院回顾性分析了243例周边型小肿块(直径≤2 cm)非小细胞肺癌病例中淋巴结转移相关的因素[13]。这些小肿块的直径都在新鲜标本中测量(在4%的甲醛溶液固定之前)。腺癌的亚型根据2011年版的IASLC/ATS/ERS腺癌分类方法进行归类。结果显示N1和N2淋巴结累及率分别为5.3%和6.6%。在直径≤1 cm的肿块中也发现有N2淋巴结累及(2/53,3.8%)。在鳞癌、腺癌中的原位腺癌、微侵润腺癌、贴壁亚型以及侵袭性粘液腺癌中未见淋巴结累及。以上5种组织类型占所有周围型小直径非小细胞肺癌的34.6%。因而通过组织学分型,在超过1/3的周围型小直径非小细胞肺癌中可不进行系统性淋巴结清扫。
3 展望
目前转化研究主要针对肺腺癌患者开展,检测范畴也仅限于目前世界上所发现的已知驱动突变。而肺腺癌总体仍有50%无法确定其驱动突变,限制了这部分患者接受个体化诊治的可能。此外与肺腺癌相比,肺鳞癌的个体化治疗更加是一片较难开垦的处女地,也潜藏着巨大机遇。进一步的研究将聚焦未见已知突变(pan-negative)的肺癌,探索其发病机制,提供分子生物学标志,为患者诊断与个体化治疗提供依据将成为研究热点。此外,随着“全基因组时代”的逐渐到来,通过高通量全基因组(外显子)测序技术探索未知的突变并进行功能的鉴定,将可能极大地推进肺癌基础研究领域的进步,使肺癌的个体化治疗更上一个台阶。
[1] GIRARD N, SIMA C S, JACKMAN D M, et al.Nomogram to predict the presence of EGFR activating mutation in lung adenocarcinoma[J].Eur Respir J, 2012, 39: 366-372.
[2] SUN Y H, FANG R, GAO B, et al.Comparable rate of EGFR kinase domain mutation in lung adenocarcinomas from Chinese male and female never-smokers[J].Acta Pharmacol Sin,2010, 31: 647-648.
[3] ZHANG Y, SUN Y, PAN Y, et al.Frequency of driver mutations in lung adenocarcinoma from female never-smokers varies with histologic subtypes and age at diagnosis[J].Clin Cancer Res, 2012, 18: 1947-1953.
[4] SUN Y, REN Y, FANG Z, et al.Lung adenocarcinoma from East Asian never-smokers is a disease largely defined by targetable oncogenic mutant kinases[J].J Clin Oncol,2010, 28: 4616-4620.
[5] WANG R, HU H, PAN Y, et al.RET fusions define a unique molecular and clinicopathologic subtype of non-small-cell lung cancer[J].J Clin Oncol, 2012, 30: 4352-4359.
[6] WANG R, PAN Y, LI C, et al.The use of quantitative realtime reverse transcriptase PCR for 5’ and 3’ portions of ALK transcripts to detect ALK rearrangements in lung cancers[J].Clin Cancer Res, 2012, 18: 4725-4732.
[7] LI C, SUN Y, FANG Z, et al.Comprehensive analysis of epidermal growth factor receptor gene status in lung adenocarcinoma[J].J Thorac Oncol, 2011, 6, 1016-1021.
[8] LI C, SUN Y, FANG R, et al.lung adenocarcinomas with HER2-activating mutations are associated with distinct clinical features and HER2/EGFR copy number gains[J].J Thorac Oncol, 2012, 7: 85-89.
[9] GAO Y, XIAO Q, MA H, et al.Lkb1 inhibits lung cancer progression through lysyl oxidase and extracellular matrix remodeling[J].Proc Natl Acad Sci U S A, 2010, 107:18892-18897.
[10] GAO B, SUN Y, ZHANG J, et al.Spectrum of LKB1, EGFR,AND KRAS mutations in chinese lung adenocarcinomas[J].J Thorac Oncol, 2010, 5: 1130-1135.
[11] BERGETHON K, SHAW A T, OU S H, et al.Ros1 rearrangements define a unique molecular class of lung cancer[J].J Clin Oncol, 2012, 30: 863-870.
[12] ZHANG Y, SUN Y, SHEN L, et al.Predictive factors of lymph node status in small peripheral non-small cell lung cancers:tumor histology is more reliable[J].Ann Surg Oncol, 2012.[Epub ahead of print].
[13] ZHANG Y, SUN Y, XIANG J, et al.A prediction model for N2 disease in T1 non-small cell lung cancer[J].J Thorac Cardiovasc Surg.2012,144:1360-1364.

