芒果苷及其磷脂复合物大鼠在体肠吸收对比研究*
张伟玲,王亚静,田 慧,轩肖玉,高 旭,于 悦
(天津中医药大学,天津市现代中药重点实验室-省部共建国家重点实验室培育,天津 300193)
芒果苷(MGF),又名芒果素、知母宁,为漆树科植物芒果叶的主要活性成分,具有广泛的药理活性,如抗肿瘤、抗病毒、抗辐射、抗糖尿病等作用[1]。但由于MGF脂水均难溶,导致口服吸收差,生物利用度低,限制了其疗效的发挥和临床应用[2]。将药物制成磷脂复合物可提高药物的亲脂性,促进药物透过生物膜,改善药物在胃肠道内的吸收[3-6]。因此,本课题组前期制备了芒果苷磷脂复合物(MPC)[7],用以提高芒果苷的脂溶性。笔者进一步考察了其在体大鼠肠吸收的情况,与芒果苷进行了比较,以期为芒果苷新制剂的开发提供一定的生物药剂学依据。
1 仪器与材料
1200 型高效液相色谱仪(美国安捷伦公司);BT100-1F型恒流泵(保定兰格恒流泵有限公司);DKB-501A型超级恒温水槽(上海精宏实验设备有限公司)。
芒果苷(MGF)对照品(天津中新药业,批号:110505-11纯度>98%);MGF原料(天津中新药业,批号:100523,含量 90%);MPC(自制,批号:111119,理论含量31.25%);甲醇和乙腈均为色谱纯,其余试剂均为分析纯。
雄性SD大鼠,体质量180~200 g。由北京华阜康生物科技股份有限公司提供[许可证号:SCXK(京)2009-0004]。
2 方法与结果
2.1 灌流液中芒果苷的高效液相色谱(HPLC)测定方法的建立
2.1.1 色谱条件 色谱柱:C18柱(VenusilMP-200mm×4.6 mm,5 μm);流动相:乙腈:0.1%甲酸(16∶84);柱温:35 ℃;流速:1.0 mL/min;检测波长:260 nm;进样量:20 μL。
2.1.2 方法专属性 取K-R试液进行肠灌流,收集6 h的空白肠灌流液,以此肠灌流液配制芒果苷对照品溶液,经HPLC法测定,在此条件下空白肠灌流液不干扰芒果苷的测定,药物的保留时间为8.582 min。
2.1.3 标准曲线的绘制 精密称取MGF对照品10 mg,置100 mL量瓶中,加甲醇适量,超声使其溶解,用甲醇稀释至刻度,摇匀。分别精密量取该溶液0.25、0.5、1.0、2.0、4.0、8.0 mL 于 100 mL 量瓶中,加K-R试液稀释至刻度,摇匀,进样,以峰面积对浓度进行线性回归,回归方程为A=83542×C-11937,r=0.9998,线性范围为 0.25~8 μg/mL。
2.1.4 精密度与回收率 取标准曲线绘制项下的对照品溶液,浓度1 μg/mL,重复测定5次,计算峰面积的RSD为1.95%。精密称取芒果苷对照品0.5、2、4 mg,各3份,分别置100 mL量瓶中,按摩尔比1∶1加入磷脂,加K-R试液适量,超声30 min使其溶解,用K-R试液稀释至刻度,摇匀。各精密量取1 mL,分别置10 mL量瓶中,用K-R试液稀释至刻度,摇匀,滤过,进样。根据标准曲线方程计算浓度C,求得回收率。测得低、中、高3个浓度的回收率分别为 99.15%、96.84%、98.91%(n=3)。结果表明精密度和回收率均符合方法学测定的要求。
2.1.5 稳定性 取标准曲线绘制项下的对照品溶液,浓度 2 μg/mL,置 37 ℃水浴中,分别于 0、1、2、4、6 h取样,进样,测定芒果苷的含量。MPC在灌流液中6 h内的RSD为1.81%,表明MPC在灌流液中6 h内稳定性良好。
2.2 大鼠肠灌流实验
2.2.1 溶液的配制
1)MGF灌流液:取MGF,用pH6.8的K-R缓释液配制成的含MGF为3 μg/mL的溶液。
2)MPC灌流液:取MPC,用pH6.8的K-R缓释液配制成的含MGF为3 μg/mL的溶液。
3)K-R 试液(pH=6.8):含氯化钠 7.8 g/L、氯化钾0.35 g/L、无水氯化钙0.37 g/L、磷酸二氢钠0.32 g/L、氯化镁0.02 g/L、碳酸氢钠1.37 g/L、葡萄糖1.48 g/L。
2.2.2 实验方法 取SD大鼠,禁食12 h,可自由饮水,腹腔注射20%乌拉坦麻醉(剂量1.0 g/kg),固定并维持体温。沿腹中线打开腹腔,约4 cm,分离十二指肠、空肠、回肠、结肠各肠段。各肠段区间如下:十二指肠段为自幽门下1 cm处开始;空肠段为自幽门15 cm处开始;回肠段为自盲肠上行20 cm处开始;结肠段为紧邻盲肠至直肠,各段均取10~15 cm。每段于两端切口,用预热至37℃的生理盐水将肠内容物冲洗干净,插管后结扎。伤口处用浸有生理盐水的脱脂棉覆盖保湿,红外灯下保温。进口处用已知质量的装有供试液的小瓶以0.2 mL/min的流速进行灌流,出液口处用另一已知质量的小瓶收集,持续105 min,每隔15 min迅速更换一次供试液小瓶和收集液小瓶,称质量,以计算进出口灌流液的质量,同时HPLC法测定药物的浓度。实验结束后,处死大鼠,剪下被考察的肠段,测量长度(l)和内半径(r)。计算并比较MGF和MPC各吸收部位下的药物吸收速率常数(Ka)和表观吸收系数(Papp)值,取 5 组数据的平均值进行比较。并采用SPSS 18.5软件对数据进行单因素方差分析(one-way ANOVA)。结果见表1和表2。
计算公式:

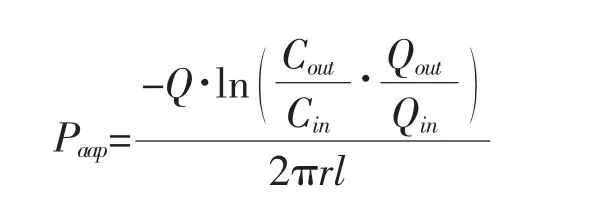
式中:Qin和Qout分别为灌入和收集的供试液体积(假定供试液密度为1.0 g/mL,根据测得质量计算体积);Q为灌流速度;Cin和Cout分别为进口和出口处供试液中的药物浓度。l和r分别为被灌流肠段的长度(cm)和横截面半径(cm);Q为灌流速度(0.2 mL/min),t为灌流时间(0.25 h);V 为灌流肠段的体积。Ka和 Papp为中间 4~5 个时间段(45~105 min)样品的平均值。
表1 MGF和MPC在不同吸收部位的吸收速率常数Ka(±s,n=5)Tab.1 Effect of different regions of intestinal on Kaof MGF and MPC(±s,n=5)

表1 MGF和MPC在不同吸收部位的吸收速率常数Ka(±s,n=5)Tab.1 Effect of different regions of intestinal on Kaof MGF and MPC(±s,n=5)
注:与 MGF 相比,*P<0.1;与 MGF 相比,**P<0.01。
肠段Ka(×10-2/min)MPC MGF十二指肠 4.45±0.76* 3.40±1.19空肠 6.85±2.10** 4.15±0.99回肠 3.41±0.61* 2.33±0.51结肠 4.36±0.583.95±1.31
表2 MGF和MPC在不同吸收部位的表观吸收系数Pap(p±s,n=5)Tab.2 Effect of different regions of intestine on Pappof MGF and MPC(±s,n=5)

表2 MGF和MPC在不同吸收部位的表观吸收系数Pap(p±s,n=5)Tab.2 Effect of different regions of intestine on Pappof MGF and MPC(±s,n=5)
注:与 MGF 相比,**P<0.01。
肠段Papp(×10-3cm/min)MPC MGF十二指肠 4.86±0.584.27±1.57空肠 9.14±2.47** 4.84±1.37回肠 4.39±1.043.60±1.35结肠 5.30±1.484.79±0.62
由表1和表2可知,MPC各吸收部位的Ka和Papp值与MGF相比,均有不同程度的提高,说明磷脂复合物对芒果苷的肠吸收具有改善作用。经方差分析,MPC在十二指肠和回肠的Ka值与MGF相比均有所提高(P<0.1)。MPC 在空肠段的 Ka和 Papp值较 MGF 均提高显著(P<0.01),Ka和 Papp值分别增加了1.65和1.89倍,说明磷脂复合物对芒果苷的肠吸收改善部位主要在空肠。
3 讨论
吸收是药物在生物体内发挥疗效的前提,药物的肠吸收在某一程度上能够反映药物经口服后整体的吸收情况[8]。因吸收速度是影响药物进一步分布、代谢、排泄的决定性因素,而药物透过生物膜的渗透能力是吸收的限速过程,因此,吸收速率常数Ka和表观吸收系数Papp成为研究药物肠吸收的重要动力学参数[9-10]。其中Ka代表药物从吸收部位进入体循环的速度,用来衡量药物吸收速度的快慢;Papp代表药物透过生物膜的渗透能力。
目前研究药物肠吸收的方法有外翻肠囊法、肠灌流法、分离肠黏膜法等[11],其中在体肠灌流模型能够较真实的模仿肠道的环境,吸收速率稳定,与人体肠吸收有很好的相关性,因此常被用来考察药物的肠吸收情况[12-13]。本实验以动力学参数Ka和Papp为指标,通过大鼠在体肠灌流模型来考察药物的肠吸收情况。MPC和MGF肠吸收的对比结果显示(见表1和表2),MPC在各吸收部位的Ka和Papp值较MGF均有不同程度的提高,其中在空肠段的提高最为显著(P<0.01),表明磷脂复合物无论是从吸收速度还是吸收程度上均对芒果苷的肠吸收有所改善。这可能与磷脂复合物对芒果苷亲脂性的提高有关。磷脂与细胞膜结构相似,具有细胞亲和力,与药物结合后,非选择性的增强了与肠壁细胞的亲和力,使药物更易透过肠壁细胞膜,从而提高了药物在各吸收部位的渗透能力,进而提高药物的肠吸收速度。由此可见,将药物制成磷脂复合物是改善中药活性成分肠吸收的一种有效途径,对于提高中药制剂的口服生物利用度具有重要意义。
[1]廖洪利,吴秋业,叶光明,等.芒果苷药理研究进展[J].天津药学,2005,17(2):50-52.
[2]梁健钦,邓家刚.芒果苷油水分配系数的测定[J].华西药学杂志,2011,26(2):193-195.
[3]杨 昀,马 炯,王玉华,等.5-氨基酮戊酸磷脂复合物的研究[J].中国药学杂志,2007,42(1):36-39.
[4]许润春,林彦君,吴品江,等.黄芩苷磷脂复合物理化性质的研究[J].中成药,2008,30(6):932-934.
[5]吴慧仪,龙晓英,陈 莉,等.磷脂复合物及其对中药活性成分透过生物膜的影响[J].中草药,2012,43(2):393-398.
[6]Li Y,Pan WS,Chen SL,et al.Pharmacokinetic,tissue distribution,and excretion of puerarin and puerarin-phospholipid complex in rats[J].Drug Dev Ind Pharm,2006,32(4):413-422.
[7]田 慧,王亚静,孙士真,等.芒果苷磷脂复合物的制备工艺研究[J].天津中医药,2012,29(1):83-85.
[8]朱容慧,赵军宁,毕岳琦,等.中药肠吸收动力学研究进展[J].药物评价研究,2010,33(1):25-29.
[9]Arooj Khalid Alvi.Determination of absorption rate constant[EB/OL].http://pharmaxchange.info/press/2011/02/determination-ofabsorption-rate-constant/,2011-02-19.
[10]Pravin R Chaturvedi,Caroline J Decker and Aleksandrs Odinecs.Prediction of pharmacokinetics properties using experimental approaches during early drug discovery[J].Curr Opin Chem Biol,2001,5:452-463.
[11]李 高,方 超.药物肠道吸收的生物学研究方法[J].中国药学杂志,2002,37(10):726-729.
[12]梁新丽,祝婧云,廖正根,等.白芷提取物对葛根中葛根素肠吸收的影响研究[J].中国中药杂志,2012,37(10):1477-1482.
[13]王大为,张 基,李 沛,等.在体肠灌流模型研究灵仙新苷的大鼠肠吸收特性[J].中国新药杂志,2012,21(7):800-803.