吡喹酮脂质体冻干剂的制备及质量评估
邓 昉,匡光伟,,陈启友,唐湘北,陈小军,张大生,隆雪明,王 慧
(1.湖南省兽药饲料监察所,长沙 410006;2.湖南农业大学动物医学院,长沙 410128;3.湖南省畜牧水产局,长沙 410006)
血吸虫病是一种严重危害人类健康、影响社会经济发展的人畜共患寄生虫病,流行于全世界76个国家,研究表明目前全世界约有2亿人遭受感染,是一种严重危害人类健康的疾病之一[1-3]。近年来受我国长江季节性洪水等自然因素及人类活动频繁等社会因素的影响,血吸虫病疫情又出现反复,钉螺面积扩大,患病人数增加,急性感染呈上升趋势,血防形势严峻[4]。吡喹酮是用于防治血吸虫病的首选药物,目前临床应用的吡喹酮制剂有片剂和胶囊,但其口服首过效应强,生物利用度低。作为靶向给药系统的一种新剂型,脂质体(Liposome,Lip)能有效延长药物在机体内的生物半衰期,提高疗效,降低毒副作用[5-6]。然而,由卵磷脂(Soybean lecithin,PC)和胆固醇(Cholesterin,Chol)等组成的传统脂质体属于热力学不稳定体系,在体内外的弱稳定性限制了其使用,极大地影响了其作为药物载体的应用。利用冷冻干燥技术可以将吡喹酮脂质体制成冻干剂型,能在很大程度上提高其稳定性,并保持药效。本文就吡喹酮脂质体冻干剂的制备工艺及其质量进行了研究。
1 材料
1.1 仪器与设备 高效液相色谱仪Agilent1200,Agilent科技有限公司;UV2100型紫外/可见光分光光度计,北京莱佰泰科仪器有限公司;透射电子显微镜JA210T型,日本Hitachi公司;旋转蒸发仪RE252型,上海亚荣生化仪器厂;激光散射粒径分析仪Malvern22000型,英国 Malvern公司;超声处理机JY98230型,宁波新芝生物科技有限公司;冷冻干燥机LGJ-12立式压盖型,北京松源华兴科技发展有限公司。
1.2 药品与试剂 吡喹酮对照品含量99.38%,批号0046-9120,中国药品生物制品检定所;大豆卵磷脂,北京美亚斯磷脂技术有限公司,批号110318;胆固醇 L0281,上海科兴生物科技有限公司,批号100914;吡喹酮原料含量98.6%,齐鲁动物保健品有限公司提供;乙腈、甲醇为色谱纯;去离子水自制。
2 方法与结果
2.1 吡喹酮脂质体冻干剂的制备 预试验:在条件相同情况下,通过薄膜分散法、逆相蒸发法、乙醚注入法及超声法分别制备吡喹酮脂质体。根据其包封率高低,并结合吡喹酮的性质和临床用药的目的、工艺的简便程度确定薄膜超声法制备吡喹酮脂质体[7]。
正式试验:参考文献[7-8],选取卵磷脂与胆固醇质量比,加适量乙醚完全溶解后,加入吡喹酮原粉溶入其中,拌匀;置于梨形瓶中,35℃减压旋转蒸发,用旋转蒸发器减压除净有机溶剂,在梨形烧瓶内壁形成一层均匀薄膜;加入含有适量维生素E的水合介质,摇匀,静置1 h;再放入玻璃珠数枚,置回旋震荡器内,震摇1~2 h洗膜,直至膜全部洗下为止,得牛奶状多室脂质体混悬液(MLVs)。采用探头式超声波粉碎机进行短时超声30 s,得吡喹酮小单室脂质体(SUVs),装入棕色试剂瓶中,密闭,冷冻保存[9]。同时同法同量制备一平行空白脂质体,电镜观察结果显示,脂质体外观圆整而且均匀(图1)。
2.2 包封率的测定 结合吡喹酮本身的结构和特性,建立HPLC测定方法测定药物的含量。
2.2.1 吡喹酮的色谱条件[10-11]Agilent ZORBAX SB C18(250 mm ×416 mm,5 μm),流动相为乙腈 -0.1%乙酸(V∶V=4∶6),流速1 mL/min,UV 检测器检测波长214 nm,柱温30℃,进样量20 μL。

图1 吡喹酮脂质体冻干剂电镜图
方法专属性:吡喹酮对照品、吡喹酮脂质体冻干剂和空白脂质体冻干剂典型的色谱图如图2~图4所示,吡喹酮保留时间约为8.4 min,辅料对药物无干扰。
2.2.2 标准曲线的绘制 精密称取吡喹酮25 mg溶于无水乙醇中,定容至50 mL,得0.5 mg/mL吡喹酮溶液。精密吸取该溶液 1、2、4、6、8、10 mL,分别置于100 mL容量瓶中,用无水乙醇稀释至刻度,得浓度为 5、10、20、30、40、50 μg/mL 的溶液,用HPLC测定药物的峰面积。将浓度(X)与峰面积(Y)进行线性回归,得Y=300000X+24552,相关系数R >0.999,吡喹酮在浓度为 5 ~50 μg/mL 的范围内线性关系良好,检测限为0.06 μg/mL。
2.2.3 加样回收率 将脂质体冻干剂解冻,分别准确量取0.2、0.4、0.8 mL 脂质体样品,用葡聚糖凝胶柱分离,用无水乙醇小心洗脱,接取洗脱液25 mL,该测定方法的加样回收率为(98.4±1.5)%(n=3)。
2.2.4 样品包封率测定 采用葡聚糖凝胶(Sephadex)柱色谱法[12],将吡喹酮脂质体冻干剂解冻,精密吸取吡喹酮脂质体混悬液0.5 mL上柱,以乙腈-0.1%乙酸混合溶液为流动相洗脱,控制流速,每1.0 mL收集一试管,流出液管数与吸光度值曲线如图5所示。
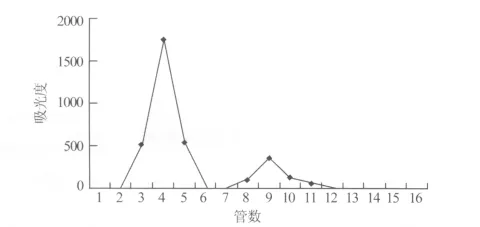
图5 吡喹酮脂质体洗脱曲线
根据Sephadex G250对大分子先被洗脱出来、小分子后出来的顺序,收集合并游离的吡喹酮于100 mL容量瓶中,加流动相定容,摇匀,HPLC测定峰面积,计算游离吡喹酮含量。另精密吸取吡喹酮脂质体混悬液0.5 mL,置100 mL容量瓶中,加无水乙醇破膜并定容至100 mL,用0.45 μm的微孔滤膜滤过,除去脂质体碎片,取滤液,用HPLC测定峰面积,求得药物含量,按下式计算包封率:包封率=(1-游离药物含量/系统中的药物总含量)×100%。
采用上述测定包封率的方法,检验3批吡喹酮脂质体冻干剂样品的包封率,包封率分别为(72.3±2.1)%、(73.2 ±2.7)%、(74.5 ±1.8)%(n=3)。
2.2.5 吡喹酮脂质体冻干剂的稳定性考察
2.2.5.1 抗光解性实验 分别称取吡喹酮脂质体冻干剂和吡喹酮各若干份,照射10 d(强度3000 LX),于 0、1、3、5、10 d 取样测定含量。结果表明,包合物抗光解性优于吡喹酮(表1)。

表1 吡喹酮脂质体冻干剂和吡喹酮抗光解性试验结果
2.2.5.2 热稳定性实验 分别精密称取吡喹酮脂质体冻干剂和吡喹酮各若干份,密封于玻璃瓶中,分别于40、60、80℃恒温干燥箱内放置10 d,于0、1、3、5、10 d取样测定含量。结果表明:吡喹酮脂质体冻干剂的热稳定性明显优于吡喹酮(表2)。

表2 吡喹酮脂质体冻干剂和吡喹酮抗热稳定性试验结果
2.2.5.3 湿稳定性实验 分别精密称取吡喹酮脂质体冻干剂和吡喹酮适量,置入两个密闭器皿中,相对湿度分别为75%(NaCl)和92.5%(KNO3),于室温放置10 d,于0、1、3、5、10 d 取样测定含量。结果表明,在高湿条件下,吡喹酮脂质体冻干剂较吡喹酮稳定(表3)。
2.2.6 脂质体的粒径参数 测定3批吡喹酮脂质体冻干剂的粒径,结果分别为(237±5.5)、(254±4.9)、(249 ±6.1)nm。
2.2.7 冻干工艺及质量评价 由于主要膜材磷脂易氧化、水解,脂质体混悬液在储存期间易发生聚集、融合及药物渗漏,因此难以满足药物制剂稳定性的要求,限制了其应用。本研究将脂质体混悬液制成冻干粉剂,采用甘露醇作为冻干保护剂,分别制成5%、10%、15%(W/V)三个不同浓度的脂质体进行冻结并冷冻干燥,通过比较各脂质体冻干再水化后的形态和粒径变化、冻干品外观及包封率的变化来选择保护剂的最佳比例,以期提高脂质体的稳定性(表4)。

表3 吡喹酮脂质体冻干剂和吡喹酮抗湿稳定性试验结果
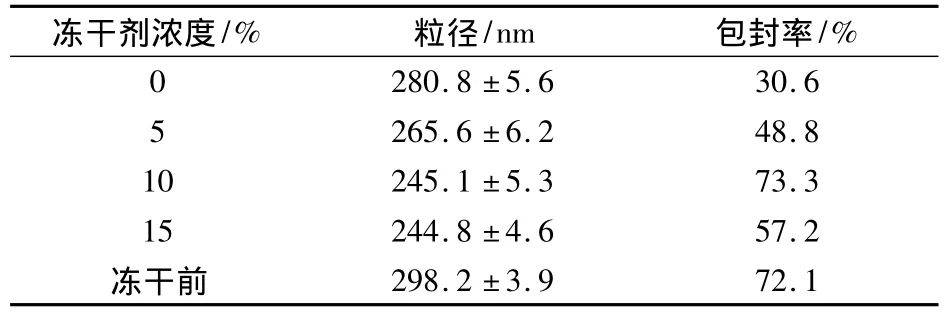
表4 不同浓度冻干保护剂对包封率和粒径的影响
3 讨论
研究表明,制成冻干脂质体可显著降低磷脂和药物的氧化及水解速度,同时,冻干保护剂可克服脂质体聚集、融合及药物渗漏等不稳定因素,保持脂质体膜结构的完整性,显著提高贮存稳定性[2]。该法与Vanleberghe报道采用冷冻干燥法提高脂质体的贮存稳定性相符[13-14],已成为较有前景的改善脂质体制剂长期稳定性的方法之一。脂质体在室温条件下短期内存放较稳定,但随着存放时间的延长,稳定性有所下降,建议在-20℃冰箱中冷冻保存。
脂质体冻结过程中形成的冰晶不仅会对脂质体囊泡造成损害,而且会影响热量的传递及水蒸气的逸出。冻干品复水化后,大量的水透过脂质体脂质双分子层,会导致药物渗漏,包封水溶性药物的大单室脂质体这种现象尤其严重。如果在冻干前加入适宜的冻干保护剂,同时采用适宜的工艺,则可大大减轻、甚至消除冻干对脂质体的破坏。
随着生物工程技术的日益发展,生物医药产品,例如多肽、蛋白质、酶及核酸类药物的不断增多,药物的给药稳定性安全性成为药物研发中迫切需要解决的重大难题。脂质体作为这类药物的常用载体,可以提高该类药物的稳定性、疗效及安全性。然而由于脂质体制备工艺较复杂,且不易扩大生产,同时冻干品的长期稳定性也还有待于进一步提高,脂质体的冻干工艺和冻干保护机理等还有待进一步研究。
[1] 陆绍红,严晓岚,李思温,等.青蒿琥酯预防曼氏血吸虫病的实验研究[J].浙江省医学科学院学报,2005,16(2):26-29.
[2] Trotta M,Pattarino F,Ignoni T.Stability of drug-carrier emulsions containing phosphatidyl- choline mixtures[J].Eur J Pharm Biopharm,2002,53(4):203-208.
[3] Allent M,Cullis P R.Drug delivery systems:entering the mainstream[J].Science,2004,303(5665):1818 -1822.
[4] 马 巍,匡尚富,廖文根,等.我国血吸虫病防治现状与研究方向[J].中国水利水电科学研究院学报,2006,4(4):241-245.
[5] Hu J H,Johnston K P,Williams R O.Nanoparticle engineering processes for enhancing the dissolution rates of poorly water soluble drugs[J].Drug Development and Industrial Pharmacy,2004,30(3):233-245.
[6] Torchilin V P.Targeted polymeric micelles for delivery of poorly soluble drugs[J].Cellular and Molecular Life Sciences,2004,61(19/20):2549-2559.
[7] 徐 霞,刘增再,刘 毅,等.伊维菌素脂质体的制备工艺[J].湖南农业大学学报(自然科学版),2005,31(3):300-303.
[8] 扶亚祥,何湘蓉,苏建明,等.奥比沙星纳米脂质体制备工艺及处方优化研究[J].动物医学进展,2009,30(4):31-35.
[9] 张 蓓,王东凯,宋 扬,等.细辛脑脂质体的制备及包封率的测定[J].中国中药杂志,2007,32(1):67-68.
[10] 高 琨,冯安吉,万明习,等.柔红霉素脂质体的制备[J].第四军医大学学报,2006,27(20):1850.
[11] 王凯平,张 玉,张 俊.猪苓多糖长循环脂质体的制备[J].中草药,2005,36(3):368-370.
[12]赵 华,董银卯,何聪芬,等.维生素C脂质体的制备与研究[J].香料香精化妆品,2006,(3):17-20.
[13]王 健,李明轩.冷冻干燥对提高脂质体稳定性的研究概况[J].中国医药工业杂志,2005,36(9):576-580.
[14] Opanasopit P,Yokoyama M,Watanabe M,et al.Influence of serum and albuminsfrom differentspecieson stability of camptothecin - loaded micelles[J].J Control Release,2005,104(2):313-321.

