单一和联合狂犬疫弱毒苗制剂给药后家兔血浆中吡喹酮的含量及血药浓度研究
苏日娜,木 兰,牧 丹,于晶峰*
(1.内蒙古医科大学药学院, 呼和浩特 010100;2.内蒙古医科大学基础医学院, 呼和浩特 010100)
吡喹酮(Praziquantel,PZQ)是由德国拜尔公司和E-Merck公司研究成功的于20世纪70年代中期发展起来一种新型的广谱抗寄生虫病药物[1]。临床应用表明,吡喹酮为理想的新型抗吸虫和绦虫药物,对吸虫病和绦虫病的治疗效果良好,已成为治疗吸虫病和绦虫病的首选药物[2-4]。目前血吸虫病的治疗仍然依赖于吡喹酮单一疗法。尽管吡喹酮可有效杀灭血吸虫成虫,但对感染相关的病理损害无效,由于吡喹酮耐药虫株的出现,寻求可替代的抗血吸虫病药物成为研究焦点。近年来临床前研究和试验发现,吡喹酮与多种抗疟[5]、抗炎药[6]、抗纤维化[7]、抗氧化剂[8]等辅助药物联合应用显示出良好的杀虫效果。在治疗过程中,如果联合阿维菌素类抗线虫药物,可使吡喹酮的抗寄生虫谱进一步扩大,对蠕虫病也可起到一定的治疗效果。同时有研究显示[9],在对片形吸虫病的治疗中,三氯苯哒唑起到了较好的治疗效果,而吡喹酮却无效,如果将二者联合使用,则对所有吸虫病和绦虫病均可起到一定疗效。郭冬梅等[10]将吡喹酮、阿苯达唑两种药品联合用于治疗人脑实质型脑囊尾坳病,在相同的治疗时间内,联合用药与单独用药治疗比较取得了更好的疗效,并疗程明显缩短。Homeida[11-12]等对吡喹酮与阿苯哒唑互相影响的药代动力学进行了研究,结果表明,吡喹酮的药代动力学参数并没有因为同时服用阿苯哒唑而受到影响,二者的半衰期改变不明显,联合用药后,不仅提高了疗效、缩短了疗程,且安全性高,无明显的毒副作用。在前期研制了细粒棘球绦虫驱虫药——吡喹酮与狂犬弱毒疫苗的复合制剂[13],确定了含药家兔血浆的前处理方法[14]的基础上,本实验建立了家兔血浆样品中吡喹酮的HPLC测定方法,测定单独和联合狂犬弱毒疫苗制剂给药后家兔血浆中吡喹酮的含量,绘制两种不同给药后吡喹酮的血药浓度-时间曲线,并初步研究其药代动力学特征参数。
1 材料与方法
1.1 材料
1.1.1 试验动物 健康成年家兔15只,常规饲养。空腹12 h后耳廓静脉采血。家兔血浆用肝素钠抗凝管收集采集的血液,3500 r/min离心10 min后,收集血浆,-20 ℃保存。
1.1.2 试验仪器 电子天平(BS 224 S),赛多利斯科学仪器(北京)有限公司;高效液相色谱仪(LC-2010A HT),日本岛津公司;离心机(3-30K),德国Sigma公司;涡动器(GL-88B),海门市其林贝尔仪器制造有限公司;真空泵(SHB-III),郑州长城科工贸有限公司;12孔氮吹仪(PGC-01D),北京晨曦科创科技有限公司。
1.1.3 试剂 乙腈、甲醇(色谱纯,sigma公司),吡喹酮对照品(色谱纯,sigma公司,批号10129462),狂犬病活疫苗(Flury株,瑞普(保定)生物药业有限公司,批号:13021)。吡喹酮原粉,新开元动物制药有限公司提供;7%吡喹酮注射剂,内蒙古农业大学寄生虫学实验室制备。
1.2 方法
1.2.1 色谱条件 色谱柱:Discovery C18(4.6×250 mm,5 μm);流动相:乙腈/水(A/B)等浓度洗脱,即0.01~30.00 min,A/B=43/57;检测波长330 nm;流速1 mL/min;柱温35 ℃;进样量10 μL。流速1.0 mL/min;检测波长263 nm;柱温35 ℃;进样量20 μL。
1.2.2 对照品溶液配制 精密称取吡喹酮标准品,用乙腈配制成浓度为12 μg/mL吡喹酮对照品溶液。
1.3 体外家兔血浆样品中喹诺酮的HPLC方法学确证
1.3.1 血浆样品处理方法 吸取1 mL血浆样品于10 mL离心管,加3 mL乙酸乙酯,漩涡8 min后,8000 r/min离心10 min,吸取乙酸乙酯层于另一试管中。重复提取一次,中和两次乙酸乙酯层,于50 ℃下氮气挥干。残渣中加入甲醇 0.4 mL涡流振荡溶解,8000 r/min 离心 5 min,取上清液 20 μL 进样。
1.3.2 方法专属性考察 按上述血浆处理方法处理含药生物样品和空白生物样品后,进样 20 μL,用上述HPLC方法测定。
1.3.3 体外家兔血浆中喹诺酮的标准曲线 精密吸取家兔空白血浆6份1.0 mL,分别加入吡喹酮标准溶液,使其血浆中吡喹酮标准溶液浓度分别为2、4、6、8、12、16 μg/mL,涡流振荡混匀,按血浆样品处理方法操作,吸取 20 μL,用上述HPLC条件测定,每个浓度下设3个重复,根据吡喹酮峰面积平均值绘制标准曲线。
1.3.4 稳定性试验 精密吸取家兔空白血浆1.0 mL,加入吡喹酮标准溶液,按血浆样品预处理方法操作,吸取20 μL上清液,用上述HPLC条件测定。进样时间分别在0、2、4、8、12、24 h。记录每次进样后吡喹酮的峰面积,采用不同时间进样的喹诺酮的峰面积或峰高的RSD%计算稳定性。
1.3.5 重复性试验 精密吸取家兔空白血浆6份各1.0 mL,加入吡喹酮标准溶液,按血浆样品处理方法操作,吸取20 μL上清液,用上述HPLC 条件测定,记录每次进样后吡喹酮的峰面积,采用峰面积或峰高的RSD%计算重复性。
1.3.6 回收率试验 配制两种标准浓度(120、90 μg/mL)的标准品样品。用HPLC进行检测,求算出各浓度吡喹酮峰面积。算出各浓度吡喹酮的峰面积与相对应浓度的吡喹酮标准品峰面积的比值,每个浓度设3个重复,此比值为待考察样品的绝对回收率。
1.4 单独给药及联合给药后家兔血浆中吡喹酮的含量测定 健康成年家兔15只,常规饲养。实验组分为对照组(生理盐水)、7%吡喹酮注射剂组以及狂犬疫苗-吡喹酮复合制剂组,每组5只。实验组根据犬与家兔的体表面积-剂量换算公式,换算成等价药物剂量,注射用水稀释,稀释后体积为0.5 mL,空腹12 h后肌注。在给药后不同时间点耳廓静脉采血。用肝素钠抗凝管收集采集的血液,3500 r/min离心10 min后,收集血浆,-20 ℃保存。同上采用血浆样品处理方法,取上清液用HPLC方法测定各实验组中吡喹酮的含量,进行统计学处理,绘制单独和联合给药后家兔血浆中吡喹酮的血药-浓度曲线。
像其他寄生虫一样,弓形虫可以在动物和人之间传染,其主要传播途径是消化道。人食用被感染的肉类或接触被感染猫的粪便,直接或间接通过胃肠道感染弓形虫。
2 结果与分析
2.1 特异性 结果如图1、图2所示。由图1、图2可以看出,空白血浆中未检测到吡喹酮,而单一给药后血浆中能够明显的检测到吡喹酮的存在。在该方法中,吡喹酮峰保留时间在15.10 min左右、无杂峰干扰,且拖尾因子和塔板数均符合要求。
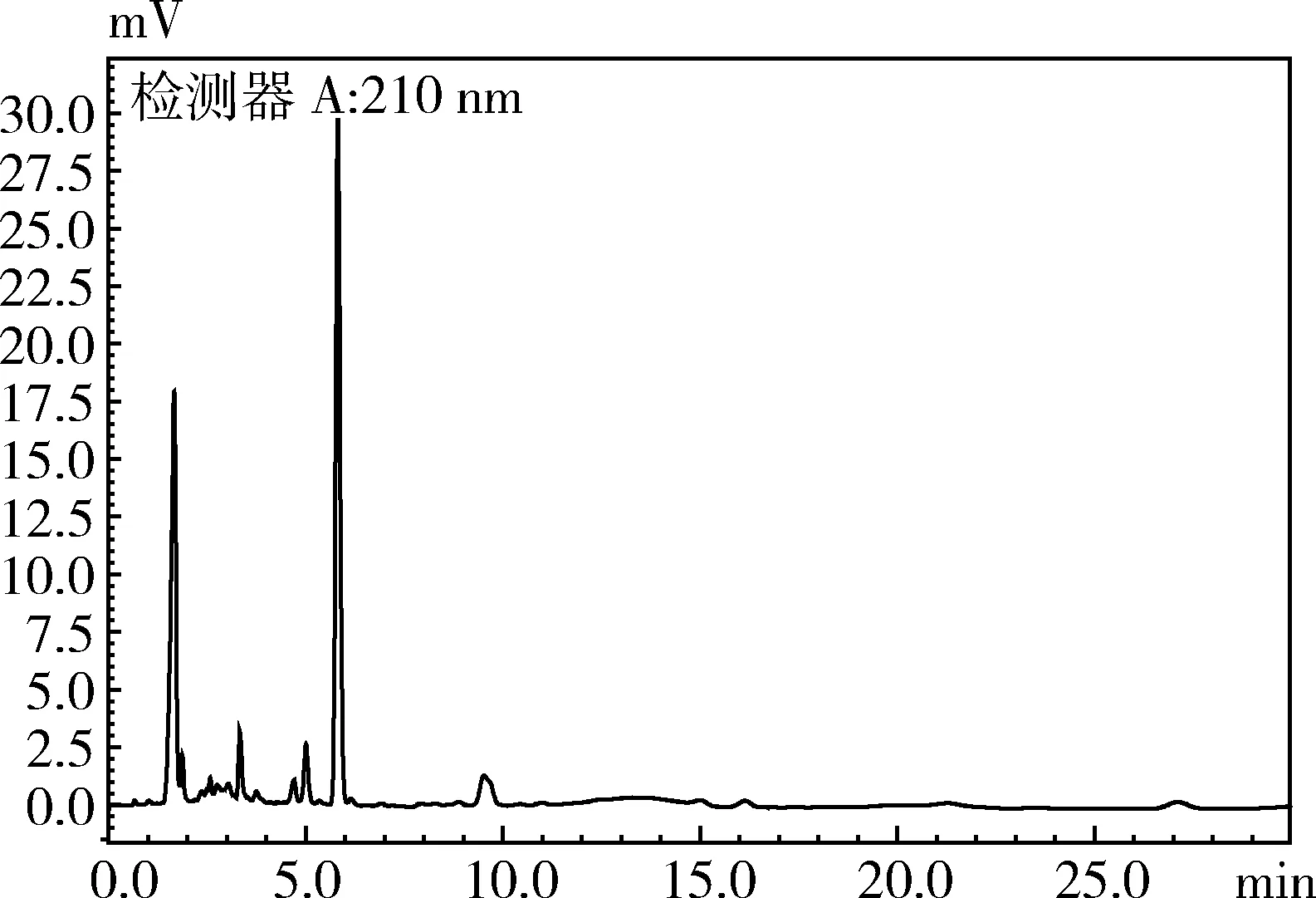
图1 空白血浆色谱图
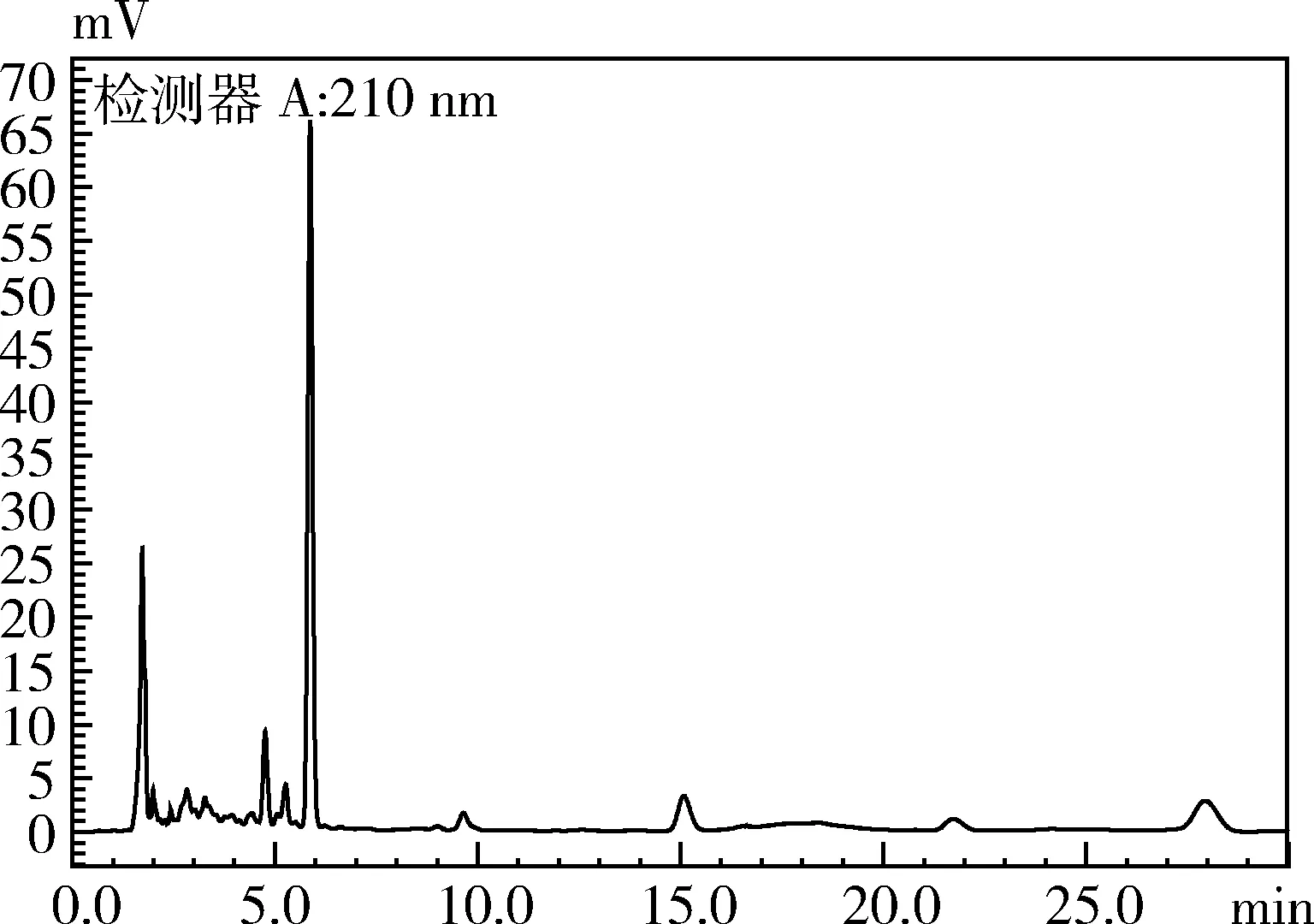
图2 单独给药血浆样品色谱图
2.2 标准曲线 在上述色谱条件下,吡喹酮标准品在2~16 μg/mL浓度范围内,线性关系良好,直线回归方程为y=127874x-4658.6(R2=0.9996,n=6)。标准曲线见图3。
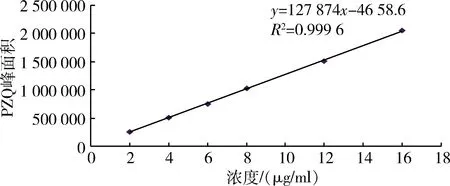
图3 吡喹酮标准品标准曲线
2.3 稳定性结果 稳定性结果见表1。由表1可知,该方法在0~24 h内稳定性很好,可以用于吡喹酮的定性及定量检测。
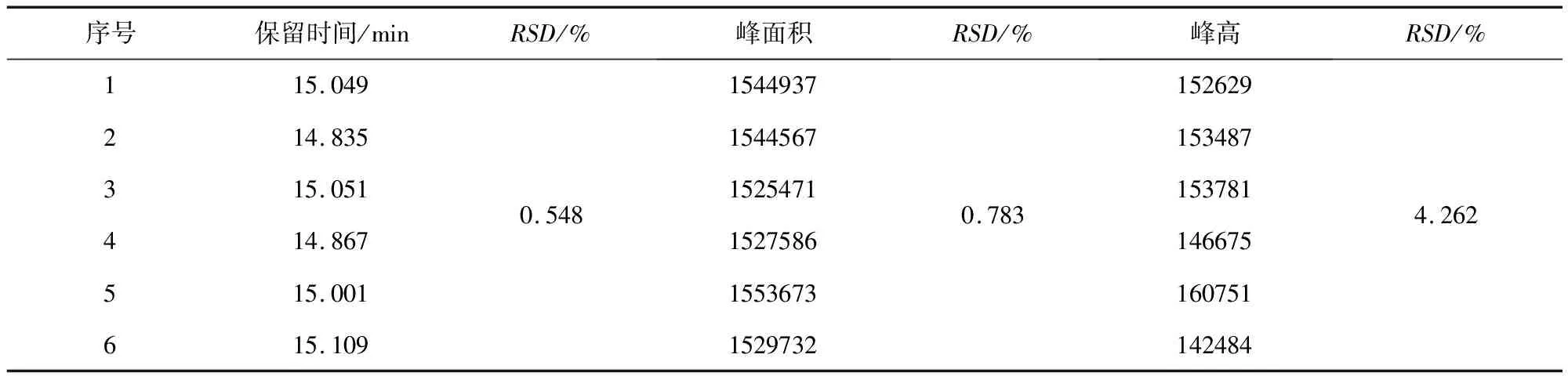
表1 家兔血浆中吡喹酮的稳定性结果
2.4 重复性结果 重复性结果见表2。由表2可知,该方法的重复性良好,可以用于吡喹酮的定性及定量检测。
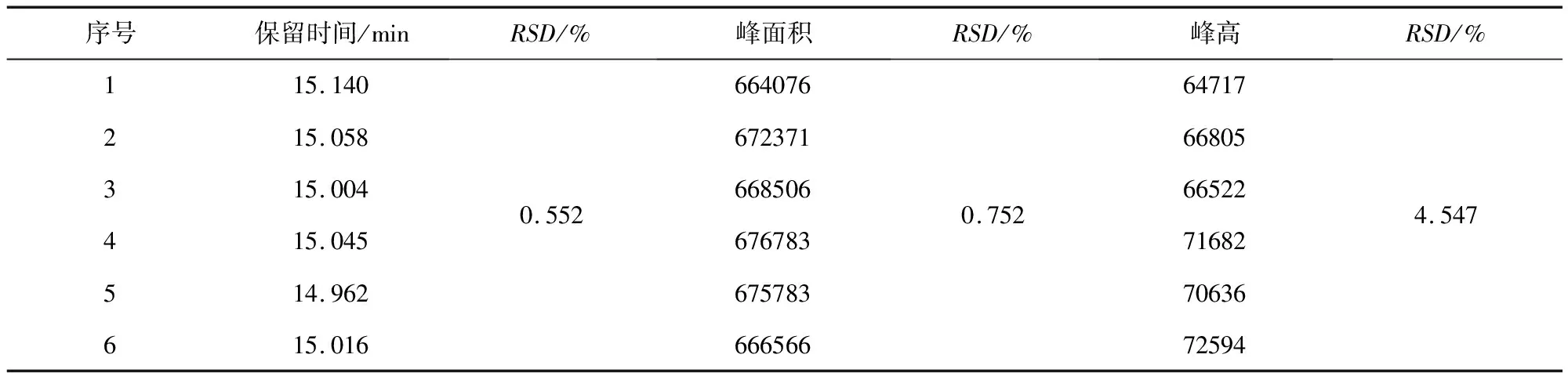
表2 家兔血浆中吡喹酮的重复性结果
2.5 回收率结果 回收率结果见表3。通过峰面积测定及标准曲线的计算,平均回收率为86.79%。
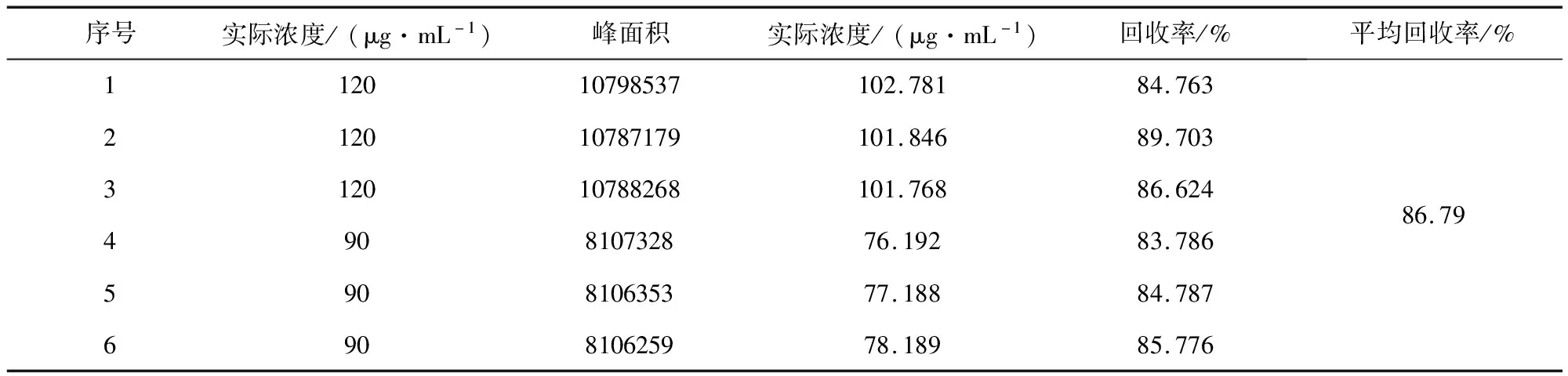
表3 家兔血浆中吡喹酮的回收率结果
2.6 单独给药与联合给药的血浆中吡喹酮含量变化 从表4可以看出,单独给药后,血浆中吡喹酮的含量在15 min后迅速增加,在1 h达到峰值,在4 h时含量达到低值,此后代谢缓慢,在24 h后仍能检测到微量吡喹酮,此时的吡喹酮几乎完全代谢。
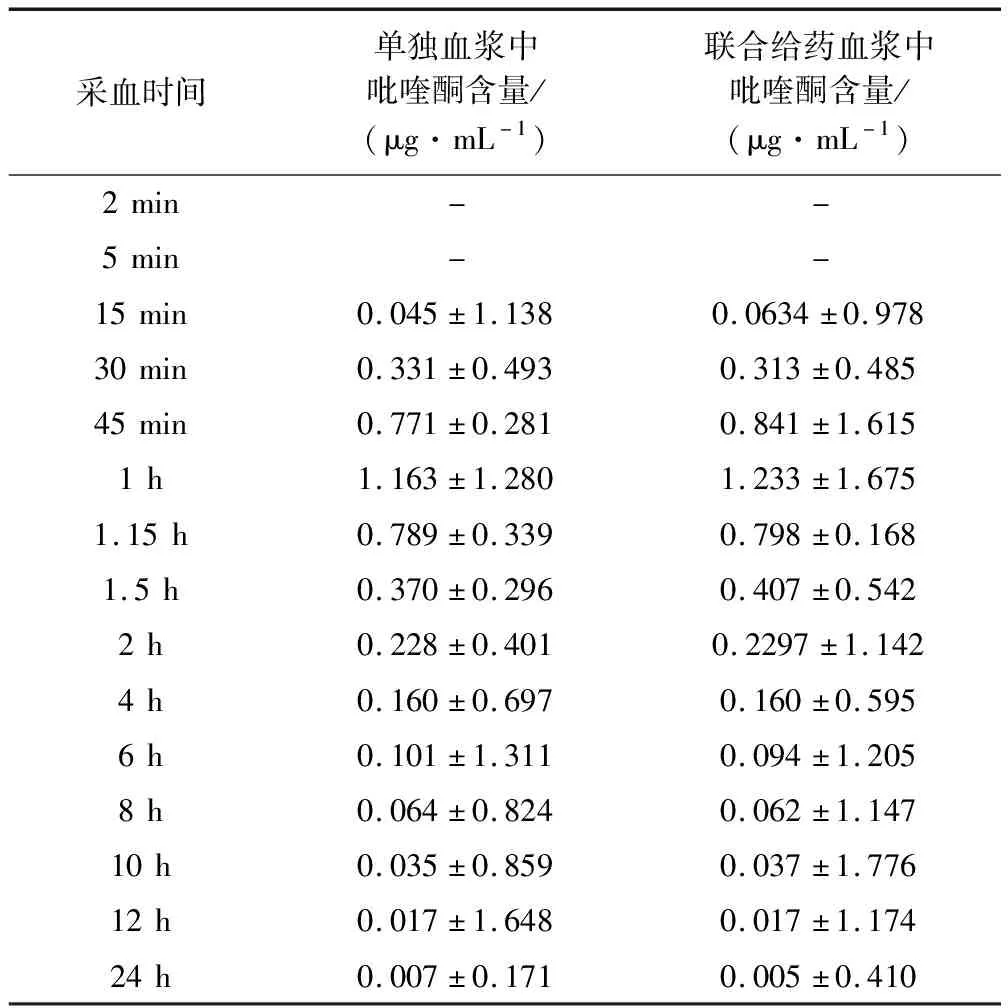
表4 单独给药与联合给药的血浆中吡喹酮的含量
由图4可以看出,单独给药与联合给药后血浆中吡喹酮含量的变化趋势几乎完全相同,联合给药后血浆中的吡喹酮含量峰值较单独给药的要高,可见联合给药比单独给药可能更有助于吡喹酮的吸收代谢。
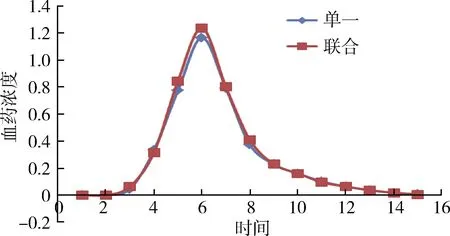
图4 单独给药与联合给药的血浆中吡喹酮的血药浓度曲线
通过DAS3.1.1药代动力学软件统计计算后,单独给药与联合给药的血浆中吡喹酮的非房室模型的参数如表5所示,单独给药与联合给药的血浆中吡喹酮的药峰浓度(Cmax)分别为1.163±0.013 μg/L和1.485±1.232 μg/L,联合给药的略高于单独给药。单独给药与联合给药的血浆中吡喹酮的药时曲线下面积(AUC0-t)的分别为2.043±0.025 μg/L·h和2.068±0.279 μg/L·h,联合给药的略高于单独给药。单独给药与联合给药的血浆中吡喹酮的平均驻留时间(MRT(0-t))分别为3.976±0.423 h和3.735±0.398 h,单独给药的略高于联合给药。单独给药与联合给药的血浆中吡喹酮的清除率(CL)基本相同。以上结果表明,单独给药与联合给药后血浆中吡喹酮的药代动力学参数基本相同,但是Cmax和AUC联合给药比单独给药略微高一点,而MRT稍低一些,可能说明联合给药比单独给药更有助于吡喹酮的吸收代谢。
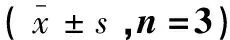
表5 单独给药与联合给药的血浆中吡喹酮的药代动力学参数
3 讨论与结论
在本研究中,通过单独给药和联合给药后测定血药浓度,发现血浆中吡喹酮含量的变化趋势呈现相似的情形,在15 min后迅速增加,在1 h达到峰值,在4 h含量达到低值,此后代谢缓慢,在24 h仍能检测到微量吡喹酮,此时的吡喹酮从体内几乎代谢完全。联合给药后血浆中的吡喹酮含量峰值较单独给药的药物含量高少许,可见联合给药比单独给药可能更有助于吡喹酮的吸收代谢。药代动力学参数计算结果与此结果相符。
实验中发现,吡喹酮含量峰值的时间与武杰较为一致,与操继跃[15]和贾冬舒[2]研究结果有些差异,本实验的血浆吡喹酮峰值时间有所提前,这可能与实验动物的种类、给药方式及给药浓度有关。何坎[16]研究了左旋和右旋吡喹酮在人体和大鼠肝微粒体的代谢,得出吡喹酮对应异构体在人和大鼠肝微粒体代谢有着严格的立体选择,为完善本实验提供了新的方向。对于吡喹酮不同的异构体与狂犬疫苗的联合代谢方面,是否也存在着立体选择有待进一步研究。
在联合给药方面,未见吡喹酮和狂犬疫苗联合给药的文献报道,本文就单独给药和联合狂犬疫弱毒苗制剂后家兔血浆中吡喹酮的药代动力学过程对体内药物吸收和代谢过程进行初步研究,以期为临床安全合理给药提供参考,同时为实际应用提供基础研究数据。

