MicroRNA-93在骨肉瘤组织中的表达及其意义
何 敏 刘水红 杨志强 高志增
骨肉瘤是原发性骨恶性肿瘤中最常见的一种,约占骨恶性肿瘤的1/3。其恶性程度较高,是严重影响劳动生产力并危及生命的重要肿瘤之一,早期诊断及早期治疗具有特别重要的意义[1]。MicroRNAs(miRNAs)是内源性非编码RNA经过一系列加工后产生的一类大小约20~25个核苷酸单链的小分子RNA,其功能为调控基因转录后的表达[2]。在恶性肿瘤发生发展中,miRNAs扮演着“癌基因”和(或)“抑癌基因”的重要角色[3-5]。本研究拟采用TaqMan MGB探针法检测miR-93在骨肉瘤组织中的表达情况,同时转染miR-93过表达载体及利用反义技术降低骨肉瘤细胞miR-93的表达,观察其生长及细胞周期变化情况,以便为骨肉瘤早期诊治提供新的理论和试验基础。
1 材料和方法
1.1 实验材料 收集2009年9月—2011年11月南昌大学第一附属医院骨外科38例骨肉瘤及对应软骨组织手术标本,所有标本均经病理学检查确诊,其中男25例,女13例,年龄11~47岁。
1.2 试剂和仪器 TaqMan miRNA分析试剂盒(美国ABI公司);DMEM高糖培养基(美国Gibco公司)、胎牛血清(美国Hyclone公司)、脂质体 LipfectamineTM2000及真核载体pcDNA5-FRT(美国Invitrogen公司);反义miR-93寡核苷酸(AMO-miR-93,大连宝生物公司);人骨肉瘤细胞系 U2-OS和MG-63购自上海中科院细胞库;实时荧光定量PCR分析仪7500(美国ABI公司),流式细胞仪(美国BD公司)。
1.3 方法
1.3.1 实时荧光定量PCR检测miR-93的表达 采用Trizol试剂提取组织总RNA,紫外分光光度计测定浓度,-70℃保存备用,用miR-93检测试剂盒检测miR-93的表达。首先取2μg总RNA作为模板与3μL逆转录酶混合,在20μL反应体系中,16 ℃ 30 min,42 ℃ 30 min,85 ℃ 5 min,进行逆转录反应。收集cDNA,然后将cDNA 150倍稀释,取1μL稀释的cDNA与2μLTaqMan引物混合,20μL反应体系:95℃ 10 min,随后 95 ℃ 15 s,61℃ 60 s,40 个循环。相对 miRNA 表达水平用循环阈值(Ct值)准确计算,U6小核RNA为内参。
1.3.2 miR-93过表达载体的构建 利用人骨肉瘤细胞U2-OS的cDNA扩增出miR-93前体序列,miR-93上游引物:5′-AGTCTCTGGCTGACTACATCACAG-3′;下游引物 :5′-CTACTCACAAAACAGGAGTGGAATC-3′。PCR产物纯化后,用Bam HⅠ和XhoⅠ对产物及载体pcDNA5-FRT双酶切。酶切产物纯化后用T4连接酶连接,然后转化感受态细菌DH5α。转化菌涂布于含氨苄青霉素抗性的溶菌肉汤培养基(LB固体培养基)琼脂平皿涂板,倒置平皿,于37℃中培养16 h。挑取单菌落摇菌,质粒小提,送公司测序验证,选取构建正确的质粒。
1.3.3 反义miR-93单核苷酸序列设计 根据miRBase提供的 miRNA基因序列(http://www.sanger.ac.uk/software/Rfam/miRna),获取人miR-93序列,设计相应的反义寡核苷酸序,采用核酸序列数据库检索程序排除其他的可能同源序列。同时再确定 1条随机的对照序列。miR-93反义序列:5′-CTACCTGCACGAACAGCACTTT-3′。随机上游序列 :5′-UUCUCCGAACGUGUCACGUTT-3′;随机下游序列 :5′-ACGUGACACGUUCGGAGAATT-3′,提交大连宝生物公司合成,纯化,全硫代修饰。
1.3.4 细胞株的培养及转染 U2-OS和MG-63细胞株接种于含10%胎牛血清的DMEM培养基,37℃、5%CO2条件下培养。严格按照脂质体LipfectamineTM2000转染试剂说明书进行转染,反义miR-93寡核苷酸终浓度分别为:50、100、150、200 nmol/L,初步筛选出最佳终浓度为100 nmol/L。
1.3.5 转染miR-93过表达载体及反义miR-93单核苷酸后对miR-93表达的影响 实验分为空白对照组、随机对照组、过表达组及AMO-miR-93组。后2组分别转染miR-93过表达载体及反义miR-93单核苷酸48 h后,抽提总RNA经纯度分析,逆转录为cDNA,测定cDNA浓度。用miR-93检测试剂盒检测miR-93的表达(具体条件同上)。
1.3.6 MTT检测各组细胞的增殖 收集U2-OS和MG-63细胞,在离心管内将各组细胞悬液充分打匀,按1×104/孔接种于96孔培养板,每孔加液量200μL,24 h后换液。实验分组同1.3.5,每组设6个复孔。于转染后1~3 d每孔加入5 g/L MTT试剂20μL,于37℃,5%CO2条件下继续孵育4 h。吸取各孔上清,加入DMSO 150μL/孔,室温下置水平摇床摇10 min以充分溶解MTT结晶。在酶联免疫测定仪上选择波长490 nm,空白孔调零,测定各孔光密度(OD)值。每组重复3次。按下列公式计算细胞生长抑制率(%):

1.3.7 流式细胞术分析细胞周期变化情况 实验分组同1.3.5。细胞接种6孔板,分别转染miR-93过表达载体及反义miR-93单核苷酸48 h后收集细胞,制成单细胞悬液,PBS洗2次,离心,弃上清,加PBS重悬细胞,加-20℃预冷的75%乙醇并振荡,4℃固定1 h,离心,弃冰乙醇,PBS洗1遍,弃上清;加入含有50 mg/L碘化吡啶(PI)和100 mg/L无DNA酶污染的RNA酶PBS染色液,4℃避光静置1 h,上机检测。每组重复3次。
1.4 统计学方法 采用SPSS 15.0统计软件,计量资料以均数±标准差(±s)表示,2组间均数比较采用t检验;多组均数间比较采用单因素方差分析,组间多重比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 骨肉瘤组织miR-93的表达情况 在38例骨肉瘤及对应软骨组织中65.8%(25/38)骨肉瘤组织miR-93的表达明显高于相对应的软骨组织,差异有统计学意义(t=2.76,P<0.05),见图1。
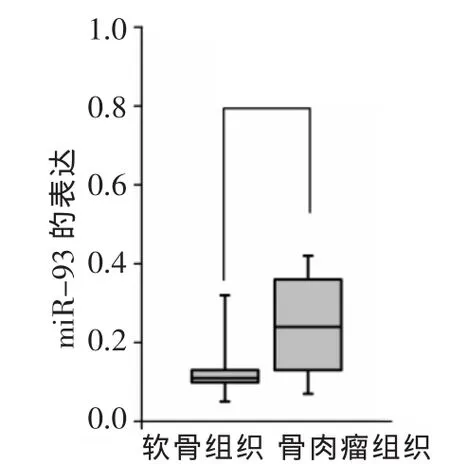
Figure 1 The expression of miR-93 in osteosarcoma and cartilaginous tissues图1 骨肉瘤组织及软骨组织中miR-93的表达情况
2.2 miR-93过表达载体或AMO-miR-93转染后miR-93表达 过表达组U2-OS和MG-63中miR-93表达水平较空白对照组增高 (P<0.01);AMO-miR-93组中miR-93表达较空白对照组降低 (P<0.01),而空白对照组与随机对照组间差异无统计学意义(P>0.05),见表1。
2.3 miR-93过表达载体或AMO-miR-93作用后对骨肉瘤细胞生长的影响 转然后1~3d,过表达组骨肉瘤细胞U2-OS和MG-63的增殖明显快于空白对照组,而AMO-miR-93组骨肉瘤细胞的增殖明显慢于空白对照组(P<0.01);空白对照组与随机对照组间骨肉瘤细胞的生长差异无统计学意义(P>0.05),见表2、3。
Table 1 The expression of miR-93 in U2-OSand MG-63 cells treated with different conditions表1 不同因素处理U2-OS和MG-63细胞后miR-93表达情况 (n=3,±s)

Table 1 The expression of miR-93 in U2-OSand MG-63 cells treated with different conditions表1 不同因素处理U2-OS和MG-63细胞后miR-93表达情况 (n=3,±s)
**P<0.01
?
Table 2 The optical density of cell proliferation in different treated U2-OScells表2 不同因素处理U2-OS细胞后增殖率OD值(n=3,±s)
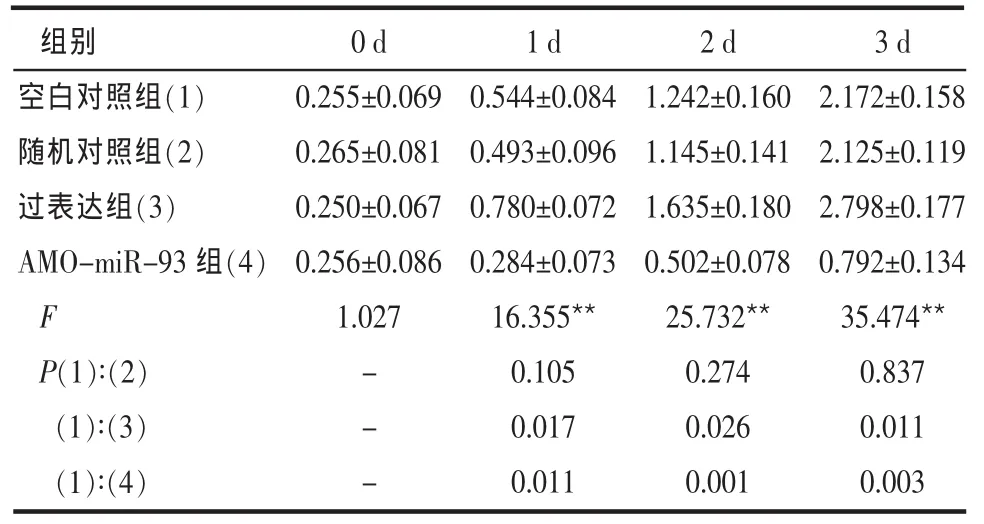
Table 2 The optical density of cell proliferation in different treated U2-OScells表2 不同因素处理U2-OS细胞后增殖率OD值(n=3,±s)
**P<0.01
?
Table 3 The optical density of cell proliferation in different treated MG-63 cells表3 不同因素处理MG-63细胞后增殖率OD值(n=3,±s)

Table 3 The optical density of cell proliferation in different treated MG-63 cells表3 不同因素处理MG-63细胞后增殖率OD值(n=3,±s)
**P<0.01
?
2.4 转染miR-93过表达载体或AMO-miR-93后骨肉瘤细胞周期变化情况 过表达组较空白对照组U2-OS和MG-63细胞的G0/G1期比例明显降低,而S期的细胞比例明显增加(P<0.01);AMO-miR-93组较空白对照组细胞G0/G1期比例明显增加,而S期和G2/M期细胞比例明显降低(P<0.01)。空白对照组与随机对照组间差异无统计学意义(P>0.05),见表4、5。
Table 4 The cell cycle of U2-OScells in four groups表4 4组U2-OS细胞的细胞周期变化 (n=3,%,±s)
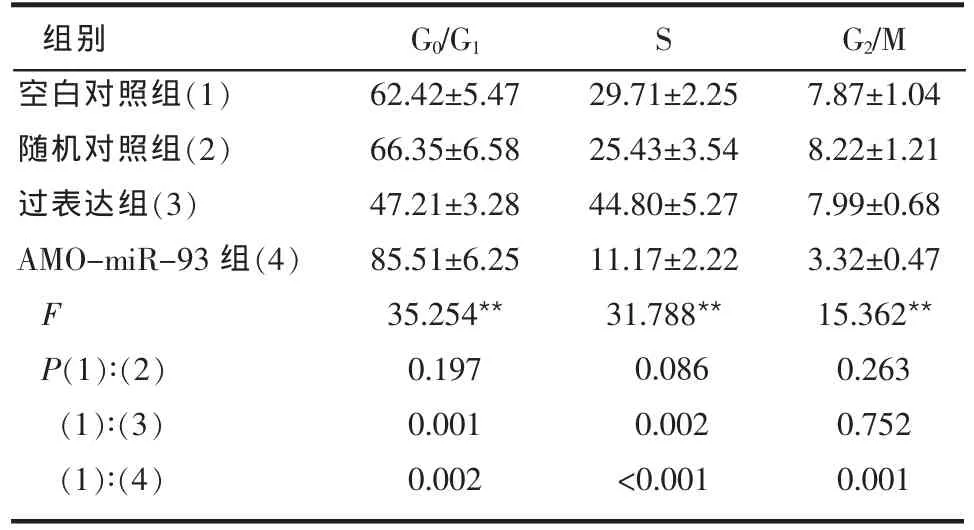
Table 4 The cell cycle of U2-OScells in four groups表4 4组U2-OS细胞的细胞周期变化 (n=3,%,±s)
**P<0.01
?
Table 5 The cell cycle of MG-63 cells in four groups表5 4组MG-63细胞的细胞周期变化 (n=3,%,±s)
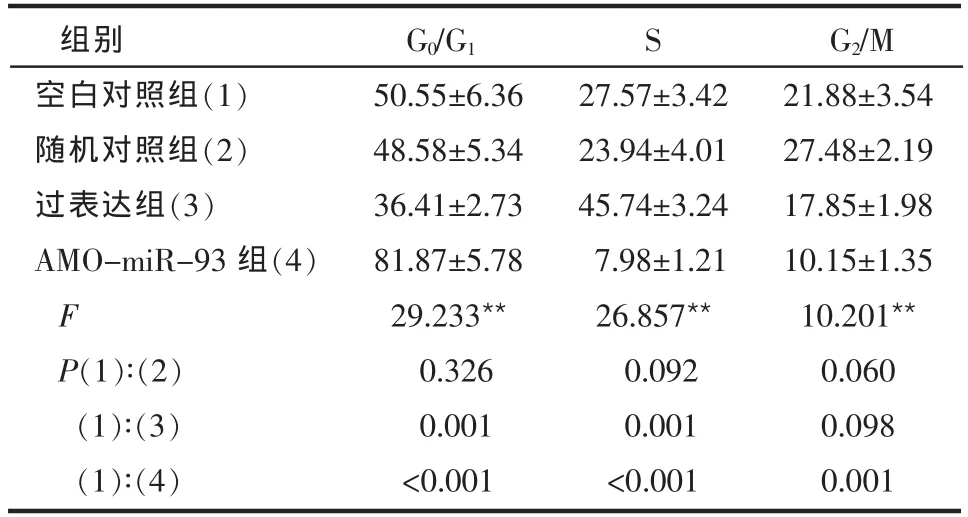
Table 5 The cell cycle of MG-63 cells in four groups表5 4组MG-63细胞的细胞周期变化 (n=3,%,±s)
**P<0.01
?
3 讨论
miRNAs可通过调控基因表达来参与生命过程中的一系列重要进程,包括早期发育、细胞增殖、凋亡、分化以及死亡。miRNAs通过与靶mRNA的3′非编码区近乎完全互补结合在转录后水平使其降解,或者与之不完全互补结合在翻译水平抑制蛋白合成,从而在基因表达中发挥重要的调节作用。多种癌症中存在miRNAs的突变或表达异常,其在肿瘤发生中的角色正日益受到关注[6-7]。有研究者认为miRNAs可作为癌基因或者抑癌基因而发挥作用[5-6]。因此miRNAs可能成为肿瘤诊断、治疗及判断预后的新的分子标志物和分子靶点,且由于miRNAs在转录后调节目的基因的表达,这将更有利于肿瘤的早发现、早诊断和早治疗,必将具有广泛的临床应用前景[8-9]。
骨肉瘤是起源于成骨组织的一种原发性恶性肿瘤,目前主要采用术前术后放疗联合外科手术的综合疗法。虽然化疗和手术治疗的水平不断提高,但仍然有大约一半的患者治疗失败,原因就在于肿瘤的早期转移以及耐药性的出现[1,8]。因此,迫切需要寻找新的肿瘤标志物来进一步提高骨肉瘤的早期诊疗水平。Murakami等[10-11]首次研究发现miR-93在肝癌组织中呈过高表达,最近又有研究发现miR-93通过调控integrin-β8而参调节肿瘤的生长[12],但miR-93在骨肉瘤中的表达及其作用目前还不清楚。
笔者首先通过分析38例骨肉瘤组织及对应的软骨组织中miR-93的表达,发现65.8%的骨肉瘤患者癌组织中miR-93表达上调。将miR-93过表达载体转染入骨肉瘤细胞中,发现其表达明显增高。Krützfeldt等[13]研究发现针对 miRNA122及miRNA192的反义寡核苷酸能够明显抑制小鼠不同组织中对应miRNAs的表达,表明针对miRNAs的反义寡核苷酸可以有效抑制miRNAs的表达。本研究同样利用反义技术成功降低骨肉瘤细胞U2-OS和MG-63内的miR-93表达。同时笔者利用MTT法检测证实miR-93可以抑制骨肉瘤细胞U2-OS和MG-63的增殖。流式细胞术分析发现增加miR-93表达后骨肉瘤细胞G0/G1期降低,阻滞于S期;降低miR-93表达后骨肉瘤细胞周期主要停滞在 G0/G1期,而S期和G2/M期细胞的比例明显下降。另外在胃癌中的研究发现miR-93、miR-106b和miR-25等通过调控细胞周期而影响细胞生长[14],这与本研究在骨肉瘤中的研究结果类似。
综上所述,miR-93在骨肉瘤的发生发展中发挥重要作用,很可能成为一个新的骨肉瘤形成前的标志物,为骨肉瘤基因治疗提供新的靶点。
[1]Canale ST,Beaty JH.Campbell’s Operative Orthopaedics[M].11th edition,Mosby/Elsevier,2008:901-902.
[2]Yu DC,Li QG,Ding XW,etal.Circulating microRNAs:potential biomarkers for cancer[J].Int JMol Sci,2011,12(3):2055-2063.
[3]Sayed D,Abdellatif M.MicroRNAs in development and disease[J].Physiol Rev,2011,91(3):827-887.
[4]Croce CM.Causes and consequences of microRNA dysregulation in cancer[J].Nat Rev Genet,2009,10(10):704-714.
[5]Munker R,Calin GA.MicroRNA profiling in cancer[J].Clin Sci(Lond),2011,121(4):141-158.
[6]Zhong X,Coukos G,Zhang L.miRNAs in human cancer[J].Methods Mol Biol,2012,822:295-306.
[7]Wang X,Tang S,Le SY,etal.Aberrant expression of oncogenic and tumor-suppressive microRNAs in cervical cancer is required for cancer cell growth[J].PLoSOne,2008,3(7):e2557.
[8]Nikifomva MN,Tseng GC,Steward D,etal.MicroRNA expression profiling of thyroid tumors:biological significance and diagnostic utility[J].JClin Endocrinol Metab,2008,93(5):1600-1608.
[9]Cho WC.OncomiRs:the discovery and progress of microRNAs in cancers[J].Mol Cancer,2007,6:60.
[10]Murakami Y,Yasuda T,Saigo K,etal.Comprehensive analysis of microRNA expression patterns in hepatocellular carcinoma and non-tumorous tissues[J].Oncogene,2006,25(17):2537-2545.
[11]Jiang J,Gusev Y,Aderca I,etal.Association of MicroRNA expression in hepatocellular carcinomas with hepatitis infection,cirrhosis,and patient survival[J].Clin Cancer Res,2008,14(2):419-427.
[12]Fang L,Deng Z,Shatseva T,etal.MicroRNA miR-93 promotes tumor growth and angiogenesis by targeting integrin-β8[J].Oncogene,2011,30(7):806-821.
[13]Krützfeldt J,Rajewsky N,Braich R,etal.Silencing of microRNAs in vivo with‘antagomirs’[J].Nature,2005,438(7068):685-689.
[14]Petrocca F,Visone R,Onelli MR,etal.E2F1-regulated microRNAs impair TGF beta-dependent cell-cycle arrest and apoposis in gastric cancer[J].Cancer cell,2008,13(3):272-286.

