Bax在14-3-3γ对抗脂多糖诱导的心肌细胞损伤中的作用*
刘丹尹东孙惦许旻何明
脂多糖(Lipopolysaccharide,LPS)能激发过度的炎症反应,产生脓毒血症[1]。心脏是脓毒血症中最易受损的主要靶器官之一[2],因此,为降低脓毒血症的病死率,减轻心脏功能损伤极为重要。本课题组前期在内毒素整体动物模型上观察到,内毒素血症时心肌14-3-3γ表达增加,提示14-3-3γ可能在内毒素所致的心肌损伤中发挥重要作用[3]。本研究拟构建pFLAG-14-3-3γ重组质粒,转染至原代培养乳鼠心肌细胞,旨在从细胞水平探讨其在心肌细胞损伤中的作用,并进一步检测凋亡的重要调节因子Bax的表达与分布,深入探讨14-3-3γ的保护机制。
1 材料与方法
1.1 受试药品与主要试剂 pFLAG-CMVTM-4质粒(Sigma公司),限制性内切酶 Eco RⅠ和 KpnⅠ(NEB),逆转录试剂盒、T4 DNA连接酶、凝胶回收试剂盒及无内毒素质粒提取试剂盒 (Promega 公司),14-3-3γ 抗体、Bax抗体、β-actin 抗体及相应二抗 (Santa Cruz),线粒体分离试剂盒 (Biovision公司),LipofectamineTM2000 (Invitrogen),MEM 培养基(GIBCO BRL公司产品),胎牛血清(杭州四季青生物工程材料有限公司),增强化学发光印迹试剂和硝酸纤维素膜(Amersham公司),胰酶、MTT、HEPES、PMSF、亮肽素,丙烯酰胺、SDS,亚甲基双丙烯酰胺、过硫酸铵、TEMED、EDTA和 DTT(Sigma公司产品),其他试剂均为分析纯。
1.2 方法
1.2.1 心肌细胞的分离培养 参照文献[4]方法略加改进,以下操作均在超净台内进行。取出生1~3 d的SD乳鼠,开胸取出心脏,分离心室组织,经0.1%胰酶消化分离,用含15%胎牛血清的MEM培养基混悬后置CO2培养箱(5%CO2,37℃)培养2 h去除成纤维细胞,台盼蓝鉴别细胞存活率在90%以上者用于实验,然后按5×105/孔、1×104/孔分别接种于6孔培养板和96孔培养板内,CO2培养箱培养,隔天换培养液,前3 d加入终浓度为0.1 mmol/L 5-溴脱氧尿嘧啶核苷 (Brdu)抑制纤维细胞生长。培养4 d随机分组进行实验。
1.2.2 实验分组(1)对照(Control)组:未转染质粒及未经LPS处理组。(2)LPS组:加LPS至培养液中,终浓度为10 mg/L,孵育6 h。(3)pFLAG+LPS组:空载质粒pFLAG转染至心肌细胞中,24 h 后处理同 LPS 组。(4)pFLAG-14-3-3γ+LPS 组:重组质粒pFLAG-14-3-3γ转染至心肌细胞中,24 h后处理同LPS组。
1.2.3 14-3-3γ真核表达载体pFLAG-14-3-3γ的构建 取SD鼠心肌组织 50 mg,用 RT-PCR方法获取 14-3-3γ(GenBank D17447.1)的全长编码 cDNA,引物序列 上游:5′-AAGAATTCCCCCGCGAAGATG-3′, 下游:5′-TTAGGTACCTG GGGCCTTAGTTGTT-3′,分别在上、下游引物中引入 Eco RⅠ和KpnⅠ的酶切位点及保护性碱基。PCR扩增后的目的基因cDNA与质粒pFLAG-CMVTM-4用 Eco RⅠ和 KpnⅠ双酶切、T4连接酶连接。连接反应产物转化感受态细胞并用抗生素筛选。质粒提取后,行酶切鉴定和DNA测序。
1.2.4 pFLAG-14-3-3γ重组质粒转染及表达效率的检测 在转染前,PBS洗2次,除去抗生素,将 LipofectamineTM2000(μL)与 DNA(μL)以 2.0∶0.8 比例混合,加入到每孔细胞中,置于培养箱(5%CO2,37℃)中孵育。24h后裂解细胞,提取蛋白,Western blot检测心肌细胞14-3-3γ蛋白表达。以空载质粒载体pFLAG为对照。
1.2.5 细胞存活率检测 采用MTT比色法检测。胰酶消化后收集细胞,每组细胞以1×104/孔接种于96孔培养板中。细胞覆盖率达70%~80%后吸出培养基。每孔加入MTT溶液(5 g/L溶于PBS)20μL,37℃孵育4 h。吸弃孔内培养上清液,再每孔加DMSO 150μL振荡10 min,使蓝色结晶充分溶解。酶联免疫检测仪在490 nm波长处测定其光密度(OD)值,以间接反映各组活细胞数。
1.2.6 生化检测 各组分别取孵育液200μL,美国Beckman生化自动分析仪测定乳酸脱氢酶(LDH)、肌酸磷酸酶(CPK)活性。当心肌细胞受损时,LDH及CPK会释放至孵育液中,使得LDH及CPK值升高,故LDH、CPK值与心肌细胞损伤成正比。
1.2.7 细胞凋亡检测 收集各组细胞,在细胞悬液中加入10 μL Annexin V-FITC和5μL的PI,轻轻混匀,避光室温反应15 min,再加入300μL Binding buffer,立即进行流式细胞仪检测。
1.2.8 Western blotting检测线粒体和胞浆中Bax蛋白水平 各组使用线粒体和胞浆蛋白制备试剂盒,按操作说明书制备线粒体和胞浆蛋白。同等量蛋白质完成SDS-PAGE后,进行电转膜,再先后结合一抗和二抗,最后X线胶片曝光分析。
1.3 统计学方法 采用SPSS 11.5软件进行分析,计量数据以±s表示,多组间比较用单因素方差分析,组间多重比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 转染 pFLAG-14-3-3γ对心肌细胞14-3-3γ蛋白表达的影响 pFLAG组的14-3-3γ蛋白表达与对照组相比无明显升高,pFLAG-14-3-3γ组的14-3-3γ蛋白表达高于对照组和pFLAG组 (P<0.001)。说明重组14-3-3γ的真核表达载体在原代乳鼠心肌细胞中能有效表达,见图1、表1。
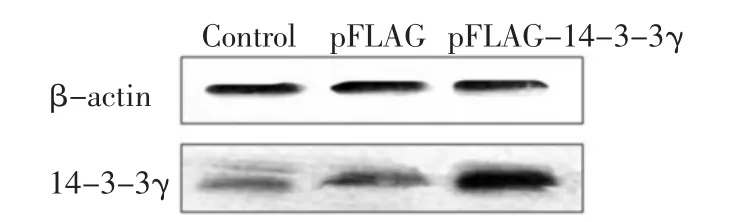
Figure 1 The expression of 14-3-3γprotein in different groups图1 14-3-3γ蛋白在各组中的表达
Table 1 The expression of 14-3-3γprotein in different groups表1 14-3-3γ蛋白在各组中的表达 (n=6,±s)
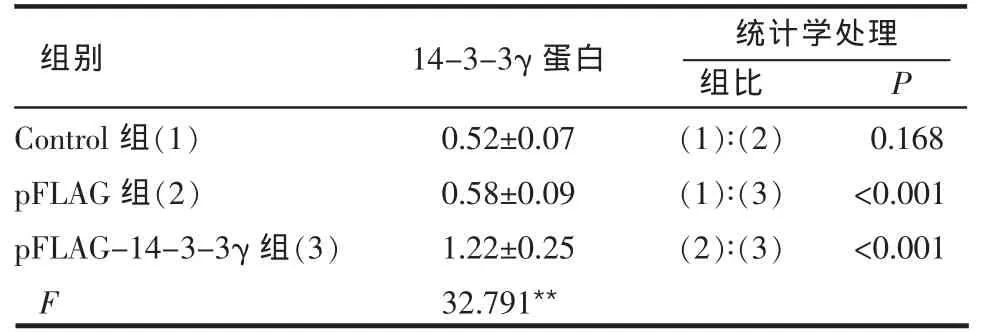
Table 1 The expression of 14-3-3γprotein in different groups表1 14-3-3γ蛋白在各组中的表达 (n=6,±s)
**P<0.01
?
2.2 14-3-3γ基因转染对LPS损伤后细胞存活率的影响 LPS组与对照组比较细胞存活率明显降低(P<0.001);而转染了pFLAG-14-3-3γ的心肌细胞能明显对抗随后LPS所致损伤,使细胞存活率明显升高(P<0.001),见表2。
Table 2 Comparison of cell viability,LDH,CPK and apoptotic rate between different groups表2 各组细胞存活率、LDH及CPK活性、细胞凋亡率比较 (n=6,±s)
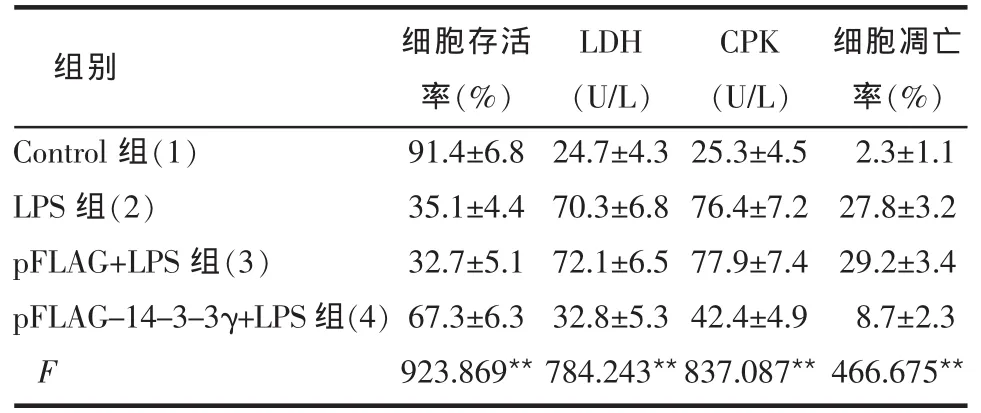
Table 2 Comparison of cell viability,LDH,CPK and apoptotic rate between different groups表2 各组细胞存活率、LDH及CPK活性、细胞凋亡率比较 (n=6,±s)
**P<0.01;(1)∶(2)~(4),(2)∶(4),(3)∶(4), 均 P<0.001,(2)∶(3)P>0.05
?
2.3 14-3-3γ基因转染对LPS损伤后LDH、CPK的影响 LPS处理使LDH及CPK较对照组明显升高(P<0.001),而转染了pFLAG-14-3-3γ的细胞再受到LPS损伤处理,LDH及 CPK较LPS组及pFLAG+LPS 组明显降低(P<0.001),见表2。
2.4 14-3-3γ基因转染对LPS损伤后细胞凋亡的影响 LPS处理使心肌细胞凋亡率较对照组明显增加(P<0.001),转染 pFLAG-14-3-3γ 的细胞能明显对抗LPS所致的损伤,与LPS损伤组相比细胞凋亡率明显减少(P<0.001),见表2、图2。
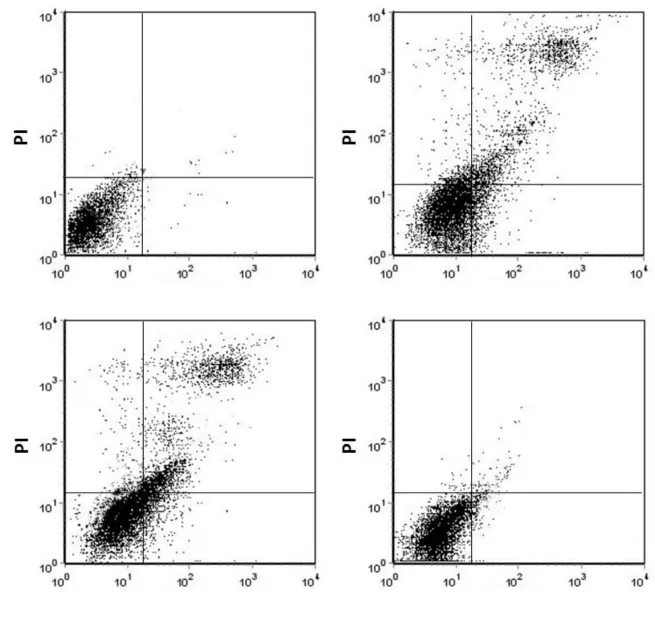
Figure 2 The cell apoptosis detected by flow cytometry in different groups图2 流式细胞仪检测各组细胞凋亡
2.5 14-3-3γ基因转染对LPS损伤后Bax表达与分布的影响 对照组Bax主要分布在胞浆,当心肌细胞遭受LPS损伤时,Bax移位至线粒体,胞浆/线粒体(cyto-Bax/mito-Bax)比值较对照组明显减少(P<0.001)。转染 pFLAG-14-3-3γ 能明显对抗Bax向线粒体的移位,使cyto-Bax/mito-Bax比值较LPS组和 pFLAG+LPS组明显升高(P<0.001),见表3、图3。
Table 3 Levels of Bax protein in cytoplasm and mitochondria in different groups表3 各组中胞浆、线粒体Bax蛋白水平 (n=6,±s)
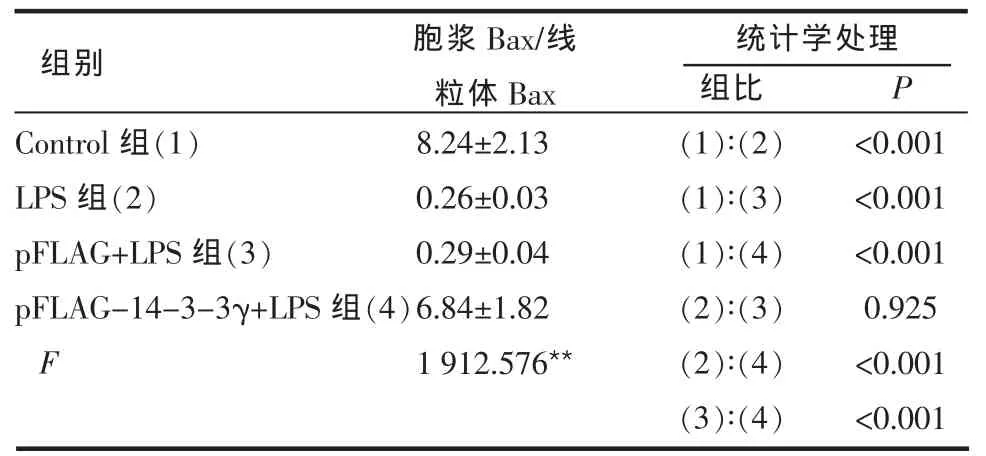
Table 3 Levels of Bax protein in cytoplasm and mitochondria in different groups表3 各组中胞浆、线粒体Bax蛋白水平 (n=6,±s)
**P<0.01
?

Figure 3 Levels of Bax protein in cytoplasm and mitochondria in different groups图3 各组中胞浆、线粒体Bax蛋白水平
3 讨论
3.1 14-3-3蛋白的基本生理作用 14-3-3蛋白是存在于几乎所有生物体细胞中的一类重要蛋白质家族,共有 β、ε、γ、η、σ、τ、ζ7 个亚型。14-3-3 蛋白主要通过与配体蛋白的相互作用,参与细胞周期、细胞凋亡、紧张反应和信号转导调控[5]。其中14-3-3蛋白最常见的作用方式就是将其配体蛋白限制在某一特定部位,通常是在胞浆,使其无法到达功能部位发挥作用[6]。
3.2 pFLAG-14-3-3γ质粒对心肌LPS损伤的对抗作用 本课题组前期实验中发现,14-3-3γ在大鼠烧伤及内毒素损伤模型中心肌表达明显升高[3],高度怀疑此蛋白可能在内毒素致心肌损伤过程中发挥重要作用。为验证此假说,并排除整体动物实验多因素干扰,笔者构建了pFLAG-14-3-3γ重组质粒,建立原代SD乳鼠心肌细胞LPS损伤模型,结果发现转染pFLAG-14-3-3γ后,心肌细胞能明显对抗随后发生的LPS损伤,使细胞存活率升高,细胞损伤减轻,表现为LDH、CPK活性下降,心肌细胞凋亡减少。
3.3 pFLAG-14-3-3γ抗心肌LPS损伤作用与抑制Bax线粒体移位有关 有文献报道,在神经细胞胞浆中14-3-3蛋白与Bcl-2家族中的Bax结合[7]。Bcl-2家族是在细胞凋亡过程中发挥关键性作用的一类蛋白质,主要是通过调节线粒体膜的通透性,影响线粒体的功能来完成对细胞凋亡的调控。Bax是Bcl-2家族中的促细胞凋亡蛋白成员,通常情况下,Bax蛋白一般存在于胞浆内,受到相关的凋亡信号刺激时,移位至线粒体,直接或间接地与线粒体通道蛋白相互作用,引起促凋亡因子细胞色素C等的释放[8]。为此,本实验检测了Bax蛋白在细胞浆与线粒体中的表达情况,结果发现当心肌细胞遭受LPS损伤时,Bax蛋白由胞浆向线粒体转移,而当转染pFLAG-14-3-3γ后,Bax蛋白的这种向线粒体迁移则明显抑制,说明在心肌细胞胞浆中14-3-3γ能抑制LPS诱导Bax向线粒体的转移,进而维持线粒体膜的稳定性,起到对抗LPS损伤的作用。
[1]Song R,Kim J,Yu D,etal.Kinetics of IL-6 and TNF-αchanges in a canine model of sepsis induced by endotoxin[J].Vet Immunol Immunopathol,2012,146(2):143-149.
[2]Wang YY,Li HM,Wang HD,etal.Pretreatment with berberine and yohimbine protects against LPS-induced myocardial dysfunction via inhibition of cardiac I-[kappa]B [alpha]phosphorylation and apoptosis in mice[J].Shock,2011,35(3):322-328.
[3]He M,Zhang J,Shao L,etal.Upregulation of 14-3-3 isoforms in acute rat myocardial injuries induced by burn and lipopolysaccharide[J].Clin Exp Pharmacol Physiol,2006,33(4):374-380.
[4]Liu D,He M,Yi B,etal.Pim-3 protects against cardiomyocyte apoptosis in anoxia/reoxygenation injury via p38-mediated signal pathway[J].Int JBiochem Cell Biol,2009,41(11):2315-2322.
[5]Morrison DK.The 14-3-3 proteins:integrators of diverse signaling cues that impact cell fate and cancer development[J].Trends Cell Biol,2009,19(1):16-23.
[6]Obsil T.14-3-3 proteins-a family of universal scaffolds and regulators[J].Semin Cell Dev Biol,2011,22(7):661-662
[7]Heaton MB,Paiva M,Kubovic S,etal.Differential effects of ethanol on c-jun N-terminal kinase,14-3-3 proteins,and Bax in postnatal day 4 and postnatal day 7 rat cerebellum[J].Brain Res,2012,1432(13):15-27.
[8]Antonsson B,Montessuit S,Sanchez B,etal.Bax is present as a high molecular weight oligomer/complex in the mitochondrial membrane of apoptotic cells[J].J Biol Chem,2001,276(15):11615-11623.

