巴豆不同给药方式对荷瘤小鼠的影响
李佳桓,林海红,杜钢军
(河南大学药学院 药物研究所,河南 开封475004)
癌毒,是引发恶性肿瘤的一个重要因素,其致病暴戾,毒陷邪深,非攻不克,故中医常采用以毒攻毒之法,选用药性剧烈的中药,以达到攻坚蚀疮、破瘀散结之目的[1]。巴豆为大戟科植物巴豆(Croton tiglium L.)的干燥成熟种子,其味辛,性热,大毒,归胃、大肠、肺经[2]。本实验制备不同的巴豆制品,采用Lewis肺癌皮下移植模型和4T1乳腺癌肺转移模型观察了巴豆不同给药方式对荷瘤小鼠的影响。
1 材料
1.1 动物及瘤株
C57BL/6小鼠及 BALB/c小鼠,雌性,18~22g,购自河南省实验动物中心;Lewis肺癌,本实验室C57BL/6小鼠在体传代保存;4T1乳腺癌,本实验室BALB/c小鼠在体传代保存。
1.2 药品与试剂
巴豆(购自开封同济堂,经中药学许文渊教授鉴定);印度墨汁(北京笃信精细制剂厂);L-肾上腺素(1mg/支,重庆迪康长江制药有限公司);谷胱甘肽(GSH,北京欣经科生物试剂有限公司);二硫对二硝基苯甲酸(DTNB,国药集团化学试剂有限公司);辣根过氧化物酶(HRP,国药集团化学试剂有限公司);硫代巴比妥酸(TBA,国药集团化学试剂有限公司);其他试剂均为市售分析纯。
1.3 巴豆霜及水煎液的制备
巴豆霜:称取巴豆20g,去皮,粗纸包裹,电热板上烘热,压榨去油,换纸后再烘再榨,反复数次,直至纸无油痕,药物呈松散粉末状,口服给药时以所需剂量加入淀粉糊制成所需混悬液。水煎液:称取巴豆20g,加水500mL煎煮2次,每次40min,合并2次煎煮液浓缩至200mL,过滤,4℃保存备用,口服给药时根据给药剂量用蒸馏水稀释。
1.4 仪器
ELX800UV型酶标仪(美国Bio-Tek公司);SB-3C-1A型洁净工作台(上海博迅实业有限公司医疗设备厂);TDL-50B型台式离心机(上海安亭科学仪器厂);JY1001型电子天平(上海精密科学仪器有限公司);FA1004N型分析天平(上海精密科学仪器有限公司天平仪器厂);SK-1快速混匀器(常州国华电器有限公司);85-2恒温磁力搅拌器(常州国华电器有限公司);游标卡尺。
2 方法
2.1 对小鼠Lewis肺癌皮下移植肿瘤的影响
取生长良好的lewis肺癌传代实体瘤组织,用组织匀浆器制备单细胞悬液,调细胞数5×106/mL,按0.2mL/只接种于小鼠右前肢腋部皮下。将30只接种肿瘤的小鼠随机分为3组,每组10只。对照组:蒸馏水0.4mL/只灌胃给药;巴豆霜组:巴豆霜混悬液50mg/kg灌胃给药;水煎液组:水煎液50mg/kg灌胃给药。1次/d,连续3周,每日监测小鼠体质量。肿瘤长出后隔日用游标卡尺测量肿瘤直径2次,计算肿瘤体积。治疗结束次日,将小鼠处死,剥离肿瘤、脾脏,称重,计算抑瘤率和脾脏指数。
肿瘤体积(mm3)=肿瘤长度×肿瘤宽度×肿瘤宽度/2;抑瘤率=(1-T/C)×100%;脾脏指数=脾脏质量(mg)/体质量(g)。公式中:C为对照组平均瘤重(g);T 为实验组平均瘤重(g)。
2.2 对小鼠4T1乳腺癌肺转移的影响
取生长良好的4T1乳腺癌传代实体瘤组织,用组织匀浆器制备单细胞悬液,调细胞数5×106/mL,按0.2mL/只接种于小鼠左侧第二乳房垫上。将30只接种肿瘤的小鼠,随机分为3组,每组10只。对照组:蒸馏水0.4mL/只灌胃给药;巴豆霜组:巴豆霜混悬液50mg/kg灌胃给药;水煎液组:水煎液50mg/kg灌胃给药。1次/d,连续3周,每日监测小鼠体质量。治疗结束次日,剥离肺脏,用10倍放大镜计数肺转移结节数。剥离脾脏,称重,计算脾脏指数。
2.3 对荷4T1乳腺癌小鼠碳粒廓清能力的影响
肿瘤接种、分组给药方法同4T1乳腺癌模型。每日测小鼠体质量,治疗结束次日,从小鼠眶静脉采血20μL,吹入体积分数0.1%NaHCO32mL中,以等容量小鼠正常血溶于体积分数0.1%NaHCO3 2mL作为空白对照,用ELX 800型酶标仪630nm处测吸光度(A),计算廓清指数K及吞噬系数α。
廓清指数K=(logA1-logA2)/(T2-T1);吞噬分别为1min和10min吸光度,T1、T2分别为1min、10min。
2.4 对荷瘤小鼠体内抗氧化酶及脂质过氧化产物形成的影响
2.4.1 血清中SOD的测定 采用肾上腺素法,原理是肾上腺素在碱性溶液中自氧化产生的肾上腺素红在480nm有吸收峰,SOD能抑制肾上腺素自氧化,肾上腺素自氧化减少的程度代表SOD酶的活性。
2.4.2 血清中GSH-PX的测定 采用DTNB法,原理是谷胱甘肽过氧化物酶(GSH-PX)可以促进H2O2与还原型谷胱甘肽(GSH)反应生成水及氧化型谷胱甘肽(GSSG),而GSH可以和二硫代二硝基苯甲酸(显色剂DTNB)作用生成5-硫代二硝基苯甲酸阴离子,呈现较稳定的黄色,在412nm有最大吸收峰,以GSH消耗程度代表GSH-PX酶活性。
2.4.3 血清中H2O2的测定 在辣根过氧化物酶(HRP)存在下,酚红被过氧化氢氧化后颜色由红变黄,当pH升至12.5左右时,黄色变为紫红色,可保持较长时间不变,于490nm测OD值。
2.4.4 血清中MDA的测定 采用TBA法,原理是过氧化脂质降解产物中的丙二醛(MDA)可与硫代巴比妥酸(TBA)缩合,形成红色产物,在532nm处有最大吸收峰。
2.5 统计方法
用SPSS 11.0软件进行分析。计量资料采用均数±标准差表示,两样本均数比较采用t检验,P<0.05,有统计学意义。
3 结果
3.1 对小鼠Lewis肺癌皮下移植肿瘤及免疫器官的影响
巴豆霜灌胃有抑制肿瘤生长的作用,巴豆水煎液口服给药对肿瘤生长的抑制作用不明显;与对照组比较,巴豆霜灌胃组脾脏指数增加明显,巴豆水煎液组有增加趋势。整个实验过程小鼠生长状态良好,见表1。
3.2 对小鼠4T1乳腺癌肺转移及免疫器官的影响
与对照组相比,巴豆霜和巴豆水煎液灌胃能明显减少肺转移率和转移结节数,对脾脏指数无显著影响。整个实验过程小鼠生长状态良好,见表2。
3.3 对荷4T1乳腺癌小鼠碳粒廓清能力的影响
与对照组比较,巴豆霜组降低荷瘤小鼠碳粒廓清能力,巴豆水煎液组对荷瘤小鼠碳粒廓清能力有降低趋势,二者都有增加肝脏指数趋势,见表3。
3.4 对荷瘤小鼠体内抗氧化酶及脂质过氧化产物形成的影响
巴豆霜和巴豆水煎液对荷Lewis肺癌小鼠有增强SOD及GSH-PX酶活性作用,虽然2种治疗方式均引起MDA增加,但对H2O2水平无影响,见表4。在对荷4T1乳腺癌小鼠中,巴豆霜和巴豆水煎液抑制SOD和GSH-PX酶活性,不显著影响 MDA和H2O2水平,见表5。
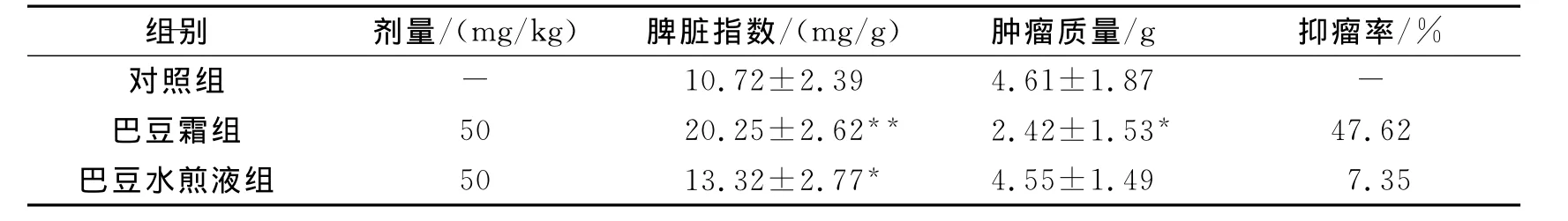
表1 巴豆对小鼠Lewis肺癌皮下肿瘤生长的影响(¯x±s,n=10)

表2 巴豆对小鼠4T1乳腺癌肺转移的影响(¯x±s,n=10)

表3 巴豆对荷4T1乳腺癌小鼠碳粒廓清的影响(¯x±s,n=10)

表4 巴豆对荷Lewis肺癌小鼠抗氧化酶的影响(¯x±s,n=10)

表5 巴豆对荷4T1乳腺癌小鼠抗氧化酶的影响(¯x±s,n=10)
4 讨论
民间早已用巴豆治疗肿瘤,其提取物对甲状腺癌、胃癌、肝癌等多种肿瘤具有治疗作用[3]。巴豆能缓解晚期胃癌患者症状,使病程进展缓慢,病灶明显缩小后,癌细胞能转化为正常细胞[4]。Morales等[5]发现巴豆中的二萜成分可诱导MCF-7乳腺癌细胞凋亡。本次实验结果显示,巴豆霜灌胃给药抑制实体瘤生长,同浓度巴豆水煎液口服作用不明显,但二者都能抑制肿瘤转移,证明巴豆有抗肿瘤作用,其抗肿瘤活性与药物处理方式有关。
脾脏是人体最大的外周免疫器官,在机体防御系统中,尤其在抗肿瘤免疫方面占有十分重要的地位[6]。巴豆霜或巴豆水煎液灌胃给药均可增加脾脏指数,巴豆中可能含有刺激脾脏细胞增殖的成分,但二者均有降低荷瘤小鼠碳粒廓清能力的作用或趋势,表明巴豆的免疫调节与其抗肿瘤活性没有必然的联系。实验中巴豆霜和巴豆水煎液对荷Lewis肺癌小鼠有增强SOD及GSH-PX酶活性作用,对荷4T1乳腺癌小鼠中却抑制SOD和GSH-PX酶活性,提示巴豆的调节机体抗氧化功能作用也与其抗肿瘤活性无关。巴豆中的抗肿瘤成分和抗肿瘤机制需进一步研究。
[1]查道成,吴立明.论药毒与癌毒[J].陕西中医,2004,25(3):267-269.
[2]万莉,周振海.巴豆的药理研究进展[J].江苏中医药,2003,24(17):60-61.
[3]徐春,汤德元,曾智勇,等.浅谈大黄和巴豆的药理作用研究[J].世界农业,2007,343(11):52-55.
[4]许冬青,王明艳,瞿融.巴豆生物碱对人胃腺癌细胞SGC-7901Fas基因表达影响的研究[J].中医药学报,2005,33(2):9-10.
[5]Morales A,Perez P,Mendoza R.Cytotoxic and proapoptotic activity of ent-16β-17α-dihydroxykaurane on human mammary carcinoma cell line MCF-7[J].Cancer Lett,2005,218(1):109-116.
[6]姜从桥.如何看待脾脏的抗肿瘤功能[J].中华普通外科学文献,2008,2(6):444-445.

