应用蛋白质组技术筛选人食管癌细胞系9706顺铂耐药相关蛋白
晁玮霞,刘 琳,卜旺雨,张 娟,侯艳芳,高小飞,牛保华,马远方,齐义军*
(1河南大学医学院 细胞与分子免疫学重点实验室,河南 开封475004;2河南大学医学院 机能实验室,河南 开封475004;3河南职工医学院 护理教研室,河南 郑州451191)
食管癌(esophageal cancer,EC)的发病率和死亡率在世界上分别列第7位和第6位,全球每年至少有40万EC死亡病例,约有一半发生在中国[1-2]。与欧美等发达国家发生的EC组织学类型以腺癌为主的不同,中国的EC 90%属食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)[3]。目前对 EC采用以手术治疗为主、放疗和化疗为辅的综合治疗措施,但EC愈后极差,约有50%的EC患者在术后的2~3a内复发[4],5a生存率小于10%[5]。EC愈后差的主要原因为:首次确诊的EC约有一半已发展至中晚期;肿瘤细胞具有较强侵袭性;化疗过程中获得多药耐药性等。目前,临床普遍采用顺铂(cis-diamminedichloroplatinum,CDDP)和5-氟尿嘧啶(5-FU)的标准化疗方案治疗EC,而多药耐药性是临床EC化疗失败的最主要原因之一。因此,建立人食管癌顺铂耐药细胞系、筛选耐药相关蛋白、探讨耐药作用相关分子机制,对寻找逆转食管癌耐药性的分子靶点具有重要理论意义和应用价值。
本研究以食管鳞癌细胞系EC9706为细胞模型,采用CDDP浓度递增法、间歇作用方式建立了EC9706顺铂耐药细胞系(EC9706/CDDP),细胞培养稳定同位素标记(cell culture and stable isotope labeling,SILAC)、质谱(mass spectrometry,MS)筛选和鉴定食管癌耐药相关的蛋白,以揭示食管癌耐药性发生的分子机制和提供食管癌耐药性逆转有意义的分子靶点。
1 材料和方法
1.1 试剂
顺铂(CDDP)、四甲基偶氮唑蓝(MTT)购自美国Sigma公司;RPMI1640培养基购自Gibco/BRL公司;胎牛血清购自四季青;NUPAGE 120g/L Bis-tris gel和SILACTM标记试剂盒购自Invitrogen。
1.2 方法
1.2.1 细胞系、细胞培养以及EC9706/CDDP的建立 EC9706由本室冻存,细胞复苏后在含体积分数为10%胎牛血清及青霉素、链霉素各100U/mL的RPMI1640培养基中,置37℃、体积分数为5%CO2、饱和湿度的培养箱中培养。细胞生长良好达80%汇合度,用体积分数为0.25%胰酶消化传代,待细胞贴壁后,加入含0.25mg/L CDDP的RPMI1640培养基培养48h,更换为不含CDDP的培养基继续培养,待细胞生长稳定后,再次加入含0.25mg/L CDDP的RPMI1640培养基培养。如此反复处理至细胞耐受该浓度后,依次加大浓度→0.5mg/L 5次→1mg/L 5次→2mg/L 5次[6],建立 EC9706/CDDP并继续在含0.5mg/L CDDP的RPMI1640培养基中培养。
1.2.2 MTT法测定EC9706/CDDP对CDDP的敏感性 取对数生长期细胞EC9706/CDDP及敏感母系细胞EC9706,调整细胞密度为1×104/mL,以200μL/孔加入96孔板,24h后换为含不同浓度CDDP的RPMI1640培养基培养,每一浓度作3平行孔,并设空白对照。培养72h后,常规 MTT法检测,酶标仪于波长550nm处测吸光度 (A)值,重复实验3次。计算相对抑制率(%)=(1-加药孔A值/对照孔A值)×100%,IC50为50%细胞生长受抑制时的药物浓度,耐药指数(RI)=(EC9706/CDDP)IC50/(EC9706)IC50[3]。
1.2.3 SILAC培养并标记 取对数期生长良好的细胞,消化传代,分别用含 [U-13C6]-H-Lysine和[U-13C6]-H-Arginine (重 型)、[12C6]-L-Lysine 和[12C6]-L-Arginine(轻型)的 RPMI1640培养基培养标记EC9706、EC9706/CDDP细胞。根据供应商建议,传代比例为1∶10,至少传代6次保证细胞标记完全。
1.2.4 细胞收集并裂解 胰酶消化标记完全的EC9706、EC9706/CDDP细胞,PBS洗涤3次,最后将混悬液收集到1.5mL Ep管中,4 000r/min,离心10min,弃去洗液,加入含有蛋白酶抑制剂的完全裂解液200μL,冰上裂解30min,13 200r/min,离心15min,将上清蛋白提取物转移到另一洁净Ep管,BCA法测定2种细胞蛋白提取物浓度。分别从EC9706、EC9706/CDDP各取200μg蛋白混合后,-80℃保存。
1.2.5 蛋白电泳、蛋白胶内胰酶消化和串联质谱分析 为减少蛋白污染,用 NUPAGE 120g/L Bis-tris gel进行EC9706、EC9706/CDDP混合蛋白电泳。电泳后胶体金考马斯亮兰染色,根据蛋白条带染色程度,将含有蛋白的胶条分为50份,胶内胰酶消化、电喷雾串联质谱检测、生物信息学分析、检索国际蛋白质索引(international protein index,IPI)人类蛋白质数据库,确定蛋白名称并计算差异表达蛋白的比值。
2 结果
2.1 EC9706/CDDP对CDDP的耐药指数
图1显示了在空白对照培养基和含有0.25mg/L至8mg/L CDDP的RPMI1640培养基中培养72h后EC9706和EC9706/COOP细胞的存活曲线,EC9706/CDDP的RI为3.23。
2.2 EC9706/CDDP耐药相关蛋白
胶内胰酶消化后洗脱的肽段经电喷雾串联质谱检测检测,检索匹配IPI人类蛋白质数据库,共鉴定到1 380个蛋白。根据我们研究确定的选取耐药相关蛋白标准,即差异倍数大于2并检测到每个候选蛋白的2个以上非重复的特异肽段。我们研究共鉴定出耐药相关的74种差异表达蛋白,包括53种蛋白的表达在EC9706/CDDP升高,21种蛋白表达降低。表1显示了在EC9706/CDDP中表达升高的前10种蛋白,表2显示了在EC9706/CDDP中表达降低的前10种蛋白。
2.3 蛋白功能分类
经GO分类分析表明,差异表达的蛋白质分子主要包括细胞骨架相关蛋白(20%)、能量代谢相关蛋白(11%)、转录调控及DNA修复相关蛋白(11%)、氧化还原内稳态维持类蛋白(9.5%)、蛋白合成及参与mRNA处理类蛋白(12%)、核糖体结构类蛋白(8.1%)、分子伴侣蛋白(8.1%)、免疫/炎症反应相关蛋白(5.4%)、细胞内转运功能相关蛋白(5.4%)、核组装相关蛋白(2.7%)等。
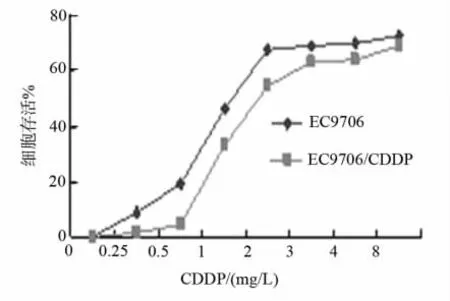
图1 EC9706和EC9706/CDDP在不同浓度CDDP的RPMI1640培养基中培养72h后细胞存活曲线
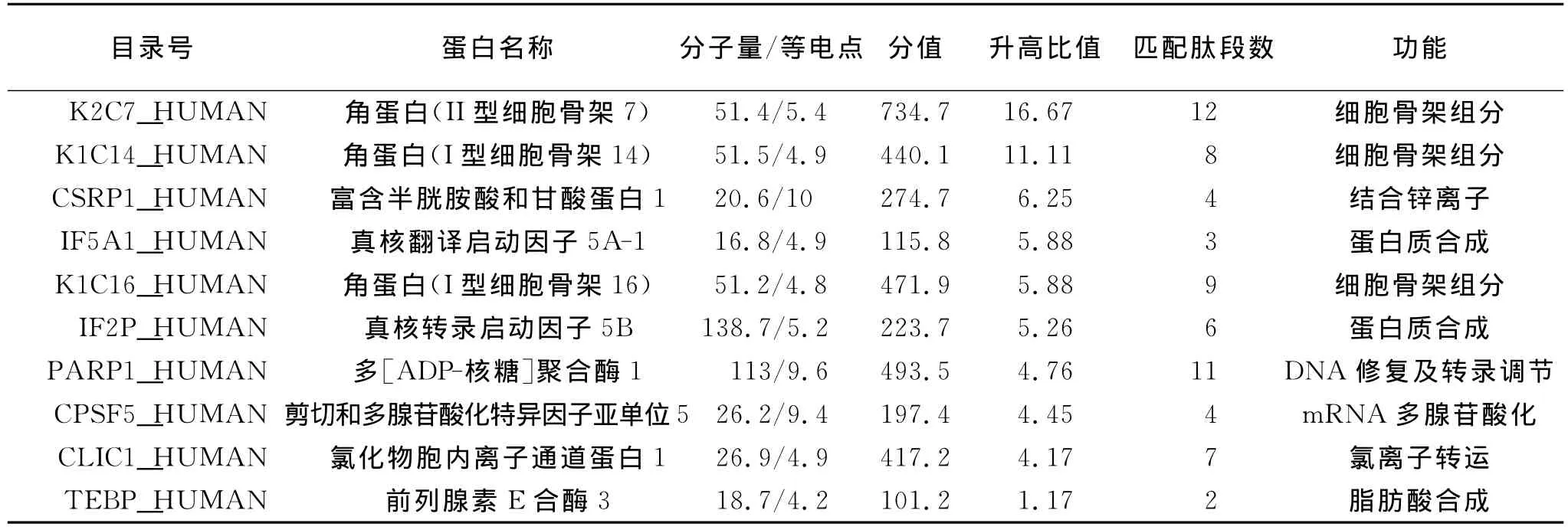
表1 EC9706/CDDP中高表达的前10种蛋白
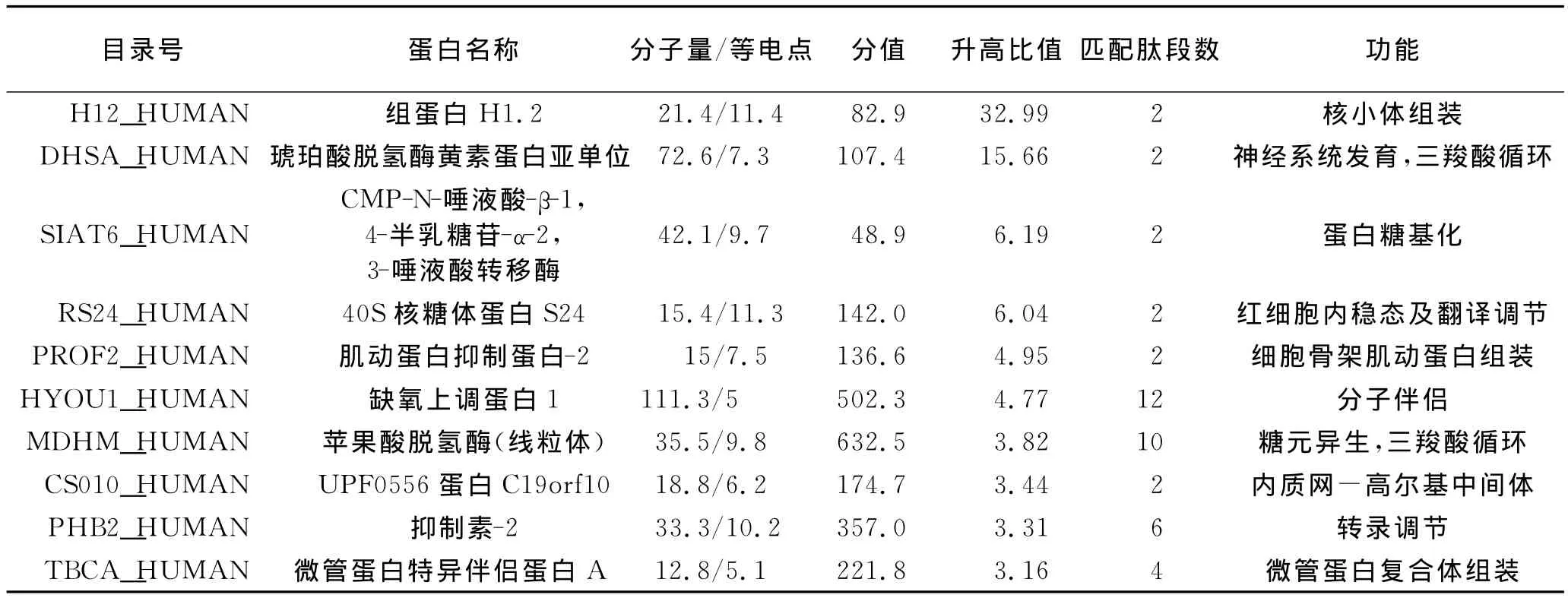
表2 EC9706/CDDP中低表达的前10种蛋白
3 讨论
CDDP是临床上较常用的化疗药物,常与其他化疗药物联合应用。CDDP对细胞周期的毒性作用具有非特异性,所以抗癌谱广,可抑制DNA的复制、RNA转录、蛋白质翻译而引起细胞死亡[7]。然而,肿瘤细胞天然的或在肿瘤化疗过程中获得的耐药性,导致药物到达靶部位的浓度降低,或肿瘤细胞内解毒系统、DNA损伤修复能力及抗凋亡系统能力的增强,最终化疗失败[8]。
以往探讨CDDP耐药分子机制的研究多集中于DNA或RNA水平,但是这些基因或转录分子事件的发生与蛋白表达缺乏相对应关系,客观上需要在蛋白水平探讨CDDP耐药机制。蛋白质组学是后基因组时代的一门新学科,是在蛋白质水平上定量、动态、整体性地研究生物体。它旨在阐明生物体全部蛋白质的表达模式及功能模式,其内容包括蛋白质的定性鉴定、定量检测、细胞内定位、相互作用研究等,最终揭示蛋白质功能,是基因组DNA序列与基因功能之间的桥梁。SILAC是在细胞培养过程中利用稳定同位素标记氨基酸结合质谱技术对蛋白表达进行定量分析的一种新技术,不仅可以对蛋白质进行定性分析,还可精确定量,具有样本需求量少、操作简单、直接、高效等特点。我们以顺铂诱导的耐药食管鳞癌细胞系EC9706/CDDP及其来源的敏感母细胞系EC9706为对象,采用SILAC和串联质谱技术比较2种细胞蛋白表达谱的差异,寻找食管鳞癌耐药相关蛋白,结果鉴定出差异2倍以上74种与食管鳞癌耐药相关蛋白,按照功能分类,这些蛋白归属为10个家族。74种差异表达的蛋白包括在EC9706/CDDP中表达升高的53种及表达降低的21种蛋白。
综上所述,我们应用SILAC和质谱鉴定蛋白技术,定量分析了EC9706/CDDP和EC9706的差异表达蛋白,并鉴定74种与食管癌CDDP耐药相关的差异表达的蛋白质分子。这些蛋白质分别属于不同的家族,具有多种生物学功能,表明肿瘤耐药是涉及多种代谢环节、多个信号传导通路紊乱的复杂过程,而这些差异蛋白在CDDP耐药中的具体生物学功能及分子机制,我们正在进行更深入的研究来证实。这些蛋白对进一步阐明多药耐药的分子机制具有重要理论意义,并为逆转多药耐药表型的药物设计提供了新的分子靶点。
[1]Parkin D M,Bray F,Ferlay J,et al.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(2):74-108.
[2]Holmes R S,Vaughan T L.Epidemiology and pathogenesis of esophageal cancer[J].Semin Radiat Oncol,2007,17(1):2-9.
[3]Li L W,Li Y Y,Li X Y,et al.A novel tumor suppressor gene ECRG4interacts directly with TMPRSS11A(ECRG1)to inhibit cancer cell growth in esophageal carcinoma[J].BMC Cancer,2011,11(52):1-7.
[4]Nakagawa S,Kanda T,Kosugi S,et al.Recurrence pattern of squamous cell carcinoma of the thoracic esophagus after extended radical esophagectomy with three-field lymphadenectomy[J].J Am Coll Surg,2004,198(2):205-211.
[5]Lightdale C J.Esophageal cancer.American College of Gastroenterology[J].Am J Gastroenterol,1999,94(1):20-29.
[6]薛英威,韩继广,李宝馨,等.三氧化二砷对胃癌细胞SGC7901多药耐药的逆转作用及其机制[J].药学学报,2007,42(9):949-953.
[7]Sorenson C M,Barry M A,Eastman A.Analysis of events associated with cell cycle arrest at G2phase and cell death induced by cisplatin[J].J Natl Cancer Inst,1990,82(9):749-755.
[8]Siddik Z H.Cisplatin:mode of cytotoxic action and molecular basis of resistance[J].Oncogene,2003,22(47):7 265-7 279.

