超声造影预测≤3 cm胰腺导管腺癌
桂 阳,陈雪琪,吕 珂,谭 莉,张 璟,孝梦甦,陈天娇,李京璘,贾琬莹,李建初,姜玉新
(中国医学科学院 北京协和医学院 北京协和医院超声医学科,北京 100730)
胰腺导管腺癌(pancreatic ductal adenocarcinoma, PDAC)恶性度高,患者5年生存率低于10%[1];早期诊断和治疗PDAC对改善预后具有重要价值[2]。超声造影(contrast enhanced ultrasound, CEUS)可敏感显示肿瘤内部及周围组织血流灌注速度、微血管分布等特点,为定性诊断肿瘤提供参考,其诊断PDAC的敏感度为75%~88%[3]。本研究评价CEUS预测最大径≤3 cm PDAC的价值。
1 资料与方法
1.1 研究对象 回顾性分析2017年9月—2021年4月75例于北京协和医院就诊的胰腺局灶实性病变患者,男40例,女35例,年龄18~81岁,中位年龄61.0岁;共75个病灶。纳入标准:①胰腺病灶超声检查前未经治疗;②最大径≤3 cm;③经病理证实或临床诊断(良性病变要求临床及影像学随访12个月以上无明显进展);④存在多发病灶时,仅纳入其中最大者。检查前患者均签署知情同意书。
1.2 仪器与方法 采用Philips iU22/Epic7彩色多普勒超声仪,凸阵探头,频率2~5 MHz。嘱患者仰卧,由2名具有5年以上超声造影诊断经验的超声科医师常规扫查胰腺病灶,记录病灶部位、最大径、回声及边界等。之后将造影剂声诺维加入5 ml生理盐水振荡混匀,经肘正中静脉注射2.4 ml混悬液;启动低机械指数实时谐波CEUS模式,于相同切面同时显示病灶与非胰瘤胰腺实质,连续观察病灶增强及廓清过程120 s;以非瘤胰腺组织为参考,评估动脉期(10~30 s)及静脉期(31~120 s)病灶增强强度(低/等/高增强)及均匀性(均匀/不均匀)[4],根据有效面积较大者判断不均匀增强病灶增强程度。廓清模式:极快速,动脉期病灶内造影剂灌注明显消退;快速,静脉期病灶内造影剂灌注消退快于正常胰腺实质;缓慢,静脉期病灶内造影剂灌注消退等于或慢于正常胰腺实质;同步等增强及减退,病灶增强和廓清快慢及程度与正常胰腺实质全程一致。由2名5年以上CEUS诊断经验的医师分别读片评价,意见存在分歧时,经讨论达成一致。
1.3 统计学分析 采用SPSS 21.0统计分析软件。以中位数(上下四分位数)表示不符合正态分布的计量资料,组间比较行Mann-WhitneyU检验;以频数表示计数资料,组间比较行χ2检验或Fisher精确概率法。绘制受试者工作特征(receiver operating characteristic, ROC)曲线,计算曲线下面积(area under the curve, AUC),评价CEUS表现预测PDAC的效能。P<0.05为差异有统计学意义。
2 结果
75例胰腺局灶实性病变中,47例为PDAC(PDCA组),28例为非PDAC(非PDAC组),其基本资料及诊断结果见表1、2。
2.1 常规超声 75例胰腺局灶实性病变均表现为低回声;位于胰头22例、钩突9例、胰颈15例,胰体/胰尾29例;最大径0.9~3.0 cm,中位数2.40(2.10,2.80)cm;26.67%(20/75)边界清晰,73.33%(55/75)边界模糊。
2.2 CEUS 动脉期57.33%(43/75)病灶呈低增强、33.33%(25/75)呈等增强、9.33%(7/75)呈高增强,81.33%(61/75)均匀、18.67%(14/75)呈不均匀增强;11例PDAC及1例肺癌转移癌中心部见极低增强区,1例SPN及1例SCN病灶边缘见少许无增强区。静脉期81.33%(61/75)病灶呈低增强、8.00%(6/75)等增强、10.67%(8/75)呈高增强;6.67%(5/75)表现为极快速廓清、58.67%(44/75)快速廓清、32.00%(24/75)缓慢廓清,2.67%(2/75)表现为同步廓清。见表1及图1、2。

图1 患者女,67岁,PDAC A.CEUS动脉期(16 s)图示胰腺病灶呈等增强; B.CEUS动脉期(28 s)图示病灶快速廓清; C.CEUS静脉期(80 s)图示病灶呈低增强 (箭示病灶)
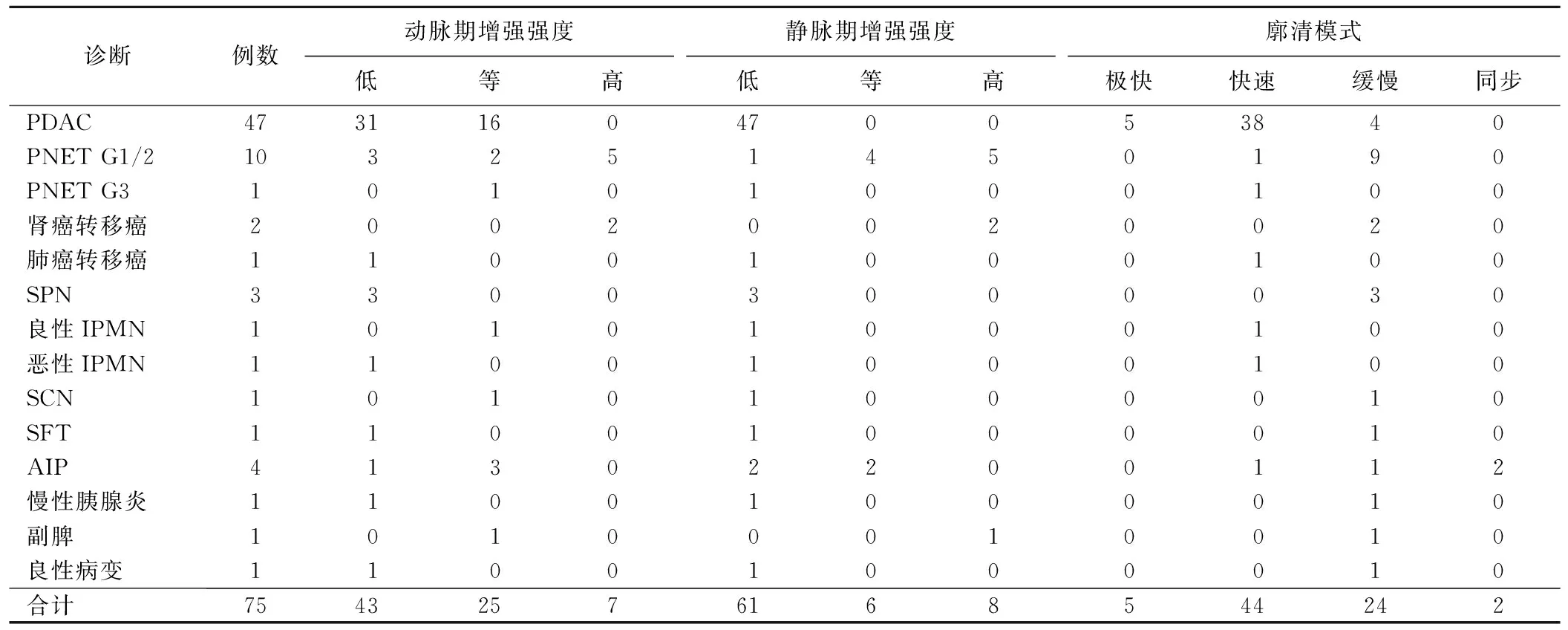
表1 75例胰腺局灶实性病变CEUS表现及最终诊断结果(例)
2.3 组间比较 PDAC组患者年龄显著高于非PDAC组(P<0.05),组间性别无显著差异(P>0.05)。PDAC组病灶最大径显著高于非PDAC组(P<0.05)。PDAC组病灶多边界模糊(43/47,91.49%),动脉期(31/47,65.96%)、静脉期(47/47,100%)多呈低增强,且多呈极快速或快速廓清(43/47,91.49%);非PDAC组病灶多边界清晰(16/28,57.14%),动脉期(16/28,57.14%)多呈等或高增强,静脉期呈低增强及等/高增强各半,廓清模式多为缓慢或同步廓清(22/28,78.57%)。组间边界清晰度、静脉期增强程度及廓清模式差异均有统计学意义(P均<0.05),动脉期增强程度差异无统计学意义(P=0.050),见表2。
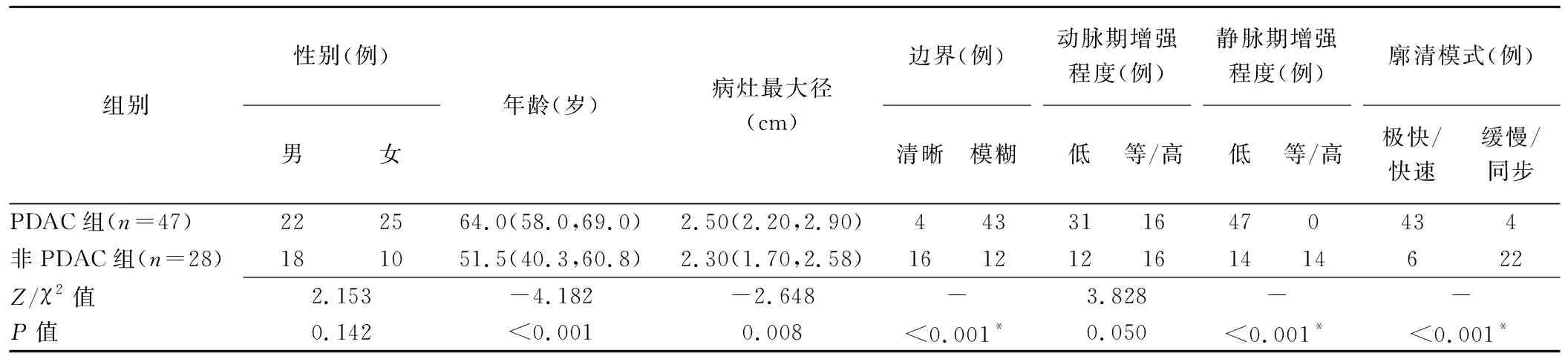
表2 PDAC组和非PDAC组基本资料及CEUS表现比较
2.4 预测效能 根据造影剂极快/快速廓清及静脉期低增强预测PDAC的AUC分别0.850及为0.750,敏感度分别为91.49%及100%,特异度分别为78.57%及50.00%,准确率分别为86.67%及81.33%,阳性预测值分别为87.76%及77.05%,阴性预测值分别为84.62%及100%,见图3。
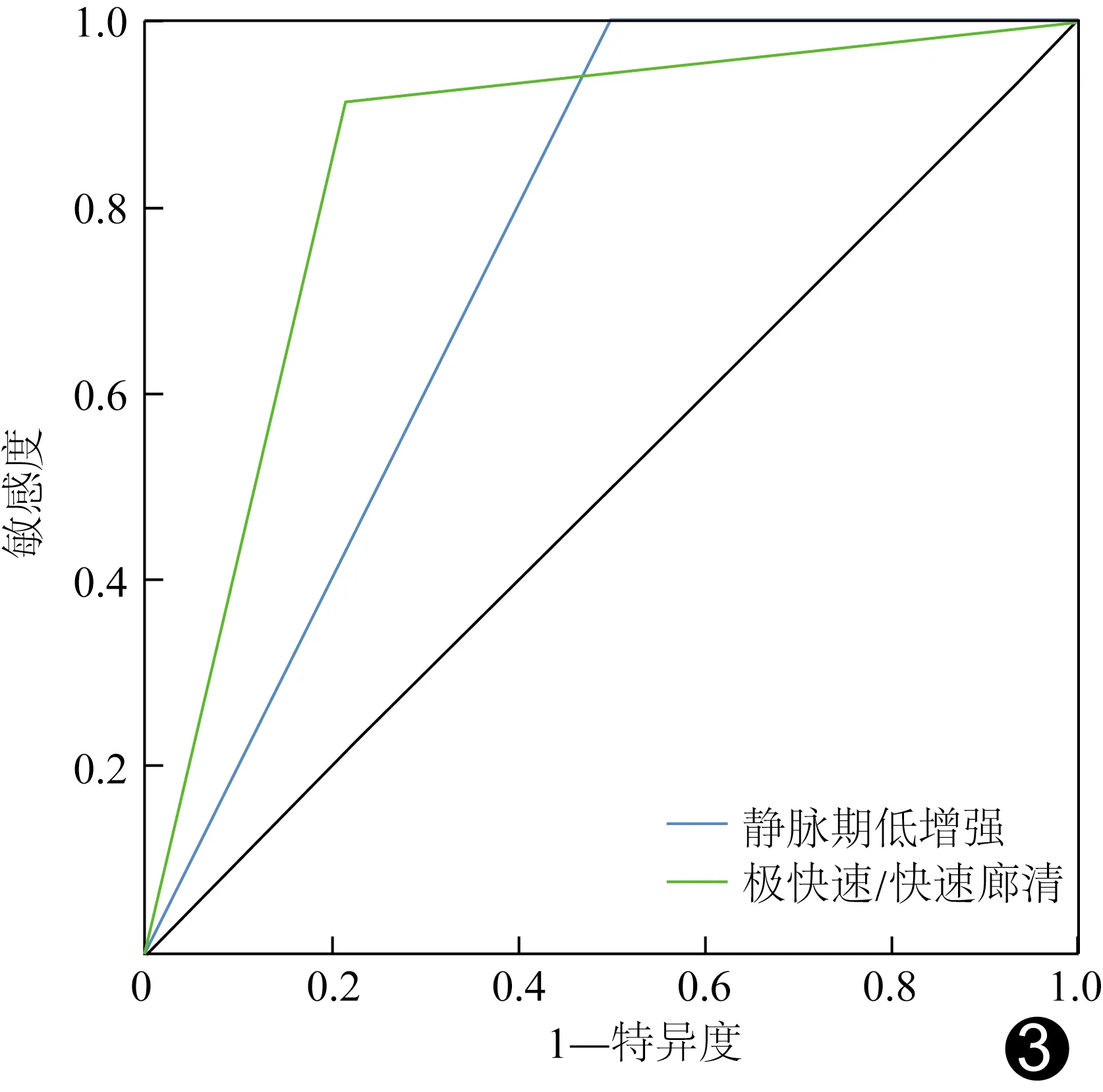
图3 CEUS静脉期低增强和造影剂极快速/快速廓清预测PDAC的ROC曲线
3 讨论
典型PDAC病灶内纤维化严重,血管密度低,约90%在CEUS中表现为全时相低增强[4],但较小病灶的增强特征可能存在不同。本组PDAC最大径均≤3 cm,在CEUS动脉期,其中65.96%(31/47)呈低增强、34.04%(16/47)呈等增强,动脉期增强程度与非PDAC无显著差异。本研究根据静脉期低增强诊断PDAC的敏感度虽然较高(100%),但其特异度仅50.00%,原因在于良性病变静脉期亦可呈低增强[5];而恶性病变存在动静脉瘘,可使造影剂快速廓清[6],根据造影剂极快/快速廓清模式预测PDAC具有较高的敏感度(91.49%)及特异度(78.57%),尤其动脉晚期极快速廓清模式高度提示PDAC,但肺癌转移癌、高级别PNET等恶性病变亦可呈快速廓清模式。SOFUNI等[3]认为不均匀增强及早期廓清均为恶性征象。本研究中12例动脉期中心不均匀极低增强病灶均为恶性病变。
CEUS有助于鉴别诊断PDAC与肿块型AIP,后者多表现为同步等增强,但存在差异,可能与病变炎症及纤维化程度不同有关。肿块型AIP病灶内纤维化明显时,CEUS动脉期可呈低增强而难以与PDAC鉴别,此时更需重视廓清模式。炎性病灶多无血管重建及动静脉瘘,且部分合并血管炎,故多不出现造影剂快速廓清;但本组1例AIP呈快速廓清、1例呈缓慢廓清,需结合胰腺外表现,如有无胆总管下段厚壁性狭窄、胆囊壁增厚及脾大等进行鉴别。
典型PNET动脉期呈等或高增强,但部分病灶纤维含量高、微血管密度低,亦可呈低增强[7]。本组27.27%(3/11)PNET于CEUS动脉期呈低增强。不同级别PNET之间,治疗方式及患者预后存在明显差异。本组CEUS中G3期PNET均见造影剂快速廓清、静脉期呈低增强,90.00%(9/10)G1/2期PNET呈缓慢廓清、静脉期呈等或高增强,与黄京智等[8]的结果相似,提示胰腺肿物于CEUS动脉期呈低增强、静脉期呈缓慢廓清及延迟增强多提示PNET。
SCN以大囊型多见,少数病灶在囊液消失后超声表现为假实性或实性[9],应与其他实性占位相鉴别。既往研究[10]显示,CEUS中,SCN全时相呈等或高增强;本研究中仅1例SCN静脉期呈明显低增强,但动脉期病灶边缘存在少许无增强区,提示可能为囊性病变。SPN为低度恶性肿瘤,好发于年轻女性;其CEUS表现多样,包膜增强及病灶内血管影为典型征象,但在小病灶常不明显[11]。本研究中3例SPN均无上述表现,CEUS动、静脉期均呈低增强,强度差异小,提示造影剂廓清极为缓慢;且SFT及随访为良性的病变同样可见相似表现。
综上所述,CEUS可实时评价胰腺局灶实性病变的微血流灌注情况,其中造影剂极快速/快速廓清诊断最大径≤3 cm的PDAC效能较高,优于静脉期低增强表现。但本研究为单中心回顾性研究,样本量小,良性病例更少,且部分胰腺肿瘤临床及影像学表现不典型,可能对结果造成影响,有待后续进一步完善。

