静息态功能MRI观察帕金森病伴疲劳患者局部一致性及功能连接
操 纵,余永强*,陈先文,王尚培
(1.安徽医科大学第一附属医院放射科, 2.神经内科,安徽 合肥 230022)
疲劳是帕金森病(Parkinson disease, PD)常见症状之一,于病程早期即可出现;且一旦出现PD伴疲劳(PD with fatigue, PD-F)往往持续发展,并呈随时间推移而加重趋势[1]。基于血氧水平依赖(blood oxygenation level dependent, BOLD)静息态功能MRI(functional MRI, fMRI)广泛用于疲劳、抑郁等PD并发症的病理生理机制相关研究[2-3]。计算脑区局部一致性(regional homogeneity, ReHo)[4]是评估局部脑区分离功能的常用方法;而功能连接(functional connectivity, FC)可反映不同脑区之间的整合功能[5]。有关PD-F的神经环路主要涉及岛叶局部脑区[6-7]和与后扣带回之间的脑功能网络[8]。本研究计算PD-F患者的ReHo值,并针对ReHo异常脑区构建ROI,行全脑体素水平FC分析,探索PD-F的病理生理机制。
1 资料与方法
1.1 一般资料 收集2019年9月—2020年12月于安徽医科大学第一附属医院就诊的58例汉族原发性PD患者,男31例,女27例,年龄35~79岁,平均(58.2±10.4)岁;均为右利手,经资深专业运动障碍性疾病主任医师按照中国PD最新版诊断标准[9]确诊PD。同期于附近社区招募35名年龄、性别相匹配的汉族右利手健康对照者(health control, HC),男13名,女22名,年龄41~78岁,平均(59.8±9.9)岁。排除标准:①进行性核上性眼肌麻痹、多系统萎缩等其他帕金森综合征;②合并疲劳的其他系统性疾病(如心力衰竭、甲状腺功能减低症、多发性硬化等);③MRI示颅内明显异常或多发病灶等;④认知障碍;⑤合并严重抑郁、焦虑等精神疾患;⑥存在MR扫描禁忌证。本研究通过本院伦理委员会审批(伦理号:PJ2021-07-01)。测试前受试者均签署知情同意书。
1.2 方法
1.2.1 资料收集 详细记录PD患者服用抗PD药物情况,根据临床等效剂量计算公式[10]换算为左旋多巴每日等效剂量(levodopa equivalent daily dose, LEDD)。采用统一PD量表第三部分(unified Parkinson disease rating scale-Ⅲ, UPDRS-Ⅲ)评估患者运动症状。以简易精神状态检查(mini-mental state examination, MMSE)评估认知功能。
以疲劳严重程度量表(fatigue severity scale, FSS)评估PD患者是否存在疲劳及其程度[11],由此将其分为PD-F组和PD不伴疲劳(PD without fatigue, PD-NF)组。FSS每项分值从1分(非常不同意)到7分(非常同意)。将9项总分除以9为界定疲劳及非疲劳的阈值,以>4分PD患者为PD-F,≤4分为PD-NF。
1.2.2 MR扫描 检查前患者停用抗PD药物12 h以上,检查过程中受试者需保持清醒,安静,闭眼。采用GE Discovery MR750w 3.0T MR扫描仪,24通道相控阵头颈联合线圈,行高分辨三维T1W脑容积成像(brain volume imaging, BRAVO),TR 8.5 ms,TE 3.2 ms,TI 450 ms,FA 12°,FOV 256 mm×256 mm,矩阵256×256,层厚1 mm,层间隔0,共188层,扫描时间296 s。以单次激发梯度平面回波(gradient echo-single shot-echo planar imaging, GRE-SS-EPI)序列采集静息态fMR,TR 2 000 ms, TE 30 ms,FA 90°,FOV 220 mm×220 mm,矩阵64×64,层厚3 mm,层间隔1 mm,共35层,连续采集185个时间点,扫描时间370 s。
1.2.3 处理数据 基于Matlab R2013b上运行的SPM12(http://www.fil.ion.ucl.ac.uk/spm)和DPARSFA软件包[12](DPABI_V5.0, http://rfmri.org/dpabi)对T1结构像数据和静息态fMRI数据行预处理:①转换数据格式;②删除前10个时间点的数据;③时间层校正;④头动校正,保证头部水平位移不超过3 mm,旋转角度不大于3°,计算帧位移量;⑤去除头动、白质信号、脑脊液信号等混杂变量;⑥带通滤波,频率范围为0.01~0.08 Hz;⑦空间标准化:先将受试者结构像配准到其平均功能像上,变换后的结构像被分割成灰质、白质和脑脊液3部分,以仿射变换联合高阶非线性分割配准方法将分割出的灰质图像配准到蒙特利尔研究所(Montreal Neurological Institute, MNI)标准空间组织概率模板上,再将配准得到的参数应用于功能像上,得到该受试者在MNI空间标准化后的功能像,将其体素大小重采样为3 mm×3 mm×3 mm。
1.2.4 计算ReHo值 计算指定体素与其相邻的26个其他体素的时间序列之间的肯德尔和谐系数(Kendall's concordance coefficient, KCC),生成单独ReHo图[13];将每个体素的KCC除以全脑KCC的均值,以减少个体差异带来的影响,并得出该体素标准化ReHo图;最后以4 mm半高全宽(full width at half maximum, FWHM)对标准化ReHo图行高斯平滑。
1.2.5 FC分析 将PD-F和PD-NF组间ReHo值差异显著且与FSS分值相关的脑区定义为ROI,并以之为FC分析的种子点,分析其时间序列与全脑其他体素之间的相关性,再对相关系数行FisherZ变换,使其符合正态分布。
1.3 统计学分析 采用SPSS 22.0统计分析软件。采用单因素方差分析比较3组间临床资料,以独立样本资料t检验比较PD-NF组病程、UPDRS Ⅲ、LEDD及FSS等。以χ2检验比较性别等计数资料。
以SPM 12软件包统计模块分析影像学数据。采用体素水平单因素方差分析比较3组ReHo图,两两比较行t检验。以t检验比较PD-F组与PD-NF组的FC。对方差分析和t检验均采用团块水平整体错误率(family wise error rate, FWER)行多重比较校正,体素水平P=0.001,校正后P<0.05为差异有统计学意义。
应用DPABI软件提取PD-F和PD-NF组间存在显著差异脑区的ReHo值,以SPSS 22.0软件对ReHo值与FSS分行Pearson相关分析。对PD-F组种子点与差异脑区提取的FC值行两独立样本t检验。P<0.05为差异有统计学意义。
2 结果
PD-F组29例,男13例,女16例,年龄38~77岁,平均(58.3±10.6)岁;PD-NF组29例,男18例,女11例,年龄38~75岁,平均(58.0±9.7)岁。
PD-F组、PD-NF组及HC组间性别、年龄、MMSE评分和帧位移量差异均无统计学意义(P均>0.05)。PD-F组与PD-NF组之间病程、UPDRS-Ⅲ评分和LEDD差异均无统计学意义(P均>0.05)。PD-F组FSS评分高于PD-NF组(P<0.01)。见表1。

表1 58例PD患者和35名HC临床资料比较
2.1 ReHo值比较 PD-F组右侧罗兰迪克岛盖(体素数54;峰值点MNI坐标60,0,15;峰t=-5.17)和右侧颞下回(体素数54;峰值点MNI坐标60,-51,-12;峰t=-4.60)ReHo值低于HC组(体素P=0.001,FWER校正P<0.05)。PD-NF组右侧颞下回(体素数42;峰值点MNI坐标51,-51,-21;峰t=-4.38)ReHo值低于HC组(体素P=0.001,FWER校正P<0.05)。PD-F组右侧罗兰迪克岛盖(体素数11;峰值点MNI坐标60,3,12;峰t=-4.46)ReHo值低于PD-NF组(体素P=0.001,FWER校正P<0.05)。见图1。

图1 3组间ReHo值差异脑区 A.PD-F组与HC组; B.PD-NF组与HC组; C.PD-F组与PD-NF组 (蓝色区域表示组间对比ReHo值减低的脑区)
2.2 相关性分析 PD-F组右侧罗兰迪克岛盖ReHo值与FSS评分呈负相关(r=-0.539,P<0.001)。
2.3 FC分析 以右侧罗兰迪克岛盖为种子点行全脑体素水平FC分析,PD-F组右侧罗兰迪克岛盖与双侧中扣带回(体素数126;峰值点MNI坐标0,-12,42;峰t=-4.64)的FC弱于PD-NF组(体素P=0.001,FWER校正P<0.05),见图2。
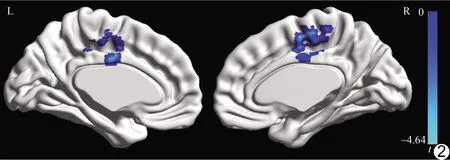
图2 PD-F组相比PD-NF组FC减弱脑区 蓝色区域表示功能连接减弱脑区
3 讨论
本研究发现PD-F患者右侧罗兰迪克岛盖ReHo值降低,其程度与疲劳严重程度相关,且右侧罗兰迪克岛盖与双侧中扣带回的FC减弱;PD患者右侧颞下回ReHo值降低。
PD等神经系统疾病伴发的中枢性疲劳包括躯体和精神疲劳[14],均为PD的独立症状,其发病机制可能不同:LOU等[15]认为PD患者躯体疲劳可能归因于震颤、肌肉强直等运动症状,而精神疲劳更大程度上与睡眠困难、情绪障碍等密切相关。目前对于抑郁等情绪障碍与疲劳之间的关联存在较多争议。作为PD常见非运动症状,抑郁和疲劳常有重叠,难以准确区分。一项纵向随访研究[16]报道了疲劳与抑郁症状之间的相关性,也有研究[17]认为疲劳可单独存在。
罗兰迪克岛盖参与抑郁、焦虑、应激等负向情绪的处理[18-20],而这些负向情绪与疲劳关系密切[1,15]。SUTOKO等[21]证实右侧罗兰迪克岛盖局部损伤导致抑郁样心理状态。ZHANG等[22]的结果证实右侧罗兰迪克岛盖在处理抑郁等负性情绪中具有关键作用。推测PD患者右侧罗兰迪克岛盖局部脑区功能异常在一定程度上参与疲劳症状的发生与进展。疲劳通常被定义为患者感觉难以启动或维持活动[23]。罗兰迪克岛盖-扣带回网络连接异常是产生疲劳等非特异性感觉的重要病理生理机制之一[24],GOODALE等[25]甚至将罗兰迪克岛盖列为第三感觉区,认为其是先于扣带回触发疲劳感觉网络的第一个激活脑区。本研究发现,作为疲劳等非特异性感觉网络的触发脑区,岛盖在PD-F患者的功能异常表现为右侧罗兰迪克岛盖ReHo值降低;而右侧罗兰迪克岛盖与双侧中扣带回FC减弱则在某种程度上反映岛盖与扣带回非特异性感觉网络内连接异常。颞下回是视觉处理关键脑区,而整合视觉信息对制定和协调肢体运动以及完成日常活动等任务必不可少[26-28]。PD患者因动作迟缓、肌肉强直等症状,制定和协调等运动功能明显受损。本研究结果显示PD患者右侧颞下回ReHo值降低,为上述研究结论提供了间接佐证。
利用静息态fMRI观察PD-F患者以脑功能网络为代表的脑区之间的连接整合功能是研究热点。TESSITORE等[28]采用独立成分分析法构建默认网络、感觉运动网络等脑功能网络观察20例首发未用药PD-F患者,发现不仅运动相关脑区,与情绪、认知相关的脑区之间的连接整合功能异常也在PD-F病理生理过程中具有显著作用。
本研究先从脑区局部分离功能角度、再从脑区之间连接整合功能角度对PD-F患者脑功能进行浅显剖析,探索PD-F的病理生理机制,具有一定局限性:①未关注PD-F与肌肉强直、情绪障碍等其他临床症状的关系;②为单中心研究,样本量小;③以FSS评分评价疲劳程度,具有一定主观性,且仅行横断面观察,有待完善。

